Характеристики цементного клинкера
Качество цементного клинкера может быть охарактеризовано численными значениями модулей, выражающих соотношения между количествами главных оксидов, взятыми в процентах по массе. Значения модулей оказываются численно одинаковыми как для клинкера, так и для сырьевой смеси, из которой этот клинкер получают.
Первоначально для характеристики состава клинкера пользовались гидравлическим модулем (иначе называемым основным). Он выражает отношение количества связанного оксида кальция к количеству кислотных оксидов:
 .
.
Значение основного модуля ОМ, обозначаемого также буквой m, у современных цементных клинкеров колеблется в пределах 1,7–2,4. В настоящее время качество клинкеров принято характеризовать коэффициентом насыщения КН, силикатным модулем СМ (или n) и глиноземным модулем ГМ (или p).
Коэффициент насыщения показывает отношение количества оксида кальция, фактически связанного с кремнеземом, к количеству его, теоретически необходимому для полного связывания оксида кремния в C3S:
 .
.
Коэффициент насыщения равен 1, если в клинкере образуется только C3S и совсем не образуется C2S; в обратном случае, когда весь оксид кальция связывается в C2S, КН = 0,64. Клинкеры заводского изготовления имеют КН от 0,85 до 0,95. Более высокий коэффициент насыщения свидетельствует о повышенном содержании в клинкере C3S. Это обусловливает высокие показатели прочности цементов и скорости твердения, но, с другой стороны, затрудняет спекание клинкера и увеличивает тепловыделение при гидратации.
|
|
|
При расчете сырьевых смесей пользуются упрощенной формулой коэффициента насыщения:
 .
.
Силикатный или кремнеземный модуль СМ (или n) показывает отношение между количеством кремнезема, вступившего в реакцию с другими оксидами, и суммарным содержанием в клинкере глинозема и оксида железа:
 .
.
Силикатный модуль характеризует соотношение минералов-силикатов и минералов-плавней, показывает количество расплава при обжиге. Его численное значение для обычного портландцемента колеблется от 1,7 до 3,5, а для сульфатостойкого – повышается до 4 и более.
Глиноземный или алюминатный модуль ГМ (или p) представляет собой отношение содержания глинозема к содержанию оксида железа:
 .
.
Глиноземный модуль отражает соотношение минералов-плавней в клинкере, т. е. соотношение между трехкальциевым алюминатом и железосодержащими соединениями. ГМ характеризует свойства расплава, образующегося при спекании, и прежде всего вязкость расплава (чем больше ГМ, тем больше вязкость). Значение этого модуля для обычных портландцементов находится в пределах от 1 до 2,5.
|
|
|
Установить содержание в клинкере основных минералов можно экспериментальными методами (прежде всего, петрографическим анализом). Приближенно оценить минеральный состав клинкера можно на основании данных химического анализа по формулам, предложенным В. А. Киндом,
% C3S= 3,8SiO2⋅(3КН − 2);
% C2S= 8,6SiO2⋅ (1− КН) .
Таким образом, количественное содержание минералов в клинкере оказывает влияние на свойства цемента. Имея данные о составе клинкера, можно предопределить основные свойства цемента и особенности его твердения в различных условиях эксплуатации;
Взаимодействие минералов клинкера с водой. Алит (С3S ) под действием воды подвергается гидролизу с выделением Са(ОН)2 и последующей гидратации:
3CaO × SiO2 + (n+1)H2O = 2CaO × SiO2 × nH2O + Ca(OH)2
где n зависит от температуры (при tKOMH близко к 2).
В обычных условиях твердения гидролиз останавливается на этой первой ступени, так как высокая концентрация ионов Са2+ и ОН- будет препятствовать дальнейшему протеканию этого процесса.
Белит C2S, находясь в одной системе с С3S, гидролизу не подвергается, но гидратируется по уравнению:
2CaO × SiO2 + nH2O = 2CaO × SiO2 × nH2O
Имеет место только гидратация. В этих условиях гидролиз не идет, так как вода уже насыщена гидроксидом кальция.
|
|
|
Таким образом, двухкальциевый гидросиликат - это основной минерал цементного камня, обеспечивающий прочность.
Для трехкальциевого алюмината общепринятым является следующее уравнение реакции гидратации:
3СаО ×·Al2О3 +6H2O =6СаО·× А12О3 × 6H2О
Целит (C4AF) гидролитически расщепляется с образованием шестиводного трехкальциевого алюмината и гидроферрита кальция:
4СаО ×·Al2О3 × Fe2O3 + (n+6)H2O = 3СаО·× А12О3 × 6H2О+ CaO × Fe2O3 × nH2O
Гидратационное твердение портландцемента осуществляется в соответствии с теорией А.А. Байкова.
Как указывалось выше, при помоле цементного клинкера добавляют небольшое количество двуводного гипса СаSО4 ×·2Н2О (3-5% от массы цемента) для регулирования сроков схватывания цементного теста. Без добавки двуводного гипса цементное тесто может схватываться очень быстро, так как реакция С3А с водой протекает с большой скоростью, что затрудняет или делает невозможным операции перемешивания, укладки и уплотнения бетонных смесей. Замедление указанной реакции достигается введением двуводного гипса, который взаимодействует с С3А с образованием гидросульфоалюмината кальция* в начале гидратации портпандцемента:
|
|
|
3СаО·× А12О3 + 3(CaS04 × 2Н2О) + 25(26)Н2О =
= 3СаО·× А12О3 ×·3CaS04 ×·(31 ... 32)Н2О.
В насыщенном растворе Са(ОН)2 эттрингит сначала выделяется в коллоидном состоянии. На поверхности С3А образуются гелевидные пленки гидросульфоалюмината кальция, которые сдерживают диффузию воды. Когда эттрингит образуется в виде длинных иглоподобных кристаллов, то сплошность пленки нарушается, гидратация ускоряется и наступает схватывание цементного теста.
После израсходования двуводного гипса эттрингит взаимодействует с 3СаО·× А12О3 с образованием моносульфата кальция:
2(3СаО·× А12О3) + 3Ca0 × Al2O3 × 3CaSO4 × 32Н2О + 22Н2О ®
® 3(3СаО·× А12О3 ×·CaS04 ×·18Н2О).
Более 80% цементных бетонов изготовляется с использованием разнообразных по составу добавок; одни имеют свойство ускорять твердение, другие – замедлять твердение. Например, ускорители твердения: CaCl2, Na2SO4, NiCl2, K2Cr2O4 ; замедлители твердения: CuCl2, SnCl2, ZnCl2.
В нормальных условиях (5-250С) длительность твердения цемента с достижением марочной прочности занимает 28 сут. Этот процесс можно провести за 12-18 часов в пропарочной камере (80-900С) и даже за 8-12 часов в автоклаве (175-180°С).
Смешанные цементы получают путем совместного измельчения клинкера с активной минеральной добавкой:

Количество добавки в составе смешанных цементов достигает 30 - 40%, а иногда 70 - 75 %.
Активная минеральная добавка способна в процессе твердения взаимодействовать с гидроксидом кальция по уравнению реакции:
Са(ОН)2 + SiО2 + (n - 1)Н2О = СаО·× SiO2 . nН2O
аморфный
где n изменяется от 2 до 3.
В результате в жидкой фазе твердеющего теста снижается концентрация ионов ОН- и становится возможным дальнейший гидролиз:
2СаО × SiО2 × nН2О + Н2О = Са(ОН)2 + СаО × SiО2 × nН2О .
Увеличиваются общее количество продуктов гидратации и плотность цементного камня. Более низкая себестоимость, твердение с меньшим тепловым эффектом позволяют использовать эти цементы для массивных бетонных конструкций подводных и подземных сооружений.
ГЦПВ - гипсоцементнопуццолановые вяжущие являются трехкомпонентными и состоят из портландцемента (10-25%), строительного гипса (40-75%) и активной минеральной добавки (10-25%).
Твердение таких вяжущих происходит в два этапа. На первом этапе гидратируется строительный гипс и через 2-3 часа достигается прочность, равная 30-40% от марочной. Второй этап - гидратация поргландцемента и взаимодействие Са(ОН)2 с активной минеральной добавкой.
Глиноземистый цемент (алюминатный цемент). Глиноземистый цемент получают из сырьевой смеси, состоящей из бокситов* (Al2О3 × nН2О) и известняка.
В России разработан и используется способ производства глиноземистого цемента в доменной печи. Доменная печь выдает и чугун, и цемент.
В шихту добавляют в качестве флюсов* известняк (СаСОз) и доломит (СаСО3 ×·МgСО3).·
Образующийся за счет реакции декарбонизации (1) оксид кальция вступает в реакцию с оксидом алюминия (2):
СаСО3 = СаО + СО2 (1)
СаО+Аl2О3 =СаО × Аl2О3 (2)
Основной минерал клинкера глиноземистого цемента - однокальциевый алюминат - СаО·× Аl2О3.
Химические реакции гидратационного твердения глиноземистого цемента сильно зависят от температуры. Низкие температуры (менее 100С) наиболее благоприятны для гидратации однокальциевого алюмината согласно уравнению:
СаО·× А12О3 + 10Н2О = СаО·× А12О3 ×·10Н2О.
Если температура в пределах 10-250С, то однокальциевый гидроалюминат сразу же подвергается разложению:
2(СаО·× А12О3 × 10Н2О) = 2СаО·× А12О3 ×·8Н2О × 2Al(OH)3 + 9H2O.
или
2(СаО·× А12О3) + 11H2O = 2СаО·× А12О3 ×·8Н2О × 2Al(OH)3.
Процесс протекает по стадиям. Сначала при гидратации СаО·× Аl2О3 образуется СаО·× Аl2О3 × Н2О (n = 10), который сравнительно быстро (в течении нескольких часов) переходит в гель. Получающийся гель неустойчив, из него выделяются и кристаллизуются восьмиводный двухкальциеный гидроалюминат и гидроксид алюминия.
2(СаО·× А12О3 × 10Н2О) = 2СаО·× А12О3 ×·8Н2О × 2Al(OH)3 ¯+ 9H2O.
Эта реакция протекает быстро. Вода, образующаяся в ходе реакции вступает во взаимодействие с еще не прореагировавшими частицами цемента, при этом выделяются новые количества кристаллов гидроалюминькальция и гель гидроксида алюминия.
Дальнейшее повышение температуры приводит к следующему превращению:
3(СаО·× А12О3 × 8Н2О) = 2(3СаО·× А12О3 ×·6Н2О) + 2Al(OH)3 ¯+ 9H2O.
Объем новообразований при этом уменьшается на 20-30% и возникают напряжения в цементном камне, что снижает прочность в 2-3 раза.
Твердение глиноземистого цемента протекает настолько интенсивно, что уже через сутки достигается 90 % конечной прочности.
Глиноземистый цемент образует цементный камень высокой плотности, пористость которого в два раза меньше, чем у портландцемента. При твердении глиноземистого цемента связывается-воды примерно в два раза больше, чем при твердении портландцемента, а промежутки между кристаллами заполнены Аl(ОН)3.
Твердение глиноземистого цемента сопровождается интенсивным выделением теплоты. Поэтому его нельзя применять в условиях жаркого климата, при тепловлажностной обработке изделий, бетонировании массивных конструкций.
Цементный камень глиноземистого цемента разрушается в сильнощелочной среде вследствие образования алюминатов, т.к. в цементном камне присутствует Аl(ОН)3 (амфотерный гидроксид). Поэтому глиноземистый цемент нельзя смешивать с портландцементом и известью и не допускается применять в средах, содержащих щелочи.
1.6. Коррозия цементного камня и бетона*
Внешняя среда вызывает разрушение цементного камня и бетона. В результате коррозионных разрушений снижается долговечность бетонных и железобетонных конструкций. Основное значение в современном строительстве имеют бетоны на портландцементе.
Затвердевший цементный камень бетона на портландцементе состоит из следующих компонентов:
Са(ОН)2, 2СаО × SiО2 × nН2О, 3СаО × А12О3 × 6Н2О, СаО·× Fе2О3 × nН2О и др.
Физическая коррозия бетона. Действие воды (мягкой) на бетон ведет к вымыванию Са(ОН)2 из бетона. В результате снижения его концентрации нарушаются условия устойчивости высокоосновных гидроалюминатов и гидросиликатов. После снижения его концентрации ниже 1,1 г/л начинается разрушение (изменение) других компонентов цементного камня. Так, например,
2СаО·× SiО2 × nН2О ® 3СаО·× 2SiO2 × nН2О ®
® СаО·× SiO2 × nН2O ® H4Si04
(SiO2 ×·2Н2О)
Постепенный отвод Са(ОН)2 во внешнюю среду сопровождается необратимым процессом разрыхления бетона и уменьшения его прочности.
Выщелачивание Са(ОН)2 в количестве 15-30% от общего содержания в цементном камне вызывает понижение прочности на 40-50%. Процесс ускоряется, если на бетон действует мягкая вода или вода под давлевием.
Химическая коррозия бетона. Углекислотная коррозия. Избыточная углекислота (увеличение количества СО2 в воде сверх равновесного) вызывает растворение карбоната кальция на поверхности:
Ca(OH)2 + CO2 ® CaCO3 + H2O
СаСО3 + СО2 + Н2О = Са(НСО3)2 (хорошо растворим в воде)
В результате вымывания его из бетона увеличивается пористость, проницаемость бетона.
Магнезиальная коррозия. В морской воде, в грунтовых водах содержатся соли магния (MgSO4, MgC12). При действии такой воды на бетон происходят следующие реакции:
Са(ОН)2 + MgC12 = CaC12 + Mg(OH)2 ¯
Са(ОН)2 + MgSO4 + 2Н2О = CaSO4 × 2Н2О + Mg(OH)2 ¯
Mg(OH)2 - (рыхлая объемная масса) выпадает в осадок в виде пленки, проницаемой для воды, CaC12 вымывается, CaSO4 ×·2Н2О в морской воде также вымывается.
Соли магния могут взаимодействовать с составными частями цементного камня:
2СаО × SiО2 × nН20 + 2MgC12 + 2Н2О =
= 2CaC12 + 2Mg(OH)2 ¯ +SiО2 × nН20
3СаО × А12О3 × 6Н2О + 3MgC12 =
= 3CaC12 + 3Mg(OH)2 ¯ +2Аl(ОН)3 ¯
В результате цементный камень превращается в рыхлую массу.
Сульфатная коррозия бетона возникает под действием воды, содержащей сульфат кальция, магния, натрия и др.:
3СаО·× А12О3 ×·6H2О + 3CaS04 + (25 ... 26)Н2О =
= 3СаО·× А12О3 × 3CaSO4 (31 ... 32)Н2О
трехсульфатный гидросульфоалюминат (эттрингит)*
Образование трехсульфатного гидросульфоалюмината сопровождается увеличением объема, что при водит к возникновению внутренних напряжений в бетоне и появлению трещин.
Если в воде содержится сульфат натрия, то-вначале с ним взаимодействует Са(ОН)2 :
Са(ОН)2 + Na2SО4 = CaSО4 + 2NaOH
Равновесие реакции смещается влево за счет связывания кальция сульфат-ионом (см. сульфатная коррозия).
Кислотная коррозия. Возникает под действием кислот, находящихся в сточных водах промышленных предприятий и грунтовых водах:
Ca(OH)2 +2HCl = CaCl2 + 2H2O,
Са(ОН)2 + H2SO4 = CaSO4 × 2Н2О.
Под действием кислот могут разрушаться и другие компоненты цементного камня.
Все методы защиты бетона от коррозии можно свести в следующие группы:
- правильный выбор цемента;
- изготовление особо плотного бетона;
- использование защитных покрытий;
- регулирование состава коррозионной среды (например, нейтрализация кислых вод, контактирующих с бетоном).
Вопросы для самоподготовки
1. Как влияют технологические условия при обжиге двуводного гипса на состав и свойства вяжущих?
2. Дайте сравнительную характеристику минералов С3S и C2S.
3.Напишите уравнения реакций взаимодействия минералов клинкера портландцемента с водой, если все минералы находятся в водной реагирующей системе.
4. Какая активная минеральная добавка используется при получении пуццоланового портландцемента и шлакопортландцемента? Какую функцию выполняет эта добавка? Где используются указанные цемента?
5. В грунтовых водах содержатся соли магния (MgSO4 и MgC12). Возможна ли коррозия бетона, контактирующего с такой водой? Напишите уравнения реакций.
6. Будут ли подвергаться бетонные сооружения разрушению при контакте с водой, содержащей значительные количества анионов  ? Почему? Дайте подробное объяснение.
? Почему? Дайте подробное объяснение.
Примеры решения задач
Задача №1
Определите чистоту (%) природного гипса, если при температуре 1200-1700С образец минерала массой 20 г теряет в массе 2,83 г.
Решение:
Изменение массы гипса при нагревании в интервале температур 1200-1700С происходит за счет частичного обезвоживания и образования бета-полугидрата:
CaSO4∙2H2O 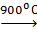 CaSO4∙0,5H2O + 1,5H2O↑
CaSO4∙0,5H2O + 1,5H2O↑
дигидрат полугидрат
Согласно уравнению реакции: из 1 моль дигидрата (М = 172 г/моль) при нагревании образуется 1 моль полугидрата (М = 145 г/моль) и 1,5 моль воды (М = 18 г/моль).
1. Находим массу дигидрата сульфата кальция


2. Находим степень чистоты природного гипса
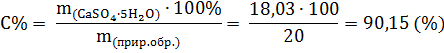
Ответ: степень чистоты природного минерала составляет 90,15%
Задача №2
Определить массу природного гипса, необходимую для получения эстрих-гипса массой 2563 т, в котором доля свободного оксида кальция составляет 16,39%
Решение:
Эстрих – гипс, или высокообжиговый гипс – СаSО4∙СаО, получают в результате обжига природного гипса при температуре 8000-10000 в присутствии угля (кокс).
Химизм процесса:
1. CaSO4∙2H2O = CaSO4 + 2H2O↑ – стадия дегидратации;
2. CaSO4 + С = СаО + SO2↑ + СО↑ – стадия получения эстрих-гипса, который состоит в основном из СаSО4 с добавками СаО.
Схема получения эстрих –гипса:
CaSO4∙2H2O 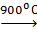 CaSO4
CaSO4 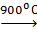 СаО → СаSО4∙СаО
СаО → СаSО4∙СаО
Как следует из схемы, доля безводного сульфата кальция, участвующего в реакции востановления, варьирует от 8 до 22%, доля свободного оксида кальция в эстрих-гипсе принимает значения от 10 до 20%.
CaSO4∙2H2O → CaSO4 → СаО
172 г/моль 136 г/моль 56 г/моль
1. Находим массу свободного оксида кальция:

Тогда масса CaSO4 составит:

2. Находим массу природного гипса для получения 420 т СаО:


3. Находим массу природного гипса для получения 2143 т СаSО4:


4. Находим суммарную массу природного гипса:

Ответ: масса природного гипса составляет 4000 т.
Задача №3
Определите химический состав (%) партии портландцемента по известному минералогическому составу: С3S – 50; С2S – 30; С3А – 5; С4АF – 15.
Решение:
Для выражения минералогического состава портландцемента используются краткие формулы, так и стехиометрические.
При составлении кратких формул следует знать условные обозначения: С→СаО; S→SiO2; А→Al2O3; F→Fe2O3.
Тогда химический состав по минералогическим формулам:
3СаО∙Al2O3 – 50% (алит);
2СаО∙SiO2 – 30% (белит);
4 СаО∙Al2O3∙Fe2O3– 15% (четырехкальциевый алюмоферрит);
3СаО∙ Al2O3 – 5% (трехкальциевый алюминат).
1. Примем массу партии портландцемента за 1 кг, отсюда находим массы:




2. Находим соответственно массы оксидов, которые содержатся в минералах:
А) 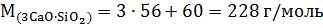



Б) 



В) 



Г) 





3. Находим процентное содержание оксидов:




Ответ: 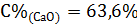 ;
;  ;
;  ;
;

Задача №4
Рассчитайте минералогический состав (%) образца клинкера портландцемента, если известно, что масса белита в образце втрое меньше массы алита, а массовые доли оксида железа  – 4,944%, оксида алюминия
– 4,944%, оксида алюминия  – 5,039%.
– 5,039%.
Решение:
Алит: 3СаО∙Al2O3; 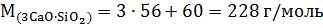
Белит: 2СаО∙SiO2; 
Алюминатная фаза: 3СаО∙ Al2O3; 
Целит: 4СаО∙Al2O3∙Fe2O3; 
1. Примем массу образца клинкера за 1 кг.
2. Находим массу оксида железа:

3. Находим число моль  :
:

4. 
Тогда масса минерала целита составит:

Тогда 
5. Находим массу оксида алюминия:

Число моль оксида алюминия:

6. Количество оксида алюминия в целите равно количеству оксида железа в целите = 0,309 моль. Следовательно, количество оксида алюминия в алюминатной фазе составляет:

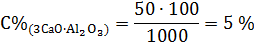
7. Находим массы белита и алита в образце:

Так как белита втрое больше алита, получим:
 :
: 
 :
: 
Ответ:  ;
; 
Задача №5
Определите массу известняка (кг) в исходной шихте для получения глиноземистого цемента, если массовая доля карбоната кальция составляет в нем 98%, масса железистого боксита Al2O3∙nH2O в шихте равна 1250 кг, массовая доля оксида алюминия в бокисте 40,8%.
Решение:
При получении глиноземистого цемента, протекает процесс, который соответствует следующему уравнению реакции:
СаСО3 + Al2O3∙nH2O → СаСО3∙ Al2O3+СО2↑+nН2О↑


1. Находим массу оксида алюминия в боксите шихты:

2. Находим число моль оксида алюминия:

3. Отсюда число моль карбоната кальция также составляет 5∙103 моль и тогда масса карбоната кальция равна:
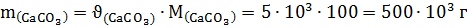
4. Находим массу известняка:

Ответ: масса известняка составляет 510 кг.
2. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ
2.1. Положение металлов в периодической системе элементов
Д.И. Meнделеева
Свыше 80 известных химических элементов являются металлами. Руководствуясь делением элементов на семейства, к элементам-металлам относятся S-элементы I и II групп, кроме водорода, d- и f-элементы часть р-элементов. Следует подчеркнуть, что деление химических элементов на металлы и неметаллы условно. Условной границей между металлами и неметаллами считают относительную электроотрицательность (Х), равную двум. Если Х < 2, то химический элемент - металл, если Х > 2, то химический элемент является неметаллом.
2.2. Классификация металлов
В промышленности имеет место исторически сложившееся разделение металлов на черные и цветные. К первым относят железо и сплавы на его основе, а также металлы, которые применяются, главным образов, в этих сплавах, например, марганец, хром. Ко вторым относят медь и сплавы на ее основе, а также никель, цинк, алюминий, магний и др.
В технике металлы классифицируют по различиям в свойствах, например, легкие, плотность которых меньше 5 г/см3, и тяжелые, с плотностью больше 5 г/см3. К легким металлам относят щелочные, щелочноземельные металлы, бериллий, алюминий, титан, скандий, иттрий; к тяжелым - все остальные. Самый легкий металл - литий (r = 0,53 г/см3), самый тяжелый - осмий (r = 22,7 г/см3). В зависимости от величины температуры плавления металлы делят на легкоплавкие и тугоплавкие. Металлы с температурой плавления ниже 1000°С относят к легкоплавким металлам, а металлы с температурой плавления выше 1000°С - к тугоплавким металлам. Так, цезий плавится в руках (tпл. = 26,5°С), тогда как температура плавления наиболее тугоплавкого металла - вольфрама, составляет 3380°С.
Особо выделяют группу благородных металлов. Эта группа включает платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt) и золото. Все платиновые металлы относятся к числу малораспространенных элементов. Платиновые металлы чрезвычайно устойчивы по отношению к химическим реагентам. Все платиновые металлы, их сплавы и соединения часто используются в качестве катализаторов во многих органических и неорганических синтезах.
Помимо распределения металлов по группам периодической системы Д.И. Менделеева, существует тенденция выделять s- , Р-, d- металлы.
2.3. Физические свойства металлов
Все свойства металлов и сплавов можно разделить на четыре группы: физические, химические, механические и технологические.
К отличительным физическим свойствам металлов можно отнести твердое агрегатное состояние (за исключением ртути), высокую электропроводность, теплопроводность, металлический блеск, цвет, магнитные и другие свойства.
Все металлы при обычной температуре твердые вещества, но по степени твердости они сильно отличаются друг от друга: щелочные металлы легко режутся ножом, тогда как самый твердый - хром - по своей твердости близок к алмазу. В таблице 1 приведены некоторые свойства наиболее широко применяемых металлов.
Таблица 1
Дата добавления: 2019-07-15; просмотров: 329; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
