Вывод по итогам выполнения задания:
 | |||
| |||
 | |||
Цель работы
Углубить теоретические представления о механизмах возникновения, о величине внутреннего трения в газах, о её связи с микрокинетическими параметрами газа. Освоить методы измерения вязкости газов.
Теоретическая часть
 Вязкость газов, в отличие от жидкостей, увеличивается при повышении температуры. Различный характер зависимости вязкости газов и жидкостей от температуры указывает на различный механизм их возникновения, хотя формула Ньютона -
Вязкость газов, в отличие от жидкостей, увеличивается при повышении температуры. Различный характер зависимости вязкости газов и жидкостей от температуры указывает на различный механизм их возникновения, хотя формула Ньютона -  -одинаково справедлива и для обоих этих состояний.
-одинаково справедлива и для обоих этих состояний.











 Рассмотрим, как возникает внутреннее трение в газах. В отличие от жидкостей здесь силы внутреннего трения возникают в результате микрофизического процесса передачи импульса от одного слоя газа к другому. Переносчиками импульса выступают молекулы газа.
Рассмотрим, как возникает внутреннее трение в газах. В отличие от жидкостей здесь силы внутреннего трения возникают в результате микрофизического процесса передачи импульса от одного слоя газа к другому. Переносчиками импульса выступают молекулы газа.
Выделим в движущемся потоке газа вдоль вектора скорости два параллельных соприкасающихся слоя. Пусть скорости vих движения по величине и направлению таковы, как показано на рисунке. В тепловом движении импульсы р молекул и их проекции р x в рассматриваемых слоях неодинаковы. Молекулы, находящиеся в более медленном, «нижнем» слое, имеют меньшую составляющую импульса р x и, попав в «верхний» слой, затормаживают его. Δрх – изменение импульса - направлено навстречу движению этого слоя. «Верхние»же молекулы, наоборот, переносят вниз импульс больший, чем имеют молекулы «нижнего» слоя, и поэтому ускоряет нижний слой.
|
|
|
По второму закону Ньютона Δрх/Δ t = F – сила сопротивления движению. Она зависит от массы молекул, их концентрации (частота переноса импульсов) и температуры (скорость молекул). Таким образом, вязкость газов тем больше, чем больше их молекулярная масса. Она увеличивается также с повышением давления, поскольку при этом растёт концентрация газа. Отсюда также становится понятным, что чем выше температура газа, тем больше скорость теплового движения и интенсивней обмен молекулами между его слоями, а, следовательно, тем больше коэффициент вязкости этого газа.
Определение вязкости воздуха по методу Пуазейля
Теория метода
При ламинарном движении жидкостей и газов по гладким цилиндрическим трубам расход Q (объем жидкости или газа, протекающих через поперечное сечение трубы за время D t), зависит от ее вязкости, диаметра трубы, ее длины и разности давления на ее концах. Соответствующее соотношение было выведено Пуазейлем и носит его имя.
Q= D p p r4 D t/8 h l , (1)
В нее входят перепад давления D p на концах трубы, её радиус r , длительность течения D t, коэффициент вязкости h, длина трубы l.
|
|
|
На основании этого соотношения разработан и широко применяется метод измерения вязкости жидкостей и газов - метод Пуазейля. [3]
Для газов метод предполагает измерение расхода газа при его ламинарном протекании по гладкому, тонкому, капиллярному каналу с известными размерами и при контролируемой разности давлений. В данной работе по методу Пуазейля определяется вязкость неосушенного и неочищенного воздуха. Хотя известно, что эти параметры оказывают большое влияние на величину вязкости газов. В установках для точных измерений воздух перед поступлением в капилляр осушают различными, чаще всего химическими осушителями. Важно также помнить, что вязкость газов в большой степени зависит от их температуры, что также предусмотрено в лабораторных приборах.
Экспериментальная установка
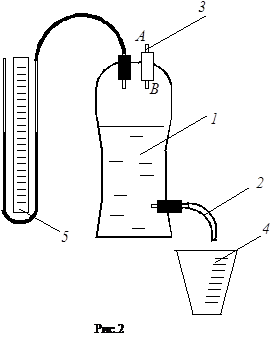
Экспериментальная установка для определения воздуха (рис. 2) состоит из сосуда - 1 со сливным шлангом - 2, капилляра -3, мерительного стакана -4 и жидкостного манометра - 5. Перед опытом сосуд заполняется водой. При опущенном шланге 2 вода из сосуда вытекает и давление становится ниже атмосферного. Так создается перепад давлений воздуха на концах А и В капилляра 3. Он измеряется манометром 5. Этот перепад давлений создает поток воздуха через капилляр, при этом объем вытекшей воды равен объему воздуха, прошедшего через капилляр.
|
|
|
 Расчетная формула для определения коэффициента вязкости по методу Пуазейля имеет вид:
Расчетная формула для определения коэффициента вязкости по методу Пуазейля имеет вид:
h = D p p r4 D t/8lQ , (2)
где – r радиус капилляра, l - его длина, Q - объем прошедшего через капилляр воздуха (равен объему вытекшей из сосуда жидкости), D р - перепад давлений на концах капилляра (показание манометра), D t - время протекания воздуха через капилляр.
Ход выполнения работы
1. Закрепите сливной шланг в верхнем положении. Заполните сосуд 7 водой и плотно закрепите пробку с капилляром в его горловине.
2. Опустите сливной шланг вниз, подставив под него мерный сосуд. Измерьте секундомером время t , в течение которого из сосуда вытечет объем Q =200 см3 воды.
3. Измерьте в это же времени перепад давлений D р по манометру.
Примечание: При постепенном понижении уровня воды в сосуде скорость истечения уменьшается. Это приводит к изменению перепада давлений воздуха на концах капилляра. Поэтому необходимо брать среднее за время опыта значение D р.
|
|
|
4. По формуле (2) вычислите вязкость воздуха.
5. Опыт повторите не менее пяти раз. Результаты занесите в таблицу 2 отчета.
6. Оцените относительную погрешность измерения вязкости воздуха. Погрешности измерений диаметра и длины капилляра возьмите из «паспорта» прибора.
9. В выводе сравните полученное значение вязкости воздуха с табличным значением (h = 1,8 × 1 0-5 Па × с при 18оС)
Дополнительное задание
1. Вычислите плотность воздуха по формуле ρ= pM / RT , где М = 0,029 кг/моль – молярная масса воздуха, R - универсальная газовая постоянная, давление р и температуру Т измерьте по приборам в лаборатории.
2. Вычислите среднюю арифметическую скорость νср молекул воздуха при данных условиях.
3. Вычислите среднюю длину свободного пробега 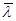 молекул воздуха при нормальных условиях, исходя из формулы связи ее с коэффициентом вязкости
молекул воздуха при нормальных условиях, исходя из формулы связи ее с коэффициентом вязкости 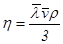 .
.
4. Исходя из формулы р = nkT , вычислите концентрацию п молекул воздуха в лаборатории ( k - постоянная Больцмана – равна 1.38∙10-23 Дж/К).
5. Вычислить среднее число столкновений молекул, испытываемых одной молекулойза одну секунду 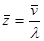 .
.
6. Выполните ряд заданий (см. бланк отчета) практического характера с использование полученных экспериментальных результатов.
Дата добавления: 2019-07-15; просмотров: 205; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
