Определение общей жесткости воды
К 50 мл исследуемой воды добавляется 5 мл щелочной смеси и 8 капель индикатора. Жидкость титруют 0,1 N раствором трилона Б до перехода цвета винно-красного в голубой.
Жесткость воды в миллиграмм-эквивалентах в 1 л рассчитывается по формуле:
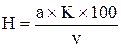 ,
,
где: Н – искомая жесткость в мг×экв/л;
а – количество мл 0,1 N раствора трилона Б;
К – коэффициент децинормальности трилона Б;
v – количество мл взятой для анализа воды.
Для перевода жесткости воды из мг×экв/л в градусы нужно полученное количество мг×экв/л умножить на 2,8. Один мг×экв/л соответствует 2,8°.
Определение устранимой жесткости
Приборы и реактивы:
1. Колбочки.
2. Пипетка.
3. Бюретка.
4. 0.1 N раствор НCl.
5. 0.1 N раствор метилоранжа- индикатор.
Ход анализа:
К 100 мл исследуемой воды добавляется 2-3 капли индикатора. Жидкость титруют 0,1 N раствором НС1 до первого изменения окраски (золотистый цвет переходит в розовый). Жесткость в 1 л исследуемой воды вычисляется по формуле:
 ,
,
где: Х – искомая устранимая жесткость в градусах;
а – количество мл в 0,1 N раствора НС1, пошедшее на титрование;
2,8 – количество мг СаО, соответствующее 1 мл 0,1 N раствора НС1.
Определение постоянной жесткости
Постоянная жесткость получается вычитанием из числа градусов общей жесткости градусов устранимой жесткости.
Очистка и обеззараживание воды
Способами очистки и улучшения качества воды являются: отстаивание, фильтрации, коагуляция и хлорирование.
|
|
|
Коагуляция воды
Мутная вода очищается посредством коагуляции. Коагулированная вода более полно обеззараживается хлорированием. В качестве коагулянта применяется главным образом сернокислый алюминий – А12(SO4)3 или глинозем.
Реже применяется для этих целей известь, квасцы, сернокислое железо. Глинозем, добавленный в воду, реагирует с бикарбонатными кальцием и магнием:
А12(SO4)3 + 3Са(НСОз)2 = 2А1(ОН)3 + 3CaSO4 + 6СO2.
Образующийся гидрат окиси алюминия А1(ОН)3, осаждаясь на дно в виде хлопчатого осадка, увлекает за собой муть, а также и микроорганизмы.
Потребная доза коагулянта зависит, главным образом, от степени устранимой жесткости: чем больше в воде бикарбонатов кальция и магния, тем больше требуется глинозема. При недостаточном количестве взятого коагулянта образуется мало хлопьев и не получается хорошего осветления воды, при избытке его – вода приобретает кислый вкус.
Приборы и реактивы:
1. Три химических стакана по 200 мл.
2. Пипетки.
3. Три стеклянных палочки.
4. 1% раствор глинозема.
Ход анализа:
1. Определение устранимой жесткости (методика изложена выше).
2. Определение дозы коагулянта.
|
|
|
В стаканы наливают по 200 мл исследуемой воды. К воде добавляется 1% раствор глинозема.
На 1° устранимой жесткости берется 0,8 мл 1% раствора глинозема. Например, при устранимой жесткости в 10° в первый стакан добавляют 8 мл (0,8´10=8), во второй стакан на 1° меньше – 7,2 мл (0,8´9=7,2), в третий стакан на 2° меньше – 6,4 мл (0,8´8=6,4).
Воду в стаканах размешивают стеклянными палочкамии оставляют на10 минут для образования хлопьев.
Дозой коагулянта считается наименьшее количество 1% раствора глинозема, от которого через 10 минут в стакане появляются ясно заметные хлопья, оседающие на дно.
Если коагуляция во всех стаканах протекает очень быстро или очень медленно, опыт повторяется с меньшими или большими дозами коагулянта.
В мягкой воде, имеющей устранимую жесткость менее 4-5°, процесс коагуляции протекает плохо, т.к. такая вода содержит мало коагулянта и образование хлопьев А1(ОН)3 происходит недостаточное. В таких случаях в очищаемой воде следует повысить устранимую жесткость. Для этого вода в стаканах подщелачивается гашеной известью в дозе 0,4 г или не гашеной в дозе 0,3 г на каждый грамм глинозема. Пробная коагуляция с подщелачиванием воды проводится по выше проведенной методике.
|
|
|
При вычислении потребного количества 1% раствора глинозема для коагуляции найденную наименьшую дозу его умножают на 5 и на количество литров воды, подлежащих коагуляций.
Хлорирование воды
Сущность обеззараживающего действия хлорной извести заключается в следующем: в воде хлорная известь разлагается на свободный хлор и кислород, окисляющие органические вещества и бактерии, содержащиеся в воде.
Свежая хлорная известь должна содержать не менее 35% активного хлора. Хлорная известь, используемая для хлорирования воды, должна содержать не менее 25% активного хлора.
В виду непостоянства состава хлорной извести, перед употреблением она должна быть исследована на содержание активного хлора. Принцип определения количества активного хлора в хлорной извести основан на том, что хлор в растворе (в кислой среде) вытесняетиз добавленного йодистого калия эквивалентное количества свободного йода, количество которого определяется титрованием гипосульфитом.
Приборы:
1. Роговые весы.
2. Стакан на 200 мл.
3. Фарфоровая чашка.
4. Колба на 100 мл.
5. Пипетки.
6. Стеклянные палочки.
7. Мерный цилиндр. Реактивы:
8. 10% раствор йодистого калия.
9. 5% раствор серной кислоты.
10. 1% раствор крахмала – индикатор.
|
|
|
11. 0,01 N раствор гипосульфита (1 мл 0,01 N раствора гипосульфита связывает 1,269 мг йода, что соответствует 0,055 мг хлора).
12. Кипяченая дистиллированная вода.
Ход анализа:
Берется средняя проба хлорной извести в количестве 1 г. В стакан наливается 100 мл прокипяченной дистиллированной воды. В фарфоровой чашке постепенно размешивают 1 г хлорной извести с отмеренной водой. Известковое молоко, а также жидкость после ополаскивания чашки водой, оставшейся в стакане, сливается в колбу. Жидкость в колбе закрывается пробкой, встряхивается и оставляется на 1 час для отстаивания.
Затем 1 мл отстоявшегося раствора переносят в стакан, добавляют к нему 50 мл дистиллированной воды, 2 мл раствора KJ, 1 мл раствора H2SO4 и 1 мл раствора крахмала.
Вытесненный хлором из йодистого калия свободный йод окрашивает крахмал в синий цвет.
Посиневшую жидкость титруют гипосульфитом до обесцвечивания.
Процентное содержание активного хлора (X) в исследуемой хлорной извести определяется по формуле:

где: a – количество мл 0,01 N раствора гипосульфита, пошедшее на титрование;
0,355 – количество мг хлора, эквивалентного 1 мл 0,01 N раствора гипосульфита;
100 – перевод содержания хлора на 100 мл приготовленного раствора;
100 – перевод содержания хлора на 100 г хлорной извести;
1000 – перевод мг в граммы.
После соответствующих сокращений формула принимает следующий вид:

Дата добавления: 2019-07-15; просмотров: 717; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
