КОЛИЧЕСТВЕННЫЙ АНАЛИЗ ФОРМАЛЬДЕГИДА И СОПУТСТВУЮЩИЙ ВЕЩЕСТВ (МЕТАНОЛ, ВОДА, МУРАВЬИННАЯ КИСЛОТА, МЕТАЛЛЫ)
Химические и инструментальные методы анализа
Определение формальдегида
Хотя основной метод анализа смесей органических веществ в настоящее время – хроматография, для определения содержания свободного формальдегида чаще всего по-прежнему пользуются химическими (волюмометрическими) методами, а из последних чаще всего гидроксиламиновым или сульфитным. Основное усовершенствование более позднего периода – лишь замена, там где это возможно, визуального определения момента конца титрования инструментальным.
Гидроксиламиновый метод. Сущность метода – взаимодействие формальдегида с гидрохлоридом гидроксиламина с образованием формальдольксима и свободной соляной кислотой.
 (1.16)
(1.16)
Приборно – методическое оформление анализа зависит от способа определения выделяющейся соляной кислоты или оксима и связанно, в основном, с наличием тех или иных примесей, влияющих на погрешность. В наиболее простой модификации метод соляной кислоты.
Ход анализа. Две порции 10-%-ного раствора гидрохлорида гидроксиламина, по 10 мл. каждая, вносится пипеткой в две конические колбы вместимостью 125 мл. В одну из колб помещают стаканчик, содержащий навеску анализируемого раствора ( проба должна содержать примерно 1 г формальдегида). Если в пробе имеются смолистые вещества или осадки, то в качестве растворителя в стаканчик добавляют 10 мл. метанола. Такой же объем последнего прибавляют и во вторую (сравнительную) колбу. Спустя 15 – 20 мин. необходимых для завершения приведенной выше реакции, содержимое обеих колб титруют 1 н. раствором едкого кали с индикатором бромфеноловым синим. Конец титрования фиксируется по переходу желтой окраски в светло-пурпурную. В некоторых случаях определение ведут в растворе пиридина.
|
|
|
В щелочной или слабокислой (до рН 4-5) среде взаимодействия формальдегида с гидроксиламином протекает быстрее, чем в нейтральной или кислой. В присутствии оснований реакция протекает через следующие стадии:
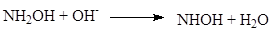 (1.17)
(1.17)
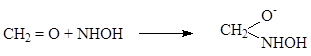 (1.18)
(1.18)
 (1.19)
(1.19)
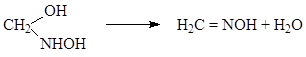 (1.20)
(1.20)
Наиболее медленная стадия – реакция (18). Анализ формальдегида в щелочной среде основан на потенциометрическом определении момента появления в растворе свободной неразложенной соли гидроксиламина (вместо гидрохлорида может применяться также сульфат гидроксиламина). Образование формальдоксима происходит настолько быстро, что предварительная выдержка приготовленных реакционных смесей не требуется. В стаканчик емкостью 100 мл., в котором ведут титрование, наливают 55 мл. воды и 5 мл. 50%-го раствора едкого кали. К этому раствору добавляют на магнитной мешалке и опускают в раствор два электрода - платиновый и насыщенный каломелевый. Титрование ведут при перемешивании 0,1 н. раствором гидрохлорида гидроксиламина с помощью микробюретки. Точка эквивалентности находится в интервале от -250 до -300 мВ. Вначале отрицательный потенциал под влиянием возрастающего содержания оксима увеличивается, однако стрелка милливольтметра не останавливается на новом значении, а возвращается обратному исходному положению. Концом титрования считается момент, когда стрелка перестает откланяться назад и очередная капля титрагента отклоняет ее только в перед. Относительная ошибка метода составления 0,2%.
|
|
|
Определению не мешают метанол, этанол, уксусная и муравьиная кислоты, ацетон и др.
В соответствии с гостированной методикой определение примесей формальдегида как в кислых, так и в щелочных растворах проводится рН – метрическим титрованием. В этом случае добавлением необходимого количества кислоты или щелочи рН исследуемого раствора предварительно доводится до 4. После этого к водно-этанольному раствору , содержащему навеску, добавляют 5 мл. 5% -ного раствора гидрохлорида, смесь перемешивают и выдерживают в течении 30 мин. Затем в стакан со сиесью опускают пару электродов (стеклянный в сочетании с хлорсеребряным или каломельным) и титруют 0,1 н. раствором едкого натра до достижения исходного значения рН 4. Вместо добавления щелочи можно использовать предварительно построенную тарированную кривую рН – содержание СН2О. титрование можно проводить, и с индикатором бромфеноловым синим.
|
|
|
Сульфитный метод. В основе метода – реакция формальдегида с сульфитом натрия, в результате которой образуется как бы продукт присоединения гидросульфата натрия к формальдегиду и свободная щелочь:
 (1.21)
(1.21)
 (1.22)
(1.22)
Гидросульфитное соединение имеет именно приведенную структуру гидроксисульфоновой кислоты, а не строение гидроксиметилсульфита HOCH2 – O – SO2Na, приписывавшееся этому соединению ранее. Взаимодействие сульфитов с формальдегидом является примером метоксилирования неорганического соединения – реакции, часто встречающейся в органических синтезах с участием формальдегида.
Дата добавления: 2019-07-15; просмотров: 474; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
