Механизм реакции замещения на примере предельных углеводородов. Практическое значение предельных углеводородов.
Галогенирование -- это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно -- за один этап замещается не более одного атома водорода:
1. CH4 + Cl2 > CH3Cl + HCl (хлорметан)
2. CH3Cl + Cl2 > CH2Cl2 + HCl (дихлорметан)
3. CH2Cl2 + Cl2 > CHCl3 + HCl (трихлорметан)
4. CHCl3 + Cl2 > CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, замещая у них атом водорода, в результате этого образуются метильные радикалы СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Нитрование (реакция Коновалова)
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных. Реакция также подчиняется правилу Марковникова.
RH + HNO3 = RNO2 + H2O
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
1) метанв составе природного газа находит все более широкое применение в быту и на производстве;
2) пропан и бутанприменяются в виде «сжиженного газа», особенно в тех местностях, где нет подвода природного газа;
3) жидкие углеводороды используются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
|
|
|
4) метанкак доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения метанаиспользуется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7) метан– основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана
Непредельные углеводороды ряда этилена, общая формула и химические свойства. Применение этиленовых углеводородов в медицине.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4)
Хим.свойства
Реакции присоединения:
СH2=CH-CH3 + H2 → CH3-CH2-CH3
|
|
|
CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3 - качественная реакция на алкены — обесцвечивание бромной воды.
Присоединение по правилу Марковникову:
водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи:
СH2=CH-CH3 + HCl = CH3-CHCl-CH3
Окисление алкенов:
1)В нейтральной (или слабощелочной среде:
СH2=CH2 → CH2(OH) — CH2(OH) — схематичное уравнение
3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение
2)В кислой среде — идет разрыв двойной связи:
R-СH2=CH2-R → 2R-COOH — схематичное уравнение
полное сгорание: С2H4 + 3O2 = 2CO2 + 2H2O
Реакция полимеризации: n СH2=CH2 → n(-CH2-CH2-)
Применение:
При взаимодействии этилена с хлороводородом образуется этилхлорид, который используют в медицине для проведения местной анестезии. Применение алкенов также связано с их способностью реагировать с водой, образуя при этом спирты. Так, из этилена в процессе реакции гидратации получается этиловый спирт. Нашли свое применение в качестве сырья для производства органических соединений, лаков, пластических масс, средств косметической промышленности и окиси алкенов.
Механизм реакции присоединения на примере непредельных углеводородов ряда этилена. Правило Марковникова. Применение этиленовых углеводородов в органическом синтезе.
|
|
|
Рассмотрим этот механизм на примере реакции присоединения бромоводорода к молекуле этилена.

Несмотря на то, что реакция гидробромирования описывается очень простым равнением, ее механизм включает несколько стадий.
Стадия 1. На первой стадии молекула галогеноводорода образует с π-электронным облаком двойной связи неустойчивую систему – «π-комплекс» за счет частичной передачи π-электронной плотности на атом водорода, несущий частичный положительный заряд.

Стадия 2. Связь водород-галоген разрывается с образованием электрофильной частицы Н+, и нуклеофильной частицы Br-. Освободившийся электрофил Н+ присоединяется к алкену за счет электронной пары двойной связи, образуя σ-комплекс – карбокатион.

Стадия 3. На этой стадии к положительно заряженному карбокатиону присоединяется отрицательно заряженный нуклеофил с образованием конечного продукта реакции.
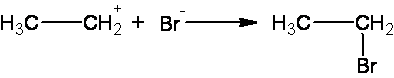
Правило Марковникова — в органической химии правило, используемое для предсказания региоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам и алкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году
|
|
|
. 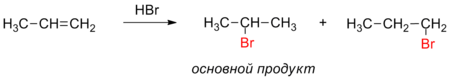
Реакция протекает в две стадии. На первой, медленной стадии происходит присоединение протона H+ к двойной связи: при этом протон может связываться с одним из двух атомов углерода, образующих двойную связь. Образующиеся карбокатионы И1 и И2 имеют различную энергию (устойчивость), поскольку положительный заряд в них делокализуется с разной эффективностью. По этой причине вторичный карбокатион И2 является более устойчивым, и соответствующий ему бромид П2 образуется в большем количестве.
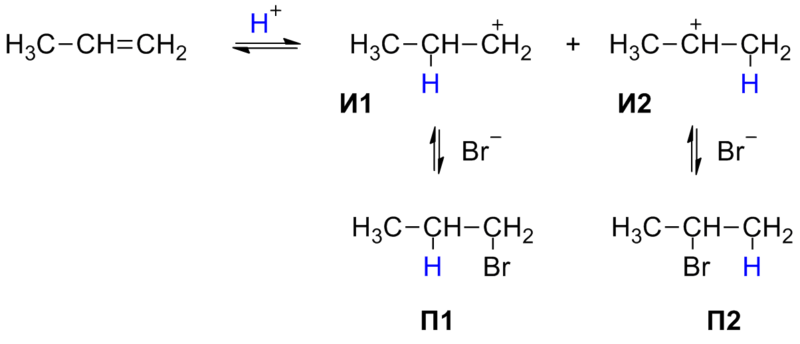 При более строгом рассмотрении необходимо сравнивать устойчивости не интермедиатов, а двух альтернативных переходных состояний на стадии образования карбокатионов, то есть энергии активации двух параллельных процессов. Для некоторых реакций различие этих величин достигает 25—30 кДж/моль.
При более строгом рассмотрении необходимо сравнивать устойчивости не интермедиатов, а двух альтернативных переходных состояний на стадии образования карбокатионов, то есть энергии активации двух параллельных процессов. Для некоторых реакций различие этих величин достигает 25—30 кДж/моль.
Благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ.
Вопрос 42
Ацетилен — непредельный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства:
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах. Малорастворим в воде, хорошо растворяется в ацетоне. Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[5].
Химические свойства:
Для ацетилена (этина) характерны реакции присоединения:
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения .
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов - эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации)
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция ,а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Применение:
Ацетилен используют:
1)для сварки и резки металлов,
2)как источник очень яркого, белого света в автономных светильниках, где он получается реакцией
3)карбида кальция и воды (см. карбидная лампа),
4)в производстве взрывчатых веществ (см. ацетилениды),
5)для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука,ароматических углеводородов.
6)для получения технического углерода
7)в атомно-абсорбционной спектрофотометрии при пламенной атомизации
8)в ракетных двигателях
Вопрос 43
Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.
Химические свойства:
1.реакции замещения:
а)в присутствии катализатора – Солей железа (III) –бензол вступает в реакцию замещения, так же он реагирует и с хлором.
Б)взаимодействие с азотной кислотой
2.реакции присоединения
А)при действии солнечного света или ультрафиолетовых лучей. На свету присоединяется хлор и образуется гексахлорциклогексан (гексахлоран). Эта реакция используется и в промышленности, т.к. гексахлоран применяют для борьбы с насекомыми (инсектицид):
Б)гидрирование
3. реакции окисления
А) при действии энергичных окислителей на гамологи бензола окислению подвергаются только боковые цепи
Б)бензол и его гомологи на солнце горят коптящем пламенем
Применение:
Продукт для получения красителей, медикоментов, взрывчатых веществ, инсектицидов, пластмасс и синтетических волокон. Хороший растворитель многих органических веществ.
Получение:
Получение. Бензол и его гомологи в больших количествах получают из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании). Сухая перегонка производится на коксохимических и газовых заводах
Вопрос 46
Этиленгликоль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
· Как компонент автомобильных антифризов и тормозных жидкостей
· В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
· В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
· Как растворитель красящих веществ;
· В органическом синтезе:
· в качестве высокотемпературного растворителя.
· для защиты карбонильной группы путём получения 1,3-диоксолана
· Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.
· В качестве криопротектора
· Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей.
· Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
· при производстве конденсаторов
· при производстве 1,4-диоксана
· компонент в составе систем жидкостного охлаждения компьютеров
· как теплоноситель в системах чиллер-фанкойл
· в качестве компонента крема для обуви (1—2 %)
· в составе для мытья стёкол вместе с изопропиловым спиртом
Глицерин (1,2,3-триоксипропан, пропантриол-1,2,3) — простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость. Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Глицерин относится к группе стабилизаторов обладающих свойствами сохранять и увеличивать степень вязкости, а так же консистенции пищевых продуктов. Зарегистрирован как пищевая добавка Е422, и используется в качествеэмульгатора, при помощи которого смешиваются различные несмешиваемые смеси.
Поскольку глицерин хорошо поддается желированию, в отличие например от этанола, и как и этанол горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей.
Технический глицерин используется для заполнения виброустойчивых манометров типа ДМ8008ВУ, заполнения торцевых уплотнений мешалок и др.
Также глицерин используется при изготовлении динамита.
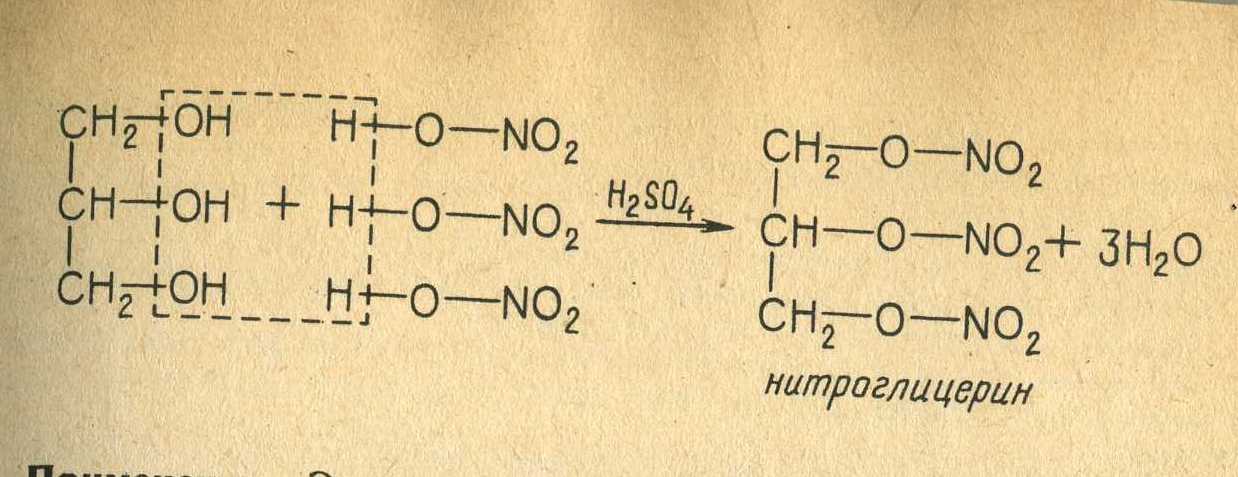

Вопрос 47
Фенол (гидроксибензол, устаревшее карболовая кислота) C6H5OH — простейший представитель классафенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом (таким, как запах гуаши, т. к. в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, вацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Химические свойства.:
Обладает слабыми кислотными свойствами, при действии щелочей образует соли — феноляты (например, фенолят натрия - C6H5ONa):C6H5OH + NaOH = C6H5ONa + H2O
· Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
· Реакция Кольбе-Шмидта.
· 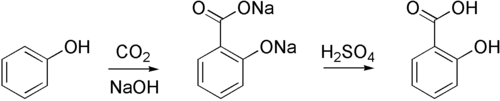 Взаимодействие с металлическим натрием:
Взаимодействие с металлическим натрием:
2C6H5OH + 2Na = 2C6H5ONa + H2↑
· Взаимодействие с бромной водой (качественная реакция на фенол):
C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6-трибромфенол
· Взаимодействие с концентрированной азотной кислотой:
C6H5OH + 3HNO3конц → C6H2(NO2)3OH + 3H2О образуется 2,4,6 тринитрофенол
· Взаимодействие с хлоридом железа(III) (качественная реакция на фенол):
6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание)
Фенол весьма ядовит. При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуютПопадая на кожу, фенол очень быстро всасывается даже через неповрежденные участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Фенол является канцерогенным химическим веществом и способен вызвать рак. Смертельная доза для человека при попадании внутрь 1-10 г, для детей 0,05-0,5 г.[5] В лагерях смерти фашистской германии применялся для преднамеренной, активной, недобровольной эвтаназии, как правило в виде инъекции в сердце.
53)
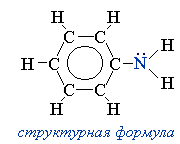 Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом . На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом . На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Основной способ получения анилина — восстановление нитробензола. В промышленных условиях восстановление проводят водородом при 250-350 °С на никелевом или медном катализаторе.
В лаборатории для этой цели используют цинк в кислой среде:
С6Н5NО2 + 3Zn + 7HCl → C6H5NH3Cl + 3ZnCl2 + 2Н2О
или алюминий в щелочной среде:
C6H5NO2 + 2Al + 2NaOH + 4Н2О → C6H5NH2 + 2Na[Al(OH)4].
60)
 Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.
Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.
Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина):
 (OH)C6H4CH(NH2)COOH + HNO3 —-H2SO4——> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O — выпадает осадок желтого цвета.
(OH)C6H4CH(NH2)COOH + HNO3 —-H2SO4——> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O — выпадает осадок желтого цвета.
(OH)C6H3(NO2)CH(NH2)COOH + 2NaOH ——-> (ONa)C6H3(NO2)CH(NH2)COONa + H2O — раствор становится оранжевым.

Дата добавления: 2019-02-22; просмотров: 2148; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
