Хемилюминесцентный метод анализа
Научные исследования, связанные с использованием
И синтезом люминола
УДК 577.151.4
ОПРЕДЕЛЕНИЕ ПЕРОКСИДА ВОДОРОДА В РЕАКЦИИ ЛАККАЗНОГО ОКИСЛЕНИЯ ГИДРОХИНОНА
Калач И.Е.
Научн ый руководитель Одарюк И.Д., к.х.н.
ГОУ ВПО «Донецкий национальн ы й университет»
e - mail : iradonetsk 2204@ gmail . com
Фермент лакказа, который относится к голубым медьсодержащим оксидазам и примечателен высокой активностью и низкой субстратной специфичностью, широко используется в различных отраслях промышленности и сельского хозяйства. Лакказа окисляет различные субстраты, как правило, фенольной природы, восстанавливая кислород до воды. Согласно литературным данным [1, 2], каталитический цикл фермента не приводит к образованию перекисных соединений. В работе [1] подчеркивается, что в этом состоит преимущество лакказы для промышленного применения перед пероксидазами, для работы которых необходим пероксид водорода, в то же время приводящий к их дезактивации через несколько циклов. Однако не только восстановление кислорода, но и превращения феноксильного радикала, второго продукта лакказы, способны генерировать АФК, в том числе и H2O2, например, по реакциям [3]:
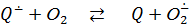 , ,
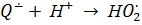 , ,
| |
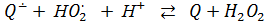 , ,
|
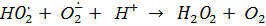 .
.
Для выявления пероксида водорода в реакционной смеси при лакказном окислении фенолов применялась высокочувствительная методика, основанная на усилении хемилюминесценции кобальт-люминольной системы при введении H2O2 [4]. Реакционная смесь, вводимая в кобальт-люминольную систему, разбавлялась в 105 раз, что обеспечивало отсутствие влияния на интенсивность хемилюминесценции примесей, также способных вызвать схожий эффект.
|
|
|
Реакцию лакказного окисления гидрохинона проводили в термостатируемом реакторе с барботацией ([ГХ]0 =1,36 мМ, [Е]0 = 20 мг/л, цитратный буфер рН 4,6, 35°С). Через 20 минут после начала реакции отбирали 0,05 мл реакционной смеси и разбавляли дистиллированной водой в 105 раз. В 5 мл кобальт-люминольной смеси ([люм] = 7,0 мкМ, [CoSO4] = 1,0 мкМ, карбонатный буфер рН=9.9) вводили по 0,5 мл разбавленной реакционной смеси или растворы пероксида водорода известной концентрации, что вызывало скачок на кривой хемилюминесценции (рисунок). Сравнивая интенсивность хемилюминесценции, получаем, что в реакционной смеси присутствует примерно 1 мМ H2O2, то есть концентрация пероксида водорода соизмерима с начальной концентрацией гидрохинона.
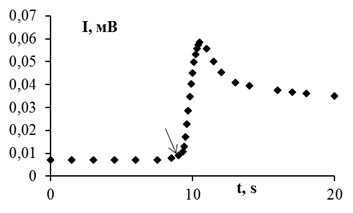
|
| Рисунок - Влияние пробы реакционной смеси (стрелкой показан момент введения) на люминол-зависимую ХЛ. Карбонатный буфер рН 9.9; [люминол] = 7,0 мкМ; [CoSO4] = 1,0 мкМ). |
Таким образом, показано образование пероксида водорода при лакказном окислении гидрохинона с помощью кобальт-зависимой хемилюминесценции люминола. Это указывает на то, что в ходе каталитических циклов образуются активные формы кислорода, диффундирующие из активного центра в реакционную смесь и приводящие к образованию пероксида водорода.
|
|
|
Использованные источники:
1. Использование базидиальных грибов в технологиях переработки и утилизации техногенных отходов: фундаментальные и прикладные аспекты (обзор) / Н. А. Куликова [и др.] // Прикладная биохимия и микробиология. 2011. Т. 47. С. 619-634.
2. Laccase: Properties, Catalytic Mechanism, and Applicability / A. I. Yaropolov et al. // Applied Biochemistry and Biotechnology. 1994. Vol. 49. P. 257-280.
3. Автоокисление фенольных антиоксидантов в водных средах: монография / А. Н. Шендрик [и др.]. Донецк: ДонНУ, 2013. 147 с.
4. Determination of Hydrogen Peroxide in Water by Chemiluminescence Detection / S. Uchida et al. // Journal of Nuclear Science and Technology. 2004. Vol. 41. № 9, p. 898–906.
Определение малых количеств H2O2 с помощью люминола
Пероксид водорода, который может образовываться в ходе приготовления настоя чайных листов, может значительно влиять на ХЛ при их ферментативном окислении. Установлено, что в экстракте чая H2O2 содержится. Наличие в реакционной смеси H2O2 является дополнительным, осложняющим интерпретацию данных по кинетике ХЛ.
|
|
|
Для количественного определения пероксида водорода в реакционной смеси при лакказном окислении настоя черного чая использовали методику, основанную на усилении хемилюминесценции системы, содержащей люминол и ионы Со2+ в щелочном буферном растворе (0,01 М карбонатный буфер, рН 9.9). Кобальт-люминольная система характеризуется свечением небольшой интенсивности, которое резко возрастает при введении пероксида водорода. Максимальная интенсивность свечения на пике (Imax) или площадь под ХЛ-кривой до времени, соответствующего максимальной интенсивности (SImax) (рисунок 3.7) соотносятся c концентрацией введенного пероксида водорода, однако вид зависимости не линейный, а близок к некоторой степенной функции.
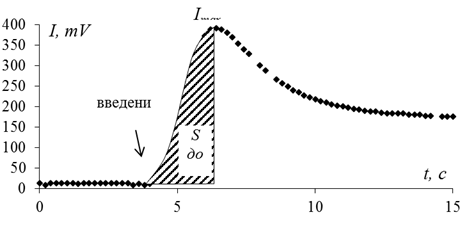
|
| Рисунок – Кривая ХЛ кобальт-люминольной системы в отсутствие пероксида водовода и после его введения. [Co2+] = 0.5 мкМ, [люм] = 5 мкМ, [Н2О2] = 0,1 мкМ. |
Для определения содержания пероксида водорода использовали настой черного чая Assam Kamarupa, приготовленный по методике, описанной ранее в разделе 2.2 (навеска чая 0,2 г).
Лакказное окисление настоя чая проводили в реакторе барботажного типа при оптимальных условиях ферментативной кинетики (цитратный буферный раствор с рН 4.6, Т = 308 К). Использовалась концентрация фермента 200 мг/л, настой чая был разбавлен в реакционой смеси в 10 раз. Через 2 минуты после начала реакции отбирали пробу реакционной смеси и разбавляли ее бидистиллированной водой для замедления ферментативного процесса и приближения концентрации пероксида водорода к диапазону полученной калибровочной зависимости.
|
|
|
После учета разбавления исследуемых проб содержание пероксида водорода составило 0,7 мкМ в настое чая и 0,3 мкМ в реакционной смеси при лакказном окислении настоя (рисунок 3.8).
 
|
| Рисунок – Зависимость максимальной интенсивности ХЛ кобальт-люминольной системы Imax от концентрации Н2О2 и определение неизвестных концентраций Н2О2 в настое чая (1) и в реакционной смеси при лакказном окислении настоя чая (2). |
Хемилюминесцентный метод анализа
Если в ходе реакции образующаяся возбужденная молекула дезактивируется с испусканием кванта света, наблюдается явление хемилюминесценции. Это процесс, обратный фотохимическим реакциям. Простейшая схема такой реакции:
| А + В → Р* → Р + hν, | (1) |
где А и В – исходные реагенты, Р* - молекула продукта в электронно-возбужденном состоянии, Р – молекула продукта в основном состоянии.
Интенсивность излучения будет пропорциональна скорости реакции образования возбужденного продукта Р*и описывается выражением [35]:
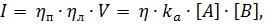
| (2) |
где I – интенсивность хемилюминесценции, ηп ‑ выход возбужденных молекул продукта (отношение числа возбужденных молекул к общему количеству продукта), ηл – квантовый выход хемилюминесценции (отношение числа возбужденных молекул, дезактивирующихся с испусканием света, к общему числу возбужденных молекул, ω – скорость реакции, η = ηп·ηл, ka –константа скорости образования Р* в реакции (2.4).
Общий выход хемилюминесценции η обычно очень мал (10-8-10-10), это объясняется невысокой вероятностью образования Р*, кроме того, вероятность хемилюминесцентной дезактивации Р* мала, что объясняется процессами безызлучательной дезактивации: тушение, внутренняя дезактивация [35,42].
Установка для регистрации хемилюминесценции должна удовлетворять двум требованиям – максимального соотношения сигнала к шуму при измерении слабых световых потоков и возможности восприятия свечения в широкой области спектра [43]. Измерения проводились на хемилюминесцентной установке (рисунок 2.6), собранной в научно-исследовательской лаборатории на кафедре биохимии ДонНУ [44].
Ход измерений:
- реакционную систему и буферный раствор предварительно инкубировали при 308 К;
- в реакционный сосуд барботажного типа, помещенный в установку, добавляли растворы субстрата и фермента и начинали измерение.
Для изучения кинетики хемилюминесценции и первичной обработки полученных кривых применяли программму PowerGraph 2.0.
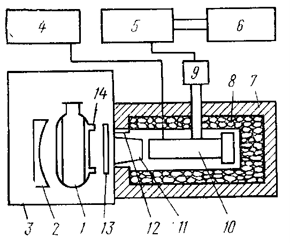
|
| 1. ‑ реакционный сосуд; 2. ‑ фокусирующее зеркало; 3. ‑ светонепроницаемая камера; 4. ‑ источник питания фотоумножителя; 5. ‑ электрометрический усилитель; 6. ‑ самопишущий потенциометр; 7. ‑ пенопластовый кожух; 8. ‑ охладитель ФЭУ; 9. – усилитель постоянного тока; 10. – ФЭУ; 11. ‑ светопровод; 12. – обогрев светопровода; 13. – светофильтр; 14. – отводы к термостату. Рисунок – Схема установки для изучения хемилюминесценции. |
В случае быстрого протекания реакции необходимо начать измерение до начала реакции. С этой целью использовали систему ввода вещества, начинающего реакцию.
Дата добавления: 2019-02-22; просмотров: 384; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
