Билет 55 (Основные положения МКТ газов. Молекулярно-кинетический смысл температуры. Закон Больцмана о равномерном распределении энергии по степеням свободы)
Билет 53 (Термодинамические параметры системы. Основной постулат термодинамики)
Параметры состояния, термодинамические параметры — физические величины, характеризующие состояние термодинамической системы. Термодинамическая система – это совокупность тел, обменивающихся энергией, как между собой, так и с внешними телами. Различают экстенсивные параметры состояния, пропорциональные массе системы: объём, внутренняя энергия, энтропия, энтальпия, энергия Гиббса и интенсивные параметры состояния, не зависящие от массы системы: давление, температура, концентрация, магнитная индукция и др.
Стационарным называется состояние, для которого значения всех термодинамических параметров постоянны во времени. Стационарное состояние называется равновесным, если его неизменность во времени не обусловлена протеканием каких-либо процессов во внешних по отношению к данной термодинамической системе телах. Равновесное состояние однозначно определяется заданием значений ограниченного числа его термодинамических параметров, называемых параметрами состояния.
Основной постулат термодинамики. Нулевое начало термодинамики (общее начало термодинамики) — физический принцип, утверждающий, что вне зависимости от начального состояния системы, в конце концов, в ней при фиксированных внешних условиях установится термодинамическое равновесие, а также что все части системы при достижении термодинамического равновесия будут иметь одинаковую температуру.
|
|
|
Билет 54 (Уравнение состояния идеального газа. Законы идеального газа. Изопроцессы)
Уравнение состояния идеального газа:
Уравнение состояния идеального газа ( уравнение Менделеева — Клапейрона ) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: 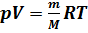 , где P- давление, V – объем, m – масса, M – молярная масса, R – универсальная газовая постоянная (8,31 Дж/К*моль) T – температура.
, где P- давление, V – объем, m – масса, M – молярная масса, R – универсальная газовая постоянная (8,31 Дж/К*моль) T – температура.
Законы идеального газа. Изопроцессы
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
1. Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
График изохорического процесса на РV-диаграмме называется изохорой. Полезно знать график изохорического процесса на РТ- и VT-диаграммах (рис. 1.6). Уравнение изохоры:
|
|
|

| (1.4.1) |

Рис. 1.6
Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде
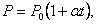
| (1.4.2) |
где Р0 – давление при 0 °С, α - температурный коэффициент давления газа равный 1/273 град-1. График такой зависимости на Рt-диаграмме имеет вид, показанный на рисунке 1.7.

Рис. 1.7
2. Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
График изобарического процесса на VT-диаграмме называется изобарой. Графики изобарического процесса на РV- и РT-диаграммах (рис. 1.8).
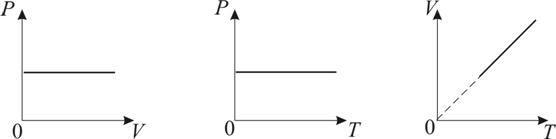
Рис. 1.8
Уравнение изобары:
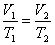 . .
| (1.4.3) |
Если температура газа выражена в градусах Цельсия, то уравнение изобарического процесса записывается в виде

| (1.4.4) |
где α =1/273 град -1- температурный коэффициент объёмного расширения. График такой зависимости на Vt диаграмме имеет вид, показанный на рисунке 1.9.
|
|
|

Рис. 1.9
3. Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT- и РT-диаграммах (рис. 1.10).

Рис. 1.10
Уравнение изотермы:
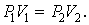
| (1.4.5) |
4. Адиабатический процесс (изоэнтропийный):
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA=6,02·1023молекул (число Авогадро).
|
|
|
7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:

| (1.4.6) |
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
При  , давление смеси газов:
, давление смеси газов:

| (1.4.7) |
8. Объединённый газовый закон (Закон Клапейрона).
В соответствии с законами Бойля – Мариотта (1.4.5) и Гей-Люссака (1.4.3) можно сделать заключение, что для данной массы газа

|
Билет 55 (Основные положения МКТ газов. Молекулярно-кинетический смысл температуры. Закон Больцмана о равномерном распределении энергии по степеням свободы)
3 основных положения молекулярно - кинетической теории:
I положение
Все тела (вещества) состоят из частиц (молекул, атомов, ионов...), между которыми есть промежутки.
Опытные обоснования:
- крошение вещества
- испарение жидкостей
- смешивание веществ; диффузия
- фотографии туннельного микроскопа
II положение
Частицы находятся в постоянном, беспорядочном (хаотичном) движении (тепловое движение).
Опытные обоснования:
- испарение (вылет частиц с поверхности вещества)
- диффузия
III положение
Частицы вещества взаимодействуют друг с другом: притягиваются на небольших расстояниях и отталкиваются, когда эти расстояния уменьшаются.
Дата добавления: 2019-02-22; просмотров: 209; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
