Кислородный потенциал газовой фазы
Пример 1.6. Определить кислородный потенциал газовых смесей из СО2 и СО для содержания СО2 в смесях, %: 1,0; 5; 15; 30; 50; 80; 90; 99 и двух температур: 800 и 1100°С. Общее давление в смеси равно 105 Па.
Решение. Определяем вначале значение отношений  для смесей заданного состава. Затем, используя выражение для кислородного потенциала газовых смесей
для смесей заданного состава. Затем, используя выражение для кислородного потенциала газовых смесей 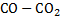 находим значения кислородного потенциала газовых смесей
находим значения кислородного потенциала газовых смесей  для заданных температур 800 ° С (1073 К) и 1100 ° С (1373 К). Результаты расчета сведены в табл. 1.
для заданных температур 800 ° С (1073 К) и 1100 ° С (1373 К). Результаты расчета сведены в табл. 1.
На рис.1 результаты расчета представлены в виде графика.

Рис.1. Кислородный потенциал газовой смеси  в зависимости от содержания СО в смеси и температуры.
в зависимости от содержания СО в смеси и температуры.
Анализ результатов расчета подтверждает положение теории о том, что окислительная способность газовых смесей 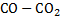 ограничена. Наибольшую окислительную способность (т. е. наиболее высокое значение кислородного потенциала) имеет СО2. С повышением температуры окислительная способность СО2 увеличивается. Это связано с развитием процессов термической диссоциации СО2 при высоких температурах.
ограничена. Наибольшую окислительную способность (т. е. наиболее высокое значение кислородного потенциала) имеет СО2. С повышением температуры окислительная способность СО2 увеличивается. Это связано с развитием процессов термической диссоциации СО2 при высоких температурах.
Пример 1.7. Определить значение кислородных потенциалов газовых смесей из 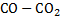 и
и  , содержащих одинаковое количество оксида углерода и водорода 10% и 90%, для температур 800 и 1800 К.
, содержащих одинаковое количество оксида углерода и водорода 10% и 90%, для температур 800 и 1800 К.
Решение. Значение отношений  для двух составов газовых смесей соответствуют отношению объемных процентов соответствующих компонентов газовой фазы. Поэтому в расчетные формулы для определения значений кислородных потенциалов газовых смесей вместо парциальных давлений подставляем содержание соответствующих газов в объемных процентах.
для двух составов газовых смесей соответствуют отношению объемных процентов соответствующих компонентов газовой фазы. Поэтому в расчетные формулы для определения значений кислородных потенциалов газовых смесей вместо парциальных давлений подставляем содержание соответствующих газов в объемных процентах.
Так для смесей, содержащих по 10 % Н2 и СО, и температуры 800 К получаем


Таблица 1. Кислородные потенциалы газовых смесей  с различным содержанием СО2.
с различным содержанием СО2.
| Содержание СО2, % | Отношение |
| |

| 
| ||
| 1 5 15 30 50 80 90 99 | 99 19 5,67 2,33 1,0 0,25 0,11 1·10-2 | -459 466 -429 999 -408 410 -392 533 -377 433 -352 684 -338 027 -295 219 | -429 851 -392 144 -364 520 -344 204 -324 882 -293 213 -274 459 -219 682 |
Аналогично определяем значения кислородных потенциалов для других температур и составов газовых смесей. Результаты расчета приведены в табл. 2.
Таблица 2. Кислородные потенциалы газовых смесей 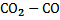 и
и  различного состава
различного состава
| Состав смеси | Т, К | π0, Дж | |||
| СО | СО2 | Н2 | Н2О | ||
| 10 - 10 - 90 - 90 - | 90 - 90 - 10 - 10 - | - 10 - 10 - 90 - 90 | - 90 - 90 - 10 - 10 | 800 800 1800 1800 800 800 1800 1800 | -396 008 -376 392 -184 281 -231 595 -454 500 -439 884 -315 887 -363 200 |
Реакция водяного газа и свойства сложных газовых смесей.
Пример 1.8. В печь для термической обработки, нагретую до температуры 960 ° С подается газовая смесь следующего состава, % (объемн.): 32 СО; 11 СО2; 9 Н2 48 N2.
Какой будет равновесный состав газовой смеси, когда она нагревается до температуры печи? Общее давление равно 105 Па.
Решение. При подаче в печь, нагретую до высокой температуры, газовой смеси, содержащей СО, СО2 и Н2, между компонентами газовой смеси будет происходить взаимодействие, соответствующее реакции водяного газа

Состав газовой смеси будет изменяться, пока не будет достигнуто состояние равновесия этой реакции, отвечающее заданной температуре. Таким образом, задача сводится к расчету величины константы равновесия 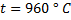 и определению равновесного состава газовой смеси.
и определению равновесного состава газовой смеси.
Значение константы равновесия реакции водяного газа для температуры 960 ° С равно:

Таким образом, соотношение между компонентами газовой смеси в условиях равновесия при 960 ° С

Реакция водяного газа не сопровождается изменением объема , поэтому такое же соотношение будет и между компонентами смеси, выраженными в объемных процентах.
Поскольку имеются четыре неизвестных величины, то для их определения нужно иметь четыре уравнения. Связывающие эти величины. Недостающие уравнения составляем с учетом известного исходного состава газовой смеси:

После подстановки данных об исходном составе смеси в балансовые уравнения и значения  в уравнение для константы равновесия получим систему уравнений:
в уравнение для константы равновесия получим систему уравнений:


Совместное решение этой системы уравнений относительно  приводит к квадратному уравнению вида
приводит к квадратному уравнению вида  .
.
Решая это уравнение, находим:  Далее находим количество других компонентов равновесной газовой смеси:
Далее находим количество других компонентов равновесной газовой смеси: 
Количество азота в составе смеси не изменяется, т. е.  Указанную задачу можно решить другим методом.
Указанную задачу можно решить другим методом.
Допустим, что для достижения равновесия в системе требуется превращение «т» молей СО2 из исходного его количества в смеси.

После преобразований получим квадратное уравнение 
Таким образом, состав равновесной газовой смеси при 960 ° С будет, %:




52
Количество азота в составе смеси не изменится, т. е. N2=48%.
Состав равновесной газовой смеси для двух вариантов методики решения задачи получается одинаковым.
Пример 1.9. Металлическое железо окисляется при высоких температурах в случае, если давление кислорода в газовой фазе превышает величину  FeO, зависящую от температуры по уравнению
FeO, зависящую от температуры по уравнению
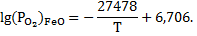
Каково должно быть отношение  в исходной смеси, чтобы образующаяся при температуре 1200 ° С газовая смесь
в исходной смеси, чтобы образующаяся при температуре 1200 ° С газовая смесь  была бы безокислительной по отношению к железу?
была бы безокислительной по отношению к железу?
Решение. Определяем максимально допустимое давление кислорода в газовой смеси, при котором не будет происходить окисление железа при температуре 1200 ° С:


Исходная газовая смесь из СО2 и Н2 реагирует при высокой температуре по реакции водяного газа

Образующаяся газовая смесь  имеет при заданной температуре определенное давление кислорода, которое определяется отношением
имеет при заданной температуре определенное давление кислорода, которое определяется отношением  или
или  в соответствии с реакциями:
в соответствии с реакциями:

Рассмотрим равновесие одной из этих реакций, например горения водорода. Для этой реакции:

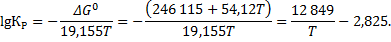

Определяем отношение  , которое обеспечивает давление кислорода
, которое обеспечивает давление кислорода


Константа равновесия реакции водяного газа при 1200 ° С равна

В соответствии с реакцией водяного газа при заданной температуре отношение в газовой смеси

Далее воспользуемся схемой расчета равновесного состава газовой фазы для реакции водяного газа, которая использовалась для вывода уравнения. Обозначим содержание водорода в исходной смеси  через х:
через х:
 Тогда
Тогда 
Составляем уравнения, связывающие равновесные концентрации газовой смеси  при 1200 ° С:
при 1200 ° С:
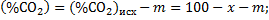




Решая полученную систему уравнений, находим 
Таким образом , для получения безокислительной по отношению к железу газовой смеси  , исходная смесь должна содержать, %:
, исходная смесь должна содержать, %: 
Отношение газов в смеси:
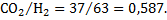
Пример 1.10. Определить значения кислородных потенциалов в газовой смеси исходного состава, %: 10 СО2; 25 СО; 25 Н2; 40 N2 при нагреве ее до температур (К): 800; 1000 и 1200.
Решение. Определим вначале равновесный состав газовой смеси для заданных температур. Значения контраст равновесия находим по уравнению:

Для других температур аналогично находим:

Для температуры 800 К получим равенство вида:

После преобразования получаем квадратное уравнение:

Откуда 
Состав равновесной газовой смеси при 800 К будет следующим, %:




Содержание азота в составе равновесной газовой смеси не изменяется и составляет 40%.
Аналогичный расчет для температур 100 К и 1200 К дает следующие равновесные составы газовых смесей, % :
Т. К СО2 Н2 СО Н2О
1000 6,56 21,56 3,44
1200 5,08 20,08 4,92
Дата добавления: 2019-02-22; просмотров: 1813; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

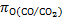 , Дж, для температур
, Дж, для температур