Окислительные свойства газовой фазы
ПРОЦЕССЫ ГОРЕНИЯ И СВОЙСТВА ВЫСОКОТЕМПЕРАТУРНОЙ ГАЗОВОЙ ФАЗЫ
Термодинамические характеристики реакций горения при высоких температурах.
Пример 1.1. Определить равновесие парциальное давление кислорода в газовых смесях СО-СО2 и Н2-Н2О при одинаковом значении отношения РСО2/ РСО = РН2О/РН2 = 0,25 и температуре 1600 °С.
Решение. Рассматриваем равновесие реакций горения окиси углерода и водорода :
2СО + О2 = 2СО2;
2Н2 + О2 = 2Н2О.
Величины ΔG0 для этих реакций как функции температуры выражаются уравнениями
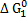

 566307 +175,47Т;
566307 +175,47Т;
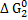

 493038 + 108, 40Т.
493038 + 108, 40Т.
Находим зависимость констант равновесия этих реакций от температуры:

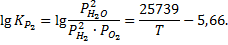
Для заданной температуры константы равновесия имеют значения


Из выражений для констант равновесия реакций горения СО и Н2 находим равновесное парциальное давление кислорода в газовых смесях:

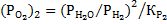
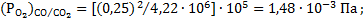

Таким образом, при одинаковом составе газовых смесей, равновесное давление кислорода в газовой смеси  значительно меньше, чем для смеси
значительно меньше, чем для смеси 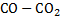 . Это объясняется более высоким химическим сродством водорода к кислороду в области высоких температур.
. Это объясняется более высоким химическим сродством водорода к кислороду в области высоких температур.
Диссоциация газов при высоких температурах
Пример 1.2. При нагреве водорода до высоких температур происходит частичная диссоциация молекул на атомы по реакции:

Определить степень диссоциации и состав газовой смеси при нагреве водорода до температур 2000 К и 3000 К при постоянном давлении 
Решение. Пусть в исходном состоянии в газовой фазе содержится n молей Н2. При нагреве до высоких температур молекулярный водород частично диссоциирует. Обозначим степень диссоциации через α. Тогда α·n молей молекулярного водорода разлагаются с образованием атомарного водорода. Образуется смесь, состоящая из (n-α · n) молей Н2 и 2αn молей Н, поскольку один моль Н2 дает два моля Н.
Общее количество молей Н2 и Н смеси будет равно:

Мольная доля каждого компонента смеси составит:

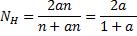
Выразим константу равновесия реакций диссоциации водорода через мольные доли компонентов смеси:

Из этого уравнения определяем степень диссоциации:

Состав газовой фазы при высокой температуре определяется по значениям мольных долей компонентов, выраженных через степени диссоциации:


Зависимость константы равновесия реакции диссоциации водорода на атомы от температуры находим, используя температурную зависимость  для этой реакции (Приложение I):
для этой реакции (Приложение I):

Для температуры 2000 К находим:


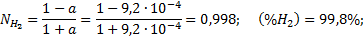
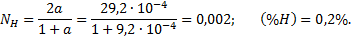
Для температуры 3000 К соответственно находим:
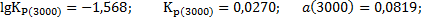


Пример 1.3. при высоких температурах водяной пар частично диссоциирует с образованием водорода и кислорода.
Определить степень диссоциации водяного пара и равновесный состав газовой смеси при температурах 2000 К и 3000 К и общем давлении Р=105 Па.
Решение. Если в исходном состоянии в системе находится 1 моль водяного пара, то при степени диссоциации α в равновесной газовой смеси будет (1 - α) молей Н2О, α молей Н2 и 0,5α молей О2.
Общее число молей всех компонентов смеси составит

Мольная доля каждого компонента смеси составит
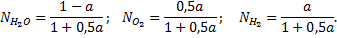
Соответственно парциальные давления компонентов смеси будут равны
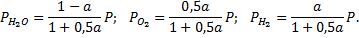
Запишем константу равновесия реакции 2Н2+О2=2Н2О в виде

Подставляя вместо парциальных давлений компонентов их значения, выраженные через степень диссоциации α и температурой:

В формуле (1.7) температура представлена через значения константы равновесия КР.
При малых значениях степени диссоциации

Для такого случая уравнение (1.7) упрощается и значение α находят из простого выражения:

В общем случае производят решение управления (1.17) одним из приближенных способов , например методом касательных Ньютона.
Для условий задачи производим расчет значений  по уравнениям (1.7) и (1.8). Определим далее величину константы равновесия для температур 2000 и 3000 К:
по уравнениям (1.7) и (1.8). Определим далее величину константы равновесия для температур 2000 и 3000 К:

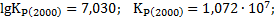

Расчет значений α по уравнению (1.7) производим, применяя метод касательных Ньютона. Уравнение (1.7) приводим к обычной форме:

Находим производную от 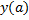 :
:
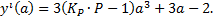
Находим первое приближение α1, по значению α0, полученному из упрощенного выражения (1.8):

Задаем далее точность решения 
Если α1 отличается от α0 на величину превышающую заданную точность, то ищем второе приближение и т. д. В результате расчета получаем  (или 0,57 %);
(или 0,57 %);
 (или 15,21 %).
(или 15,21 %).
Таким образом, при малых значениях α расчеты по упрошенной формуле (1.8) и уравнению (1.7) дают одинаковые результаты. При значительных величинах α расчет следует вести по уравнению (1.7).
Окислительные свойства газовой фазы
Пример 1.4. Для создания газовой фазы с низким фиксированным давлением кислорода в лабораторной практике используют газовые смеси Н2О-Н2 с различным соотношением между водяным паром и водородом.
Определить равновесное давление кислорода в газовой смеси Н2О-Н2 при температуре 1580°С и отношении 
Решение. Равновесное давление кислорода в газовых смесях Н2О-Н2 определим из условий равновесия реакции:

Из выражения для константы равновесия этой реакции находим

Из приложения 1 находим для реакции горения водорода:

Тогда 
Для заданной температуры 1580 °С (1853 К) значение константы равновесия  или
или 
Находим равновесное давление кислорода:


Увеличение отношения  приводит к росту равновесного парциального давления кислорода в газовой смеси
приводит к росту равновесного парциального давления кислорода в газовой смеси  , т. е. увеличению её окислительной способности.
, т. е. увеличению её окислительной способности.
Пример 1.5. Определить давление кислорода в равновесной газовой смеси, которая образуется при нагреве оксида углерода до температур: 2000, 2250 и 2500 К. Общее давление в газовой фазе равно 
Решение. При высоких температурах оксид углерода может частично разлагаться с образованием СО2 и выделением сажистого углерода:

В образующейся газовой смеси 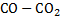 появляется кислород за счет частичной термической диссоциации CO2:
появляется кислород за счет частичной термической диссоциации CO2:
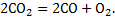
В результате устанавливается сложное равновесие, которое схематически можно изобразить так:

 CO2
CO2

 C O2
C O2
CO
Допускаем, что системе все время присутствует твердый углерод, т. е. имеет место гетерогенное равновесие.
Задача сводится к определению состава газовой смеси из СО и СО2, находящихся в равновесии с твердым углеродом, и определению равновесного давления кислорода в такой газовой смеси.
Для расчета состава газовой смеси из СО и СО2, находящейся в равновесии с твердым углеродом, можно рассмотреть равновесие реакции газификации твердого углерода:

Равновесное давление кислорода определяем по условиям равновесия реакции
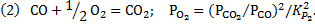
Однако расчет равновесного содержания СО для реакции (1) при высоких температурах требует определения точного значения квадратного корня из числа близкого к единице с большим числом знаков, что вызывает неудобства при использовании обычных калькуляторов с 5 или 7 разрядами.
Задачу можно решить более просто, если рассматривать взаимодействие газовой фазы из СО, СО2 и О2 с углеродом, как реакции образования окиси углерода и кислород:
СО → С +1/2О2.
Определить равновесное давление кислорода для такой реакции можно, используя термодинамические характеристики реакций образования окиси углерода:

При высоких температурах , в связи с очень низким равновесным давлением кислорода в газовой фазе, можно принять что

т. е. что равновесное давление СО равно общему давлению.
Тогда

Для общего давления  уравнение для расчета
уравнение для расчета  упрощается, поскольку
упрощается, поскольку 
Значение  определяем по данным о
определяем по данным о 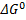 для реакции (3):
для реакции (3):
 ;
;
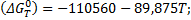

Для заданных температур получаем следующие равновесные давления кислорода в газовой фазе:


Дата добавления: 2019-02-22; просмотров: 1303; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
