Химия. 2. Зинин. 3. Семенов. 4. Бародин. 5. Морковников. 6. Бекетов. 7. Менделеев. 8. Бутлеров
Nbsp; Күні: Сыныбы 8 1 сабақ Сабақтың тақырыбы: Химия –заттар туралы жаратылыстану ғылымдарының бір саласы. Химия ғылымының пайда болуы Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов, К.Сарманова, К.Жексембина. 8 сынып оқулығы. Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Химия - заттар туралы жаратылыстану ғылымдарының бір саласы екенін біледі. Химия ғылымының пайда болуы туралы түсінік қалыптастыру Күтілетін нәтиже Оқушылар Химия ғылымы туралы, оның қолдану аясын біледі. Химия пәнінің өзіне тән ерекшеліктерін ұғынады. Негізгі идеялар Химия пәні –заттарды, олардың қасиеттерін, басқа заттарға айналып түрлендіруін қарастырады. Құрал-жабдықтар: Интерактивті тақта, маркер, қарындаш, плакаттар, слайдтар. 8-сынып электронды оқулық. Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар, ББү кестесі Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті Оқушылармен амандасып, оқушылардың көңілін сабаққа аудару, сыныптағы оқушыларды топқа бөлу. Сынып құрамын түгелдеу, тақтаға күн ретін жазу. -сабақта қалыпты жұмыс істеуге мүмкіндік жасау ; - сабақтың өткізу жоспарын көрсету. Кіріспе бөлім Оқушыларға ББү кестесі беріледі Білемін Білгім келеді? Білдім Негізгі бөлім -Тақтаға сабақтың тақырыбы жазылады. -Сабақтың мақсаты таныстырылады -Мәтінмен жұмыс жасау тапсырылады -Әр топқа суреттер беріледі. Суретті пайдалана отырып химия ғылымы туралы ақпарат береді І-топ: Химия ғылымы ІІ-топ: Химия ғылымының пайда болуы ІІІ-топ:Химия ғылымының басқа ғылымдармен байланысы Қорытынды бөлім 1.ББҮ кестесін береді 2.Химия пәні нені зерттейді? 3. «Химия біздің өмірімізде» тақырыбында эссе жазу Сабақ рефлексиясы Үйге тапсырма беру: Химия –заттар туралы жаратылыстану ғылымдарының бір саласы. Химия ғылымының пайда болуы. Химия кабинетіндегі қауіпсіздік техникасының ережелерімен танысу Оқушылардың іс-әрекеті Оқушылар топқа бөлінеді. Тақтадан күн ретін жазып алады. сабақтың жалпы мақсатымен және өткізу жоспарымен танысады Оқушылар ББҮ кестесін толтырады. Толтырылған кестені топ ішінде оқып, барлық ақпаратты түсіріп, топ атынан баяндамашы оқиды. Химия пәні туралы өз ойларын ортаға салып бөліседі. Суреттерді біріктіріп, химия ғылымы туралы өз ойларын ортаға салады. Топ атынан баяндамашы қорғайды. Қорғалған жұмысты «екі жұлдыз, бір ұсыныс» арқылы бағалайды Оқушылар жеке жұмысты орындап, бүгінгі сабақтан не түсінгенінне анализ жасайды. Оқушылар «Химия біздің өмірімізде» тақырыбында эссе жазады. ББҮ кестесін толтырады Сабақ соңында сабақ реф жазады Сыныбы 8 2 сабақ Күні: Сабақтың тақырыбы: №1 сарамандық жұмыс. Химия кабинетіндегі қауіпсіздік техникасының ережелері. Зертханалық құрал-жабдықтармен танысу Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Қауіпсіздік техникасының негізгі ережелерін, зертханалық құралдардың атауын, жұмыс жасау ережелеріне түсінік қалыптастыру Күтілетін нәтиже Зертханалық құралдармен жұмыс істеу жолдарын біле отырып, қауіпсіздік техникасының ережелерін сақтауға дағдыланады Негізгі идеялар Химиялық зертхана мен кабинеттің ішіндегі құрал жабдықтардың, заттардың орналасуымен, тарпа шкафтардың қызметімен, қауіпсіздік техникасының ережесімен танысып, оқып үйренген соң мұғалімнің не лаборанттың көмегімен зертханалық немесе практикалық жұмыстарды орындауға кірісуге болады. Құрал-жабдықтар: Интерактивті тақта, плакаттар № 1-5, зертханалық штатив, спиртшам, сынауықтар, химиялық стакан, түрлі колбалар, шыны таяқшалар, шұқырақтар, кәрлен табақша, тамшуыр, құйғы т.б. Сабақтың түрі Сарамандық жұмыс Әдіс-тәсілдер Жеке жұмыс Сабақ бойынша мұғалім жазбалары І.Ұйымдастыру кезеңі -Оқушылармен амандасу - Сынып құрамын түгелдеу -Бір-біріне жағымды сөздер айтып, сәттілік тілеу -Оқушыларға сарамандық жұмыс дәптер таратылып беріледі -Тақтаға күн ретін жазады. Негізгі бөлім Оқушылар қауіпсіздік техникасының ережелерімен танысу тапсырылады. Оқушыларға зертханалық құрал-жабдықтармен таныстырады. Зертханалық құрал жабдықтармен жұмыс істеп үйрену. Оқытушы лабораторияда немесе кабинеттегі лабораториялық құрал- жабдықтармен таныстырып, оларды қайда не үшін қолданылатынын айтып береді. Оқытушының көмегімен химия сабағында қолданылатын газжанарғы және спиртшаммен басқа да қыздырғыш құралдармен таныстырып, олардың жұмыс кезінде қолдануын үйретеді немесе плакаттан көрсетеді. Қорытынды бөлім № Тәжірибенің атауы, әрекеті Бақылау нәтижелері Қорытынды схемасын толтыруға нұсқау береді. Мына зертханалық ыдыстарды ата Оқушылар амандасып, бүгінгі сабаққа сәттілік тілейді. Дәптерге күн ретін жазып алады. Оқушылар қауіпсіздік техникасы ережесімен зертханалық құрал –жабдықтармен танысады Қорытынды схемасын оқушылар жеке толтырады. Толытырлған кестені әр оқушы жеке бағалап, бүгінгі сабаққа анализ жасайды. Сыныбы 8 3 сабақ Күні: Сабақтың тақырыбы: Заттар және олардың физикалық қасиеттері. Таза заттар және қоспалар. Заттарды бөлу әдістері Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Зат туралы ұғымды қалыптастыру арқылы оның дене ұғымынан айырмашылығы туралы түсінік алады. Заттарды бөлу әдістерімен таныстыру. Күтілетін нәтиже Заттардың физикалық қасиеттері туралы, таза заттар және қоспалардың анықтамасын біледі. Біртекті және әртекті қоспаларды бөлудің әдістерін түсінеді. Біртекті және әртекті қоспалардың ұқсастығы мен айырмашылығын салыстырады. Негізгі идеялар Таза заттар бір ғана заттың бөлшектерінен ал қоспалар екі не оданда көп заттардан тұрады. Суда ерімейтін әртекті қоспалар тұндыру арқылы бөлінеді, ал суда еритін заттардан тұратын біртекті қоспалар қайта кристалдану немесе айдау арқылы бөлінеді. Құрал-жабдықтар: Интерактивті тақта, 8 сынып электронды оқулық. Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер «Химиялық диктант» , жас ерекшеліктеріне байланысты сұрақтар мен тапсырмалар Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті а)Оқушылармен амандасып,сыныптағы оқушыларды 3 топқа бөлу. ә)Сынып құрамын түгелдеп, тақтаға күн ретін жазады. Кіріспе бөлім а)Оқушылардан «химиялық диктантты» орындауға нұсқау беріледі. 1.Физика пәні денелерді қарастырса, химия сол денелерді құрайтын заттарды .... (зерттейді) 2.Заттар дегеніміз- .... құраушылар (денелерді) 3.Таныс емес заттың .... білмей тұрып .... татып көруге, ... иіскеуге, .... ұстауға болмайды. (қасиетін, дәмін, иісін, қолмен) 4...... заттарды, олардың қасиеттерін, бір заттан екінші затқа айналуын және айналу кезінде жүретін құбылыстарды зерттейді. (химия пәні) 5.Химия ғылым ретінде ғасырларда қалыптасып, өзінің басты ұғымдарын ұсынып, заңдарын ашты. (ХІХ-ХХ) ә)Құмшекер, шақпақ қант, құм мен ағаш үгінділерін көрсетіп, оқушыларға ой тастау. Негізгі бөлім а)Тақтаға жаңа сабақтың тақырыбы жазылады. ә)Тақырып бойынша берілген термин сөздермен жұмыс жасалады. б)Оқушылар жеке дара мәтінмен танысып шығу тапсырылады. в)Әр топқа мәтін бөлініп беріледі. (Көрсетілім№1 (1.1)) І-топ: Заттар және олардың қасиеттері ІІ-топ:Таза заттар және қоспалар ІІІ-топ: Заттарды бөлу әдістері г)Эксперименттік бөлім Топтарға Қоспаларды бөлу әдістеріне тәжірибе көрсету. Қорытынды бөлім Өтілген тақырып бойынша оқушылар жұптық жұмыс жасайды. 1.Мыналардың:ауа,оттек,теңіз суы,өзен құмы,мыс қайсысы таза зат,қайсысы заттың қоспа екенін көрсетіңдер . 2.Қоспалар мен химиялық заттар арасында берілген бір артық сөзді көрсет. а)ауа,түтін,оттек,тұман ә)Мұнай,спирт,су,ацетон б)Өзен құмы,қант,темір кені, цемент 3.Сүзу тәсілімен ас тұзын ерітіндіден бөліп алуға бола ма? 4.Қайта кристалдану тәсілі деп неге аталғанын мысалмен түсіндір. 5.Айдау тәсілі неге негізделген? Сабақ рефлексиясын жасайды. Сабақтан кейінгі көңіл күйім. Кейінгі тапсырма: Тақырып бойынша тест тапсырмаларын құрастыру (5 тест) Үйге тапсырма беру: Заттар және олардың физикалық қасиеттері. Таза заттар және қоспалар. Заттарды бөлу әдістері Оқушылардың іс-әрекеті а)Оқушылар 3 топқа бөлініп отырады. ә)Тақтадан күн ретін көшіріп алады. Оқушылар берілген тапсырманы жеке орындап шығады. Орындалған жұмысты дайын жауап арқылы тексеріп, өзін-өзі бағалайды. Толық орындаған оқушы жұмысын шапалақ ұру арқылы мадақтау. ә)Оқушылар көрсетілген заттарға қарап өз ойларын айтады. Таза зат және қоспа ұғымары қалыптасады. Оқушылар тақырыппен танысып шығады. Тақырып мазмұнын топтық талқылауға салады. Топ атынан баяндамашы қорғайды, топ жұмысын екі жұлдыз, бір ұсыныс арқылы бағалайды. Көрсетілген тәжірибе бойынша оқушылар өз ойларын білдіреді. Оқушылар жұптық жұмысты орындап, бүгінгі сабақтан не түсінгеніне анализ жасайды. Жұптық жұмысты бір-біріне ауыстыра отырып бағалайды. Сыныбы 8 4 сабақ Күні: Сабақтың тақырыбы: №2 Сарамандық жұмыс Ластанған ас тұзын тазарту Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Жұмысқа қажетті құрал- жабдықтар туралы және қауіпсіздік ережесі жөнінде біледі Заттарды қоспадан бөлу және тазарту әдістерін ұғындыру Күтілетін нәтиже Қоспаны тазарту әдістерін қайталау арқылы сүзу, қайта кристалдау әрекеттерін орындай білуді үйренеді. Негізгі идеялар Қоспадан суда ерімтал заттарды бөлу Құрал-жабдықтар: сақиналы металл тұрғы, кәрлен табақша, шұқырақ, химиялық стакан, сүзгі қағаз, шыны таяқша, ластанған ас тұзы,су. Сабақтың түрі Сарамандық жұмыс Әдіс-тәсілдер Жеке жұмыс Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі -Оқушылармен амандасу -Сыныпта жағымды ахуал туғызу -сабақтың мақсатын айту -Сабаққа дейінгі көңіл күйім (смайлик арқылы бақылау) Кіріспе бөлім Оқушылардан қоспалар туралы сұралады. Әртекті және біртекті қоспаны бөлу әдістері жөнінде сұралып өтеді. Негізгі бөлім Оқушыларға «ластанған ас тұзын тазарту» жолдарын айтады. Жұмыстың мазмұны: а) Ластанған ас тұзын еріту (тұздың құммен қоспасы) Стақандағы ластанған тұзға 50 мл су құйыңдар. Еруді тездету үшін стақанның ішіндегісін шыны таяқшамен апаластырыңдар (абайлап, стақанның қабырғаоарына тигізбей). Тұз ерімесе, толық ерігенге дейін аздап су қосыңдар. ә)Алынған ерітіндіні сүзіп тазарту Сүзгі даярлау үшін ені құйғының диметрінен екі есе үлкен сүзгі қаағазды ортасынан екіге бүктеңдер, құйғыға салып өлшеп, құйғының шетіне 0,5см жетпей тұратындай етіп доға бойынша кесіңдер. Сүзгіні құйғыға жазып салып, ылғалдаңдар, құйғының бетіне тығыз жанасатындай етіп орналастырыңдар. Оның төменгі ұшы сүзілген ерітінді жиналатын стақанның ішкі қабырғасына тиіп тұратын болсын. Лайланған ерітіндіні сүзгіге шыны таяқша арқылы құйыңдар. Стақанға мөлдір сүзінді ағады. б) Ерітіндіні суалту Алынған сүзіндіні стақанға құйып, тұрғы сақинасына қойылған асбест торға орналастырыңдар. Әлсін-әлсін араластыра отырып, сүзіндіні толық суалғанша қыздырыңдар. Алынған тұзды бастапқысымен салыстырыңдар, қорытынды жасаңдар. (52-сурет) Қорытынды бөлім № Тәжірибенің атауы, әрекеті Бақылау нәтижелері Қорытынды схемасын толтыруға нұсқау береді. Мына зертханалық ыдыстарды ата Сабақ рефлексиясы Сабақтан кейінгі көңіл күйім Үйге тапсырма беру: Таза заттар мен қоспалар Оқушылардың іс-әрекеті Оқушылар бір-біріне бүгінгі сабаққа сәттілік тілейді, сабаққа дейінгі көңіл күйін смайликтерді көтеру арқылы білдіреді. Оқушылар қоспалар туралы білетіндерін ауызша, жазбаша (схемамен көрсетеді) түрде айтып өтеді. Оқушылар «ластанған ас тұзын тазарту» жолдарымен танысады. Қорытынды схемасын оқушылар жеке толтырады. Толытырлған кестені әр оқушы жеке бағалап, бүгінгі сабаққа анализ жасайды. Оқушылар сабақ рефлексиясын смайликтер арқылы көрсетеді. Сыныбы 8 5 сабақ Күні: Сабақтың тақырыбы: Атомдар мен молекулалар. Атом-молекулалық ілім және оның маңызы Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Атомдар мен молекулалардың анықтамасын, атом-молекулалық ілімнің қағидаларын ұсынған ғалымдар туралы білім қалыптастыру Күтілетін нәтиже Атом және молекула ұғымын, атом- молекулалық ілімнің негізгі қағидаларының мәнін түсінеді Негізгі идеялар Атом-заттың химиялық жолмен бөлінбейтін ең ұсақ бөлшегі. Молекула-заттың құрамы мен қасиетін сақтайтын ең кіші бөлшегі. Атом-молекулалық ілім-атомдар мен молекулалар жайындағы білімнің жиынтығы. Құрал-жабдықтар: АКТ, слайд, плакаттар, М.В. Ломоносовтың портреті, атом модельдері. Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер Топтық жұмыс (Джиксо 1), жас ерекшеліктерін сәкес сұрақтар мен тапсырмалар Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті а)Оқушылармен амандасып,сыныптағы оқушыларды 3 топқа бөлу. ә)Сынып құрамын түгелдеп, тақтаға күн ретін жазады. Кіріспе бөлім 1.Таза заттар дегеніміз не? 2.Қоспалар дегеніміз не? 3.Қоспаларды нешеге бөлеміз? 4.Қоспаларды бөлу әдістерін ата? 5.Құм мен тұздың қоспасын бөлудің жоспарын құрыңдар Негізгі бөлім Тақтаға жаңа сабақтың тақырыбы жазылады. Әр топқа бір тақырыптан бөлініп беріледі. І-топ: Атомдар мен молекулалар ІІ-топ: Атом-молекулалық ілімнің негізгі қағидалары ІІІ-топ: Атом мен молекуланың ұқсастығы мен айырмашылығына талдау жасау Қорытыды бөлім 1.«бастапқы заттарды құрайтын атомдарлан жаңа заттардың түзілуі химиялық реакция деп аталады» қағидасының мағынасы 2.Таразының оң жақ табақшасына ішінде көмірқышқыл газы бар ауызы ашық колба, ал сол жақ табақшаға массасы және көлемі сондай, ішінде сутегі бар колба орналастырған. Табақшалар қалпының уақыт өткен сайын өзгеруі мүмкін бе? 3. «Атом» және «молекула» сөздерін қажетті септікте пайдаланып, төмендегі сөйлемдіаяқтаңдар: а)Су ..... құрамына оттек және сутек .... кіреді; ә)Ауаның құрамында азот және оттек .... бар; б)Адам мен жануарлар тыныс алғанда оттек .... пайдаланады Кері байланыс Үйге тапсырма беру: Атомдар мен молекулалар. Атом-молекулалық ілім және оның маңызы Оқушылардың іс-әрекеті а)Оқушылар 3 топқа бөлініп отырады. ә)Тақтадан күн ретін көшіріп алады. Оқушыларға өздігінен орындау үшін тапсырма беріледі. (5 минут). Содан соң жұмыстарын алмастыру арқылы жауап үлгілері арқылы бірін-бірі бағалау жүргізеді. Оқушылар тақырыппен танысып шығады. Тақырып мазмұнын топтық талқылауға салады. Топ атынан баяндамашы қорғайды, топ жұмысын «екі жұлдыз, бір ұсыныс» арқылы бағалайды. Оқушылар жеке жұмысты орындайды, Орындалған жұмысты қол бармақтары арқылы бағалайды . Оқушылар бүгінгі жеткен жетістіктерін таным ағашын бояу арқылы көрсетеді Сыныбы 8 6 сабақ Күні: Сабақтың тақырыбы: Химиялық элементтер, олардың атаулары, таңбалары. Металдар мен бейметалдар туралы түсінік Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Химиялық элемент және оның таңбасы. Д. И Менделеев құрастырған периодтық кестесі туралы біледі. Металдар мен бейметалдар туралы түсінік қалыптастыру Күтілетін нәтиже Химиялық элементтердің таңбасы мен атауларына, металдар мен бейметалдарға талдау жасайды Негізгі идеялар Химиялық элемент-атомдардың белгілі бір түрі. Бейметалдардың металдар сияқты бәріне тән ортақ қасиеттері болмайды. Құрал-жабдықтар: АКТ, плакаттар, Дж. Дальтонның портреті, Д.И. Менделевтің периодтық кестесі Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер Жас ерекшеліктерін сәкес сұрақтар мен тапсырмалар, топтық жұмыс (Джиксо 1) Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі -Оқушылармен амандасу -Сыныпта жағымды ахуал туғызу -Оқушыларды 3 топқа бөлу (Химиялық элементтердің атауы, таңбасы, металдар бойынша бөлінеді) ІІ.Кіріспе бөлім Оқушыларға жеке тапсырмалар беріледі. 1.Қандай көрнекті ғалымдар атом-молекулалық ілімнің дамуына өз үлестерін қосты? 2.Қай қалада өткен сьезде «атом» және «молекула» ұғымдарына нақты анықтама берді? 3.Заттардың құрамы мен қасиетін сақтайтын ең кіші бөлшегі қалай аталады 4.Бірдей атомдар бірігіп нені түзеді? 5. Әр түрлі атомдар бірігіп нені түзеді? ІІІ. Негізгі бөлім -Тақтаға жаңа сабақтың тақырыбы жазылады, мақсаты таныстырылады. -Жаңа терминдермен жұмыс жасалады Оқушылар мәтінме танысып шығады. Мәтін бойынша постер құрастырады. 1.«Химиялық элемент» дегеніміз не? 2.Табиғатта қанша химиялық элемент түрі кездеседі? 3.Химиялық элементтерді қандай екі топқа бөледі, аттарын атаңдар. Осы элементтердің химиялық таңбаларын жазыңдар. 4.Химиялық элемент атомдары ұғымдарын пайдаланып, жай және күрделі заттардың анықтамасын беріңдер. №1 Зертханалық тәжірибе (1.1) орындалады. IV. Қорытынды бөлім Оқушыларға жеке жұмыс жасау тапсырылады. 1.Химиялық элемент алғаш енгізген ағылшын ғалымы- 2.Химиялық таңбаны ұсынған шведтің әйгілі химигі- 3.Коэффицент дегеніміз не? 4.Химиялық таңба нені бейнелейді? 5.Оттегі, азот, көміртегі, сутегі, иод, кальций, көміртектің таңбалары қандай? Кері байланыс Үйге тапсырма беру: Химиялық элементтер, олардың атаулары, таңбалары. Металдар мен бейметалдар туралы түсінік Оқушылардың іс-әрекеті Оқушылар бүгінгі сабаққа қажетті құрал – жабдықтарын алады. 3- топқа бөлініп отырады. . Оқушылар жеке жұмыс жасап жауап береді. Берілген жауапты дайын жауап үлгілері арқылы өзін-өзі бағалайды. Оқушылар тақырып пен жаңа ұғымдарды жазып алады. Жетекші сұрақтарға жауап береді. Топ ішінде талқылап топ атынан баяндамашы қорғайды. Топ жұмысын екі жұлдыз, бір ұсыныс арқылы бағалайды. Оқушылар жеке жұмыс жасап жауап береді, өз жауаптары арқылы өзін-өзі бағалайды. Сабақ рефлексиясын жазады Сыныбы 8 7 сабақ Күні: Сабақтың тақырыбы: Жай және күрделі заттар. Салыстырмалы атомдық масса. Салыстырмалы молекулалық масса Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Жай және күрделі заттар, салыстырмалы атомдық және молекулалық масса туралы түсінік алады. Күтілетін нәтиже Жай және күрделі заттардың салыстырмалы атомдық және молекулалық массасларын есептеуге үйренеді. Негізгі идеялар Бірдей атомдар бірігіп жай заттар, ал әртүрлі атомдар бірігіп күрделі заттар түзеді. Салыстырмалы молекулалық масса өлшемсіз шама, өйткені оны құрайтын элементтердің салыстырмалы атомдық массасының да өлшемі жоқ. Құрал-жабдықтар: АКТ, слайд, маркер, 8 сынып электронды оқулық Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар. Венн диаграммасы Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі а)Оқушылармен амандасып,сыныптағы оқушыларды 3 топқа бөлу. ә)Сынып құрамын түгелдеп, тақтаға күн ретін жазады. II. Кіріспе бөлім Жауап үлгілері бар жұптарда өзара бағалау 1.Химиялық таңбаның оқылуы және айтылуы арқылы таңбасын жазыңдар? Эн, Барий, силициум, плюмбум, марганец, гидраргирум 2.Элементтің қазақша атауы арқылы химиялық таңбасын және айтылуын жазыңдар Алтын, мырыш, сутек, сынап, кальций, темір, фтор, қоғасын, бор, бром, көміртек. 3.Магнийдің 2 атомы, күкірттің 8 атомы дегенді қалай жазуға болады? III. Негізгі бөлім Тақтаға жаңа сабақтың тақырыбы жазылады. Сабақтың мақсаты айтылады. Оқушылар мәтінмен жұмыс жасайды. І- тапсырма: Әр топқа мәтін бөлініп беріледі. І-топ: Жай және күрделі заттар ІІ-топ: Химиялық элементтердің салыстырмалы атомдық массаслары ІІІ-топ: Заттың салыстырмалы молекулалық массасы ІІ. №1 Көрсетілім (1.2) орындалады ІІІ-тапсырма: венн диаграмасы Оқушылардан жай және күрделі заттардың, салыстырмалы атомдық масса мен салыстырмалы молекулалық массаның ұқсастығы мен айырмашылығына талдау жасайды. ІV.Қорытынды бөлім Оқушылар жеке жұмыс жасайды. 1.Заттың жай немесе күрделі екенін қалай анықтауға болады? 2.Cалыстырмалы атомдық және молекулалық массалардың өлшем бірліктері қандай? 3.Мына заттарды жай және күрделі заттарға жіктей отырып олардың салыстырмалы атомдық және молекулалық массаларын табыңдар. H2SO4, CH4, H2S, Lі, Be. 4.Мыналардың: көміртегі атомының, су молекуласының, магний атомының, оттегі молекуласының қайсысының массасы үлкен? 5. Мына заттардың формулалары берілген: O3, S4, CaCO3, Na, H3PO4, P4, NaOH. Осылардың ішінде жай заттар санын және молекулалық массасы ең ауыр затты анықтаңыз: Сабақ рефлексиясы Кейінгі тапсырма: Тақырып бойынша тест тапсырмаларын құрастыру (5 тест) Үйге тапсырма беру: Жай және күрделі заттар. Салыстырмалы атомдық масса. Салыстырмалы молекулалық масса Оқушылардың іс-әрекеті а)Оқушылар 3 топқа бөлініп отырады. ә)Тақтадан күн ретін көшіріп алады. Оқушыларға өздігінен орындау үшін тапсырма беріледі. (5 минут). Содан соң жұмыстарын алмастыру арқылы жауап үлгілері арқылы бірін-бірі бағалау жүргізеді. Оқушылар тақырыппен танысып шығады. Тақырып мазмұнын топтық талқылауға салады. Топ атынан баяндамашы қорғайды, топ жұмысын критерий арқылы бағалайды. Венн диаграммасы Оқушылар жеке жұмысты орындап, бүгінгі сабақтан не түсінгенінне анализ жасай алады. Оқушылар сабақ рефлексиясын жазады. Сыныбы 8 8 сабақ Күні: Сабақтың тақырыбы: Зат мөлшері. Молярлық масса Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Зат мөлшері. Моль. Авогадро саны. Молярлық массаның анықтамаларын біледі Зат мөлшері. Молярлық массаның ұқсастығы мен айырмашылығына талдау жасайды Күтілетін нәтиже Зат мөлшері, моль, молярлық масса ұғымдарын пайдаланып есептер шығарады. Негізгі идеялар Зат мөлшері мольмен өрнектеледі. Заттың әр молінің массасы молярлық масса деп аталады. Құрал-жабдықтар: Интерактивті тақта, Д.И. Менделеевтің периодтық жүйесі, маркерлер. Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар. Жеке жұмыс (Кім жылдам?) Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі -Техника даярлығы -Оқушылардың сабаққа даярлығы -Оқушыларды түгелдеу -Оқушылардың зейінін сабаққа аудару ІІ.Кіріспе бөлім Оқушыларға жұптық тапсырмалар беріледі. 1.Мына заттарды жай және күрделі заттарға жіктей отырып олардың салыстырмалы атомдық және молекулалық массаларын табыңдар. SO3 , S . SO2 , Ca, Fe2O3, Cu(NO3)2 2. Мына заттардың формулалары берілген: O3, S4, CaCO3, Na, H3PO4, P4, NaOH. Осылардың ішінде жай заттар санын және молекулалық массасы ең ауыр затты анықтаңыз: ІІІ. Негізгі бөлім -Тақтаға жаңа сабақтың тақырыбы, -жаңа терминдер мен ұғымдар жазылады - Зат мөлшері. Молярлық масса туралы түсінік беріледі -Оқушыларға мәтінмен танысу тапсырылады Оқушылар топтық жұмыс жасайды І-топ:Зат мөлшері. Моль ІІ-топ:Авогадро саны ІІІ-топ:Молярлық масса Кім жылдам? 1.Зат мөлшері ретінде алынған физикалық шама? (зат мөлшері) 2.Зат мөлшерінің шартты белгісі (v-ню) 3.Зат мөлшерінің өлшем бірліг і (моль, л/моль) 4.Авогадро саны (NA) 6.02*1023 5.Әрбір заттың бір молінің массасы қалай аталады? (молярлық масса) І V. Қорытынды бөлім Оқушылар жеке жұмыс жасайды. 1. Азот қышқылының мольдік массасы 2.Құрамында 3,01×1023 оттек атомдары бар натрий гидроксидінің зат мөлшері 3. Зат мөлшері 3 моль күкірт қышқылының массасы? Сабақ рефлексиясын жазады. Кері байланыс Үйге тапсырма беру: Зат мөлшері. Молярлық масса Оқушылардың іс-әрекеті Оқушыларға топқа бөлініп отырады және күн ретін тақтадан көшіріп алады Оқушылар берілген тапсырманы өз жұбымен орындайды. Орындалған тапсырманы тексеріп «екі жұлдыз, бір ұсыныс» арқылы бағалайды. Оқушылар тақырыпты, жаңа терминдер мен ұғымдарды дәптерлеріне жазып алады Оқушылар берілген тапсырмаға өз ойлары мен түсініктерін пайдаланып топ ішінде талқылап, мысалдар келтіреді. Топ атынан баяндамашы қорғайды. Қорғалған жұмысты «екі жұлдыз, бір ұсыныс » арқылы бағалайды. Оқушылар берілген сұрақтарға жылдам жауап беріп, дайын жауаптары арқылы өзін-өзі бағалайды. Оқушылар жеке жұмысты орындайды. Сабағымыздың тақырыбына қайта оралайық. Сабақтың басында қандай мақсат қойдық? Біз сол мақсатқа жете алдық па? Сыныбы 8 9 сабақ Күні: Сабақтың тақырыбы: Химиялық формулалар. Валенттілік. Зат құрамының тұрақтылық заңы. Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Химиялық формулаларды құрастыруды, валенттілікті пайдалануды, зат құрамының тұрақтылық заңы туралы ұғындыру. Күтілетін нәтиже Заттың формуласындағы атомның валенттілігін анықтайды. Атомдардың бір-бірімен белгілі қатынаста қосылатынын түсінеді. Негізгі идеялар Химиялық формула-химиялық тілдің ең маңызды бөлігі. Валенттіліктің өлшемі ретінде сутек атомы валенттігінің мәні алынған, ол 1-ге тең. Заттың құрамы көбіне оның алу тәсіліне тәуелсіз, сондықтан тұрақты болып келеді. Құрал-жабдықтар: Интерактивті тақта, Д.И. Менделеевтің периодтық жүйесі Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер «Ыстық орындық» ойыны, топтық жұмыс Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі -Оқушылармен амандасу -Сыныпта жағымды ахуал туғызу ІІ. Кіріспе бөлім Оқушыларға жеке тапсырмамен жұмыс жасау тапсырылады. 1.Зат мөлшері 0,5 моль натрий карбонатының массасын анықтаңыз. 2. Массасы 814 г кальций гидроксидінің моль саны ... ІІІ. Негізгі бөлім -Тақтаға жаңа сабақтың тақырыбы жазылады. -Бүгінгі сабақтың мақсаты таныстырылып өтіледі. -жаңа терминдер мен ұғымдармен жұмыс жасайды - Мәтінмен танысу тапсырылады. -Мәтінмен танысып болған соң мәтін бөлініп беріледі. І-тапсырма: Оқушылар топтық жұмыс жасайды І-топ:Химиялық формулалар ІІ-топ: Валенттілік ІІІ-топ:Зат құрамының тұрақтылық заңы І-тапсырма:»Ыстық орындық» ойыны І V. Қорытынды бөлім 1. .Барий ортофосфатының молярлық массасы 2.Құрам тұрақтылық заңын тұжырымдаған француз ғалымы? 3. Берілген оттекті қосылыстардағы мыс, темір, марганец элементтерінің валенттігін табыңдар: Cu2O, CuO, FeO, Fe2O3, MnO2, Mn2O3, Mn2O7. 4. Берілген қосылыстардың формуласы бойынша бірінші тұрған элементтің валенттігін анықтаңдар: а) І валентті хлордың қосылыстары: KCL, MgCl2, FeCl3 б)ІІ валентті күкірттің қосылыстары: K2S, CaS, Al2S3, Cu2S 5.Мына элементтерді пайдаланып формула құрастырыңдар: Н, О. С, K, Na Үйге тапсырма беру: Химиялық формулалар. Валенттілік. Зат құрамының тұрақтылық заңы. Оқушылардың іс-әрекеті Оқушыларға топқа бөлініп отырады және күн ретін тақтадан көшіріп алады Оқушылар берілген жеке тапсырманы орындайды. Орындалған тапсырманы өзі тексеріп бағалайды. Оқушылар тақырыпты жаңа терминдер мен ұғымдарды дәптерлеріне жазып алады Оқушылар мәтінмен танысып шығады. Мәтінді топ ішінде талқылап, барлық ақпаратты қағаз бетіне түсіреді. Топ атынан баяндамашы қорғайды. Критерий алу арқылы бағалайды. Оқушылар жеке жұмысты орындап, бүгінгі сабақтан не түсінгенінне анализ жасай алады. Сыныбы 8 10 сабақ Күні: Сабақтың тақырыбы: Физикалық және химиялық құбылыстар. Химиялық реакциялар Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Күнделікті табиғатта кездесетін денелер мен заттардың өзгеріске қалай ұшырайтынын еске түсіре отырып, осы құбылыстардың айырмашылығы мен ұқсастығын ажыратады. Химиялық реакцияларға тән белгілер туралы түсінік қалыптастыру Күтілетін нәтиже Физикалық және химиялық құбылыстарды ажыратады. Химиялық реакциялардың белгілері туралы біледі Негізгі идеялар Физикалық құбылыстың құрамы өзгермейді. Химиялық құбылыс кезінде бір заттар екінші заттарға айналады. Химиялық реакциялардың жүруінің белгілері жаңа заттардың түзілуімен сипатталады. Құрал-жабдықтар: Интерактивті тақта, ЭО.Химия. 8 сынып. Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер Жеке, топтық тапсырмалар, «Химиялық жүріс» ойыны Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі а)Оқушылармен амандасып,сыныптағы оқушыларды 3 топқа бөлу. ә)Сынып құрамын түгелдеп, тақтаға күн ретін жазады. ІІ. Кіріспе бөлім Оқушыларға жеке тапсырмалар беру 1.Nа,О,Р,Рb-элементтер қатарынан тұрақты валенттілік көрсететін элементтердің таңбаларын бөліп жазып беріңдер? 2.ZnСІ2-формуласы қалай оқылатынын жазып көрсет (Мысалы : Н2О – аш- екі- о) 3.К(І)О, Ғе(ІІІ)СІ қосылыстарының формулаларын құрастырыңдар (Жақша ішінде элементтердің валенттіліктері көрсетілген 4. 5.Берілген атом топтары валенттіліктері бойынша х және у -ті сәйкес индекстерге ауыстырып күрделі заттардың формулаларын құрастырыңдар? Nіх(ОН)у Мnх(NО3)у 5.Зат құрамының тұрақтылық заңы дегеніміз не? ІІІ. Негізгі бөлім 1.Тақтаға жаңа сабақтың тақырыбы жазылады, 2. Жаңа ұғымдар мен терминдерді теріп жазу тапсырылады. 3.Мәтінмен танысу тапсырылады І-тапсырма.Мәтін топтарға бөлініп беріледі І-топ:Физикалық және химиялық құбылыстар ІІ-топ: Химиялық реакциялардың белгілері ІІІ-топ: Физикалық және химиялық құбылыстар. Химиялық реакциялардың белгілерінің ұқсастығы мен айырмашылығы. ІІ-тапсырма «Химиялық жүріс» ойыны. Ойынның шарты: Әр топтан 1 оқушыдан шығып, көрсетілген жерге дейін адымдап құбылыстар мен химиялық реакцияның белгілеріне мысалдар келтіреді. І-топ:Химиялық реакцияның белгісіне ІІ-топ:Физикалық құбылыс ІІІ-топ: Химиялық құбылыс Эксперименттік бөлім Көрсетілім №1 (1.3) Зертханалық тәжірибе №1 (1.2, 1.3) І V .Қорытынды бөлім Оқушылардан « ACTIV ote» құрылғысы арқылы қысқа тест алынады. 1. Физикалық құбылыс – А. Денелерді құраушылар В. бір зат екінші бір затқа айналады С. Дененің пішіні, заттардың агрегаттың күйі өзгеріске ұшырайды, ал құрамы өзгермейді 2. Химиялық құбылыс – А. Денелерді құраушылар В. бір зат екінші бір затқа айналады С. Дененің пішіні, заттардың агрегаттың күйі өзгеріске ұшырайды, ал құрамы өзгермейді 3. Химиялық құбылысты тап А. мыс пластинкасын қыздырғандағы оның қараюы В. қантты ұнтақтау С. мұздың еруі 4. Химиялық реакцияның жүру белгісіне жатады: А. судың булануы; В. тұнбаның түсуі; С. қыраудың қатуы. 5. Химиялық реакцияның жүру белгісіне жатпайды: А. тұнбаның түсуі; В. газдың бөлінуі; С. агрегаттық күйінің өзгеруі. ІІ-тапсарма Берілген сұрақтарға жауап жазады 1.Мыналарды а)ағашта қыраудың түзілуін; б)мыстан жасалған бұйымдарда жасыл дақтардың пайда болуын; в)темірдің таттануын физикалық немесе химиялық құбылыстардың қайсысына жатқызуға болады? 2.Сусыз мыс сульфаты-ақ түсті. Оған су қосқанда қызады да көгілдір түсті ерітінді түзіледі? Бұл кезде физикалық немесе химиялық құбылыстың қайсысы байқалады? Жауаптарыңды түсіндіріңдер Сабақ рефлексиясын жазу тапсырылады. Үйге тапсырма беру: Физикалық және химиялық құбылыстар. Химиялық реакциялар Оқушылардың іс-әрекеті а)Оқушылар 3 топқа бөлініп отырады. ә)Тақтадан күн ретін көшіріп алады. Оқушылар сұрақтарға жауап береді. Берілген жауапты дайын жауаптары арқылы тексеріп өзін-өзі бағалайды. Оқушылар тақырып пен жаңа ұғымдарды жазып алады. Оқушылар мәтінмен таныса отырып жеке жұмыс жасайды.Топ ішінде талқылайды. Әр топ өзара(екі жұлдыз, бір ұсыныс арқылы) бағалайды Берілген тапсырма бойынша ұтқыр мысал келтірген оқушыны шапалақ ұру арқылы бағалау. Оқушылар қысқа тестпен жұмыс жасайды. Өз жауаптары арқылы өзін-өзі бағалайды. Жұптарда өзара бағалауды жүзеге асырады. Жұбының жұмысын «екі жұлдыз, бір ұсыныс» арқылы бағалайды Оқушылар бүгінгі сабақтан ұнағанын, қиын болғанын стиктерге жазып іледі. Сыныбы 8 11 сабақ Күні: Сабақтың тақырыбы: Химиялық реакция теңдеулері. Зат массасының сақталу заңы Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Зат массасының сақталу заңы туралы, реагенттер мен өнңмдер туралы түсінік алады. Химиялық реакция теңдеулерін құру жолдарымен танысады. Күтілетін нәтиже Реагент және өнім туралы және зат массасының сақталу зыңының анықтамасын біледі Химиялық реакция теңдеулерін құру шарттарын, зат массасының сақталу заңының маңызын түсінеді. Химиялық реакция теңдеулерін жазады. Негізгі идеялар Химиялық реакция теңдеуі-бастапқа заттардың соңғы заттарға айналуын сипаттайды. Заттар массасының сақталу заңы-реакцияға дейінгі заттардың массасының реакциядан кейін де өзгермей сақталатынын көрсетеді. Құрал-жабдықтар: Интерактивті тақта, маркерлер, плакаттар Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер Жұптық жұмыс. жас ерекшеліктеріне сай сұрақтар мен тапсырмалар Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі а)Оқушылармен амандасып,сыныптағы оқушыларды 3 топқа бөлу. ә)Сынып құрамын түгелдеп, тақтаға күн ретін жазады. ІІ. Кіріспе бөлім Жұптық жұмыс Оқушылар жұптық жұмыс жасай отырып берілген сұрақтарға жауап береді 1.Автомобил двигателі жұмысы физмкалық және химиялық құбылыстармен байланысты екенін қандай деректермен дәлелдеуге болады? Жауаптарыңды түсіндіріңдер 2.Май шам жанғанда қандай құбылыс байқалады? Мұнда жаңа заттар түзілеме, түзілсе қандай заттар түзіледі және олардың түзілгенін қалай дәлелдеуге болады? 3.Мыналарда: а)суды айдағанда; б)ағашты құрғақ айдағанда химиялық өзгерістер байқала ма? ІІІ.Негізгі бөлім Тақтаға жаңа сабақтың тақырыбы жазылады, Жаңа ұғымдар жазылады. 1.Химиялық теңдеу деген не? 2.Химиялық теңдеу құрудың басты шарты қандай? 3.Химиялық теңдеу мен алгебралық теңдеудің қандай ұқсастықтары және қандай айырмашылығы бар? 4. Зат массасының сақталу заңын қалай түсінесіңдер? 5.Неге реагенттер мен өнімдердің массалары бірдей болады әрі өзгермейді? Атом-молекулалық ілім тұрғысынан түсіндіріңдер. 6.М.В. Ломоносов тәжірибесінің мәнін қалай түсінесіңдер? І V . Қорытынды бөлім 1.Мына реакция теңдеулерін теңестір ZnO + C = Zn + CO; TiCI4 + 2Mg = Ti + 2 MgCI2 MoO3 + 3H2= Mo + 3H2O; Cr2O3 + 2 AI = 2Cr + AI2O3 2.Ағаш жанған соң аздаған күл қалады. Неге ағаштың массасы күлдің массасына тең емес? Қалған өнімдер қайда кетті? 3.Сынап оксиді ыдырағанда 4г оттек пен 50,2 г сынап шықты. Реакцияға кіріскен күрделі заттың массасы қанша? Үйге тапсырма беру: Химиялық реакция теңдеулері. Зат массасының сақталу заңы Оқушылардың іс-әрекеті а)Оқушылар 3 топқа бөлініп отырады. ә)Тақтадан күн ретін көшіріп алады. Оқушылар өз жұбымен жұмыс жасап сұрақтарды талқылайды. Жауаптың дұрыс және бұрыстығына көз жеткізіп, смайликті жапсыру арқылы бағалайды Оқушылар тақырып пен жаңа ұғымдарды жазып алады. Жетекші сұрақтарға жауап бере отырып жеке жұмыс жасап, топ ішінде талқылайды. Әр топ өзара бағалайды Критерий жасақтау Оқушылар жеке жұмыс жасайды. Өз жұмысын топта талқыға салып, дұрыс немесе бұрыс екеніне көз жеткізіп, бағалайды. Сабақ рефлексиясын жазып, стиктер арқылы тақтаға іледі Сыныбы 8 12 сабақ Күні: Сабақтың тақырыбы: Химиялық реакциялардың типтері: қосылу, айырылу Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Химиялық реакцияларды реагенттер мен өнімдерге, олардың құрамындағы өзгерістерге қарап, төрт типке бөлетіні туралы түсінік алады. Қосылу және айырылу реакцияларымен танысады. Күтілетін нәтиже Химиялық реакция типтерін, қосылу және айырылу реакцияларының анықтамасын біледі Қосылу және айырылу реакцияларын жазады. Негізгі идеялар Қосылу реакциясының нәтижесінде екі немесе одан да көп заттар бірігіп, жаңа күрделі бір затқа айналады. Айырылу реакциясының нәтижесінде бір күрделі зат ыдырап, бірнеше жаңа зат түзіледі. Құрал-жабдықтар: Интерактивті тақта, ЭО. Химия 8 сынып, «ACTIV ote» тест құрылғысы Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер Топтық жұмыс (Джиксо 1) Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі а)Оқушылармен амандасып,сыныптағы оқушыларды 3 топқа бөлу. ә)Сынып құрамын түгелдеп, тақтаға күн ретін жазады. ІІ.Кіріспе бөлім Жұптық жұмысқа тапсырма береді. 1.Берілген сызбанұсқадағы белгісіз коэффициенттердің қосындысы 2.Реакция схемасындағы барлық коэффициенттердің саны: Al + Fe3O4 ® Al2O3 + Fe. 3.Реакция схемасындағы тек күрделі заттардың алдындағы коэффициенттердің қосындысы: NH3 + O2 ® N2 + H2O. ІІІ. Негізгі бөлім Тақтаға жаңа сабақтың тақырыбы жазылады. Жаңа ұғымдармен жұмыс жасалады. Мәтінмен танысып шығады. І-тапсырма: Мәтін топтарға бөлініп беріледі. І-топ: Қосылу реакциясы ІІ-топ: Айырылу реакциясы ІІІ-топ: Айырылу және қосылу реакцияларының ұқсастығы мен айырмашылығын табады. ІІ-тапсырма: Эксперименнттік бөлім. Зертханалық тәжірибе №2 (2.1.2.2) Оқушыларға айырылу және қосылу реакциялары байланысты тәжірибе көрсетіледі. Көрсетілген тәжірибе бойынша жұпта талқылап, қорытынды шығарады. IV. Қорытынды бөлім Оқушылардан « ACTIV ote» құрылғысы арқылы қысқа тест алынады. 1.Айырылу реакциясы A) K2O + SO3® K2SO4 B) AgNO3 + NaCl ® AgCl¯ + NaNO3 C) ZnSO3 + 2HCl ® ZnCl2 + H2O +SO2 D) CuCl2 + Fe ® Cu + Fe Cl2 E) MgCO3 MgO + CO2 2.Қосылу реакциясы A) K2O + SO3 ® K2SO4 B) MgCO3 MgO + CO2 C) CuCl2 + Fe ® Cu + FeCl2 D) AgNO3 + NaCl ® AgCl¯ + NaNO3 E) ZnSO3 + 2HCl ® ZnCl2 + H2O + SO2 3.2HgO ® 2Hg+O2 реакция типі A) орын басу B) бейтараптану C) алмасу D) айырылу E) қосылу 4.Айырылу реакциясы: A) 2KClO3 ® 2KCl + 3O2 B) CuO + 2HCl ® CuCl2 + H2O C) 2H2 + O2 ® 2H2O D) Fe + CuCl2 ® Fe Cl2 + Cu E) 2Na + 2HCl ® 2Na Cl + H2 5.Реакция типін анықтаңыз: 1) 2KClO3 ® 2KCl + 3O2 2) 2H2 + O2 ® 2H2O A) 1-қосылу, 2-орынбасу B) 1-айырылу, 2-қосылу C) 1-алмасу, 2-қосылу D) 1-айырылу, 2-алмасу E) 1-айырылу, 2-орынбасу Кері байланыс Үйге тапсырма беру: Химиялық реакциялардың типтері: қосылу, айырылу Оқушылардың іс-әрекеті а)Оқушылар 3 топқа бөлініп отырады. ә)Тақтадан күн ретін көшіріп алады. Оқушылар берілген тапсырманы өз жұбымен біріге отырып орындайды. Орындалған жұмысты дайын жауаптар арқылы тексеріп, өздерін бағалайды. Оқушылар тақырып пен жаңа ұғымдарды жазып алады. Берілген мәтінмен таныса отырып, топ ішінде талқылайды. Талқыланған жұмысты топ атынан баяндамашы қорғайды. Қорғалған жұмысты «екі жұлдыз, бір ұсыныс» арқылы бағалайды Оқушылар жеке жұмыс жасайды. Өзін-өзі бағалайды. Сабақ рефлексиясын жазады. Сыныбы 8 13 сабақ Күні: Сабақтың тақырыбы: Химиялық реакциялардың типтері: алмасу, орынбасу Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Алмасу, орынбасу реакцияларымен танысып, ұқсастығы мен айырмашылығын ажыратады. Күтілетін нәтиже Химиялық реакция типтерін, алмасу және орынбасу реакцияларының анықтамасын біледі Химиялық реакция теңдеулерін жазу қабілеті қалыптасады. Негізгі идеялар Орынбасу реакциясы жай заттар мен күрделі заттардың әрекеттесіп, жай және күрделі заттардың түзілуін айтады. Алмасу реакциясы екі күрделі зат қатысуымен іске асады. Құрал-жабдықтар: Интерактивті тақта, ЭО. Химия 8 сынып, «ACTIV ote» тест құрылғысы Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер Жеке, топтық жұмыстарға тапсырмалар Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі -Техника даярлығы -Оқушылардың сабаққа даярлығы -Оқушыларды түгелдеу -Оқушыларды қосылу, айырылу, орынбасу реакция типтері жазылған парақшалар арқылы 3 топқа бөлу -Оқушылардың зейінін сабаққа аудару ІІ. Кіріспе бөлім Оқушылардан « ACTIV ote» құрылғысы арқылы қысқа тест алынады. 1.Магний мен оттектің әрекеттесу реакциясының типі: A) гидрлену. B) орын басу. C) алмасу. D) айырылу. E) қосылу. 2.Қосылу реакциясын табыңыз. A) NіCl2 + 2NaOH Nі(OH)2 + 2NaCl. B) Cu(OH)2 CuO + H2O. C) 2Na + Cl2 2NaCl D) Fe + CuCl2 FeCl2 + Cu. E) 4KClO3 = KCl + 3KClO4 3.Егер химиялық реакцияның графикалық кескіні төмендегідей болса: Онда реакция типі: A) Айырылу. B) Бейтараптану. C) Орын басу. D) Қосылу. E) Алмасу. 4. Реакция типін анықтаңыз: 1) 2KClO3 ® 2KCl + 3O2 2) 2H2 + O2 ® 2H2O A) 1-қосылу, 2-орынбасу B) 1-айырылу, 2-қосылу C) 1-алмасу, 2-қосылу D) 1-айырылу, 2-алмасу E) 1-айырылу, 2-орынбасу 5.Айырылу реакциясы A) K2O + SO3® K2SO4 B) AgNO3 + NaCl ® AgCl¯ + NaNO3 C) ZnSO3 + 2HCl ® ZnCl2 + H2O +SO2 D) CuCl2 + Fe ® Cu + Fe Cl2 E) MgCO3 MgO + CO2 6. Берілген теңдеудің (...H2 + O2 ®...H2O) коэффициенттері: A) 1, 3 B) 2, 3 C) 2, 1 D) 1, 4 E) 2, 2 7. Қосылу реакциясына жатпайды: A) 2H2 + O2 ® 2H2O B) N2 + 3H2 ® 2NH3 C) Fe + S® FeS D) 2Cu+О2®2CuО E) NH4Cl ® NH3 + HCl 8. Айырылу реакциясына жатпайды: A) NH4Cl ® NH3 + HCl B) 2KClO3 ® 2KCl + 3O2 C) Сu(OH)2 ® CuO + H2O D) Fe + CuCl2 ® Fe Cl2 + Cu E) 4KClO3 ® KCl + 3KClO4 9.Реакция теңдеуіндегі жазылмай кеткен коэффициенттер санын көрсетіңдер: ... Ba + O2 ®... BaO A) 4, 4 B) 3, 3 C) 5, 5 D) 2, 2 E) 1, 1 10.Реакция типін анықтаңыз: 1) 2Fe + 3Cl2 ® 2FeCl3 2) 2Al(OH)3 ® Al2O3 + 3H2O A) 1-айырылу, 2-алмасу B) 1-қосылу, 2-орынбасу C) 1-алмасу, 2-қосылу D) 1-қосылу, 2-айырылу E) 1-айырылу, 2- орынбасу ІІІ. Негізгі бөлім Тақтаға жаңа сабақтың тақырыбы жазылады. Жаңа ұғымдармен жұмыс жасалады. Мәтінмен танысып шығады. І-тапсырма: Мәтін топтарға бөлініп беріледі. І-топ: Орынбасу реакциясы ІІ-топ: Алмасу реакциясы ІІІ-топ: Орынбасу мен алмасу реакцияларының ұқсастығы мен айырмашылығын табады. ІІ-тапсырма: Эксперименнттік бөлім. Зертханалық тәжірибе №2 (2.3.2.4) Оқушыларға орынбасу және алмасу реакциялары байланысты тәжірибе көрсетіледі. Көрсетілген тәжірибе бойынша жұпта талқылап, қорытынды шығарады IV. Қорытынды бөлім 1.Орынбасу және алмасу реакциялары дегенміз не? 2.Мына реакция типі орынбасу реакциясына жатады ма? HNO3 + KOH = KNO3 + H2O ия жоқ 3.Реакцияның типін анықтаңыз PbO + H2 4.Егер химиялық реакция схемасы: А + ВД ® АД + В болса, онда реакция типі: 5.Егер химиялық реакция схемасы: АВ + СД ® АС + ВД болса, онда реакция типі: Сабақ рефлексиясы Үйге тапсырма беру: Химиялық реакциялардың типтері Оқушылардың іс-әрекеті Оқушылар бүгінгі сабаққа қажетті құрал – жабдықтарын алады. 3- топқа бөлініп отырады. Оқушылар тест тапсырмаларына жеке жауап береді. Берілген жауап нәтижесі бойынша өзін-өзі бағалайды. Оқушылар тақырып пен жаңа ұғымдарды жазып алады. Берілген мәтінмен таныса отырып, топ ішінде талқылайды. Талқыланған жұмысты топ атынан баяндамашы қорғайды. Қорғалған жұмысты «екі жұлдыз, бір ұсыныс» арқылы бағалайды Оқушылар жеке жұмыс жасайды. Орындалған жұмыстарды топ ішінде талқылайды. Жұмыстарының дұрыс немесе бұрыс екеніне көз жеткізеді. Сабақ рефлексиясын жазады Сыныбы 8 14 сабақ Күні: Сабақтың тақырыбы: Сандық есептер шығару Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Химиялық формулалар пайдаланып, түрлі тәсілдермен есептеулер жүргізуге дағдыландыру Күтілетін нәтиже Есеп шығару қабілеттері дамиды Негізгі идеялар Химиялық формулалар бойынша есептер Құрал-жабдықтар: Интеактивті тақта, Д.И. Менделеевтің периодтық жүйесі Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер Топтық жұмыс (Джиксо 1) Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі -Оқушылармен амандасу -Сынып құрамын түгелдеу -Сынып тазалығына мән беру -Сыныпты 3 топқа бөлу ІІ. Кіріспе бөлім Оқушылардан химиялық реакция типтері туралы сұралады. Жұптық жұмыс жасау тапсырылады. Схеманы толтырып, мысалдар арқылы түсіндіріңдер. Реакция типтері 2.Мына химиялық реакция теңдеулерін теңестіріп, қай реакция типіне жататынын анықтаңдар. СаСO3 =CaO + CO2 H2O = H2 +O2 CuSO4 + 2KOH = Cu(OH)2 ↓+ K2 SO4 HgO → Hg + O2 ↑ ІІІ. Негізгі бөлім -Тақтаға бүгінгі күннің тақырыбы жазылады. -Оқушыларға сабақтың мақсаты таныстырылады. І-тапсырма: Топтарға есептердің шығару жолдары бар парақшалар таратылады. -Парақшалар арқылы топтық жұмыс жасайды ІІ-тапсырма: Топтарға сандық есептер беріледі. І-топ: Магний хлоридіндегі хлордың массалық үлесі ... ІІ-топ: Глюкоза С6 Н12 О6 құрамындағы элементтердің массалық қатынастары 1 : 16 : 24 ІІІ-топ: Құрамында 63,63 % азот және 36,37 % оттегі бар қосылыстағы азоттың валенттігі: IV. Қорытынды бөлім Оқушыларға жұптық жұмыс беріледі 1.Реакциялардың типтерін анықтап, теңестіріңдер 1)Fe+Cl3→FeCl3 2) Аl(OH)3→Al2O3+H2 O 2.65г алюминий гидроксидінің зат мөлшері 0,83 моль 3. Құрамында 49,55 % марганец және 50,45 % оттегі бар қосылыстағы марганецтің валенттігі ... Сабақ рефлексиясы Үйге тапсырма беру:Қайталау Оқушылардың іс-әрекеті Оқушыларға топқа бөлініп отырады және күн ретін тақтадан көшіріп алады Оқушылар берілген тапсырманы өз жұбымен орындап шығады. Орындалған жұмысты тексеріп бағалайды. Қол бармақтары арқылы бағалайды. Оқушылар тақырыпты жазып алады. Сабақтың мақсатымен танысып соған жету жолдарын қарастырады. Топтарда парақшаларда берілген есептерді талқыға салып топ атынын баяндамашы қорғайды. Берілген сандық есепті шығарудың алгоритімін құрып, есепті жеке шығарады. Топ ішіне салып талқылып топ атынын баяндамашы қорғайды. Критерий арқылы бағалау Оқушылар берілген тапсырманы өз жұбымен орындап шығады. Дайын жауаптары арқылы тексеріп, бағалайды. Смайликтер арқылы көрсету Сыныбы 8 15 сабақ Күні: Сабақтың тақырыбы: Сандық есептер шығару Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Химиялық реакция теңдеуін қолдана отырып, есептер шығару дағдысын қалыптастыру Күтілетін нәтиже Есеп шығару қабілеттері дамиды Негізгі идеялар Химиялық реакция теңдеулері бойынша есептеулер жүргізу Құрал-жабдықтар: Д.И. Менделеевтің периодтық жүйесі, интерактивті тақта. Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер жас ерекшеліктеріне сай сұрақтар мен тапсырмалар Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі -Оқушылармен амандасу -Сынып құрамын түгелдеу -Сынып тазалығына мән беру -Сыныпты 3 топқа бөлу ІІ. Кіріспе бөлім І-топ:Мышьяк (V) оксидіндегі - As2O5 оттектің массалық үлесі ... ІІ-топ: Құрамында 65,3 % мышьяк және 34,8 % оттегі бар қосылыстың формуласы ІІІ-топ:Мына заттағы CuO, CH4 элементтердің массалық қатынастары қандай ІІІ.Негізгі бөлім Тақтаға бүгінгі күннің тақырыбы жазылады. -Оқушыларға сабақтың мақсаты таныстырылады. І-тапсырма: Топтарға есептердің шығару жолдары бар парақшалар таратылады. -Парақшалар арқылы топтық жұмыс жасайды ІІ-тапсырма: І топқа: Зертханада оқушыға тәжірибе жасау үшін 200 г оттек керек болды. Оны алу үшін берілген реакция теңдеуі бойынша калий перманганытының қандай массасы қажет болады. ІІ топқа: Метан газы жоғары тем-да көміртек пен сутек бөле айырылады: 5 моль метанның айырылуы нәтижесінде күйенің қандай массасы түзіледі. ІІ-топқа: 3 моль магний жанатын болса, түзілетін магний оксидінің зат мөлшері: IV. Қорытынды бөлім 1.Массасы 48г алюминийді оттекпен тотықтырып, алюминий оксидінің қандай массасын алуға болады 2.Натрий сульфидінің зат мөлшері 0,5 моль. Осы үлгіні алуға жұмсалған күкірттің массасы Сабақ рефлексиясын жазады Үйге тапсырма беру: Өткен тақырыптарды қайталау. Оқушылардың іс-әрекеті Оқушыларға топқа бөлініп отырады және күн ретін тақтадан көшіріп алады Оқушылар алынған критерий бойынша жеке жұмыс жасайды (5 минут).Шығарған есептерін топ ішінде талқылап, дұрыстығына көз жеткізеді. Топ атынан баяндамашы қорғайды Оқушылар тақырыпты жазып алады. Сабақтың мақсатымен танысып соған жету жолдарын қарастырады. Топтарда парақшаларда берілген есептерді талқыға салып топ атынын баяндамашы қорғайды. Берілген сандық есепті шығарудың алгоритімін құрып, есепті жеке шығарады. Топ ішіне салып талқылып топ атынын баяндамашы қорғайды. Критерий арқылы бағалау Оқушылар жеке жұмыс жасайды. Шығарылған есептерін дұрыс жауабымен салыстырып анализ жасайды. Сабақтың басында қандай мақсат қойдық? Біз сол мақсатқа жете алдық па? Не қиын болды? Қайсы жақсы шықты. Сыныбы 8 16сабақ Күні: Сабақтың тақырыбы: Табиғаттағы тірі организмдер мен адам тіршілігіндегі химиялық реакциялар Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Табиғаттағы тірі организмдер мен адам тіршілігіндегі химиялық реакциялар туралы түсінік қалыптастыру Күтілетін нәтиже Табиғаттағы тірі организмдер туралы, адам организіміндегі химиялық элементтер жөнінде және тірі организмдер мен адам тіршілігіндегі химиялық реакциялар туралы түсінік қалыптасады Негізгі идеялар Өлі табиғаттан тірі ағзаларды өздеріне тән негізгі касиеттері аркылы бірден ажыратуға болады. Құрал-жабдықтар: АКТ, Д.И. Менделеев жасаған периодтық жүйесі. Сабақтың түрі Жаңа білімді игеру сабағы. Әдіс-тәсілдер Топтық тапсырмалар, эссе жазу Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі Оқушылармен амандасып, 3 топқа бөліп, тақатаға күннің ретін жазу ІІ.Кіріспе бөлім Жұптық жұмыс 1.7г темір күкіртпен әрекеттескенде түзілген темір (II) сульфидінің массасы (г) 11 2.325г мырыш тұз қышқылымен әрекеттескенде түзілген сутегінің зат мөлшері (моль) 5 ІІІ. Негізгі бөлім 1.Тақтаға сабақтың тақырыбы жазылады. 2.Оқушыларға мәтін беріледі 3.Мәтінмен танысу тапсырылады 4.Мәтінмен танысып болған соң интернет желісі арқылы материалдар жинақтап, постер құрастырады І-топ: «Табиғаттағы тірі организмдер мен адам тіршілігіндегі химиялық реакциялар» тақырыбын барлық ақпаратты түсіру арқылы ІІ-топ:Схема арқылы ІІІ-топ:Қима суреттерді жинау арқылы қорғау тапсырылады Қорытынды бөлім 1.Тірі организмге оны өлі табиғаттан ерекшелендіретін қандай қасиеттер тән. 2.Тірі организмдер дүниесі - құрылымы және биосферадағы функциялық рөлі жөнінен тірі организмдердің ең ірі бірлестіктері тірі организмдер дүниесінің неше түрі сараланады 3.Оқушыларға эссе жазу тапсырылады. «Табиғат-біздің анамыз» тақырыбында эссе жазу Кері байланыс Кейінгі оқу: Табиғаттағы тірі организмдер мен адам тіршілігіндегі химиялық реакциялар Оқушылардың іс-әрекеті Оқушыларға топқа бөлініп отырады және күн ретін тақтадан көшіріп алады Оқушылар сан есептерін шығарып келесі жұптық парақшаларымен ауыстырып, жұмыстарды дайын жауап арқылы тексереді. Есепті алынған критерий бойынша бағалайды. 1.Оқушылар тақырыпты жазып алады. 2.Мәтінмен танысып шығады 3.Топ ішінде талқылайды. 4.Өз жауаптарын ұсынады 5.Топ атынан баяндамашы қорғайды. 6.Топ жұмысын «екі жұлдыз, бір ұсыныс» арқылы бағалайды Оқушылар жеке жұмыс жасайды. Жасалған жұмысты топта талқылайды. Жақсы деп танылған жұмыс топ атынан оқылады. Оқушылар шапалақ ұру арқылы бағалайды. Сабақ рефлексиясын жазады Сыныбы 8 17 сабақ Күні: Сабақтың тақырыбы: Қайталау Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Тақырыптар бойынша алған білімдерін жүйелеу, алған білімдерін өз бетінше пайдалана білуге дағдыландыру Күтілетін нәтиже Тарау бойынша алған білімдерін жинақтайды Негізгі идеялар Химиялық формула құру, реакция теңдеулерін теңестіру, сан есептерін шығару Құрал-жабдықтар: Интерактивті тақта, Д.И. Менделеевтің периодтық жүйесі Сабақтың түрі Қайталау Әдіс-тәсілдер Жеке, топтық жұмыстарға жас ерекшеліктеріне сай тапсырмалар Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті І.Ұйымдастыру кезеңі -Оқушылармен амандасу -Сыныпта жағымды ахуал туғызу -санау арқылы 3 топқа бөліп отырғызу -Сабаққа дейінгі көңіл күйім (смайлик арқылы бақылау) - сабақтың мақсатын айту №1 тапсырма оқушыларға сұрақтар қою І топ 1 Физикалық денелерді құрайтын нәрсе (зат) 2 Құрамына кіретін заттардың бөлшектері микроскоп арқылы көрінбейтін қоспа қалай аталады ? ( біртекті ) 3 Шынының балқуы қай құбылысқа жатады ( физикалық) 4 «Бөлінбейтін » ең кішкентай бөлшектер ( Атомдар ) 5 Атомдардың әр түрінен түзілген заттар ( күрделі заттар ІІ -топ 6 Оттегінің салыстырмалы атомдық массасы (16) 7 Мыстың латынша аты ( купрум) 8 Плюмбум – ( қорғасын ) 9 О — әріпімен белгіленетін элемент ( оттегі ) 10 Таңбалар және формулалар арқылы шартты түрде жазылатын реакциялар ( химиялық тендеулер) ІІ І топ 1 Заттардың агрегаттық күйлері ( сұйық , газ ,қатты) 2 Темірдің тот басуы қандай құбылысқа жатады ( химиялық ) 3 Атом –молекулалық ілімді жасаған орыс ғалымы ( Ломоносов) 4 Эн таңбасы ( азот ) 5 Кремнийдің латынша аты ( Силициум ) №2 тапсырма Жұптық жұмыс Эксперименттік бөлім. (физикалық және химиялық құбылысқа байланысты, химиялық реакциялардың белгісіне байланысты тапсырмалар беріледі) №3 тапсырма І топ 5 г. мыс (ІІ) оксиді түзілген болса, мыспен реакцияласқан. оттегінің массасын есептеңдер. ІІ топ Зат мөлшері 0,2 моль алюминий оксидінің (АL2 O3) массасын есепте. ІІІ топ 480г магний толық жанғанда түзілген магний оксидінің массасы 800 Қорытынды бөлім Оқушылардан « ACTIV ote» құрылғысы арқылы қысқа тест алынады. 1.Азот қышқылының мольдік массасы A) 63 моль. B) 63 г. C) 63. D) 63 г/моль. E) 63 моль/г. 2. Химиялық таңбасы О ... A) бір молекуланы көрсетеді. B) жай заттың бір молін көрсетеді. C) салыстырмалы молекулалық массаны көрсетеді. 3.Cu + HgCl2 ® CuCl2 + Hg теңдеуімен өрнектелген реакция типі A) орын басу B) қосылу C) айрылу D) бейтараптану E) алмасу 4.Айырылу реакциясы A) K2O + SO3® K2SO4 B) AgNO3 + NaCl ® AgCl¯ + NaNO3 C) ZnSO3 + 2HCl ® ZnCl2 + H2O +SO2 D) CuCl2 + Fe ® Cu + Fe Cl2 E) MgCO3 MgO + CO2 5. Массасы 128 г күкірттің зат мөлшері: а)3 моль. B) 1,5 моль.C) 4 моль.D) 2 моль.E) 5 моль. Сабақ рефлексиясы Үйге тапсырма беру: Бақылау жұмысына дайындық Оқушылардың іс-әрекеті Оқушылар бір-біріне бүгінгі сабаққа сәттілік тілейді, сабаққа дейінгі көңіл күйін смайликтерді көтеру арқылы білдіреді. Оқушылар қойылған сұрақтарға жеке жауап береді. Дұрыс жауапқа 1 ұпай беріледі Жұптық жұмыс жасау арқылы тапсырманы орындап шығады Рөлдік ойын (топ жетекшісі, баяндамашы, уақыт сақшысы, хатшы, бақылаушы) Топ атынан баяндамашы қорғайды Критерий арқылы бағалау Оқушылар жеке жұмыс жасайды. Өз жұмысын дайын жауаптар арқылы тексереді. Сабаққа кейінгі көңіл күйім (смайлик арқылы бақылау) Сыныбы 8 16 сабақ Күні: Сабақтың тақырыбы: №1 Бақылау жұмысы Сілтеме Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. Жалпы мақсаты Өтілген сабақта алған теориялық және практикалық білімді қайталап бекітіп, еске түсіріп, қорытындылай алады Күтілетін нәтиже Өтілген сабақта алған теориялық және практикалық білімді қайталап бекітіп, еске түсіріп, қорытындылайды Негізгі идеялар Өтілген тақырыпты жинақтау Құрал-жабдықтар: Интерактвті тақта, таратпа қағаздар, Д.И.Менделеевтің периодтық жүйесі Сабақтың түрі Бақылау жұмысы Әдіс-тәсілдер Жеке жұмыс Сабақ бойынша мұғалім жазбалары Мұғалімнің іс-әрекеті а)Оқушылармен амандасып,сыныптағы оқушыларды түгелдеу І, ІІ нұсқада тапсырмаларды беру. Үйге тапсырма беру:Қайталау Оқушылардың іс-әрекеті а)Берілген тапсырмаларды жеке орындау
|
|
|
|
|
|
|
|
|
|
|
|
І нұсқа
1.Төмендегі қосылыстардың формулаларындағы элементтер таңбаларының үстіне валенттілігін көрсетіңдер.
Na2S, SiH4, AlCl3, N2O5
2. Мыс (І) оксиді құрамындағы элементтердің массалық үлесін есептеңдер
3.Массасы 36 грамға тең судың зат мөлшерін табыңдар.
4.Сызбанұсқа бойынша коэффиценттерді қойып теңестіріңдер
Fe2O3+Al→ Al2O3+Fe
LiNO3→LiNO2+O2
5.Химиялық реакция теңдеуі бойынша 12 г маний тұз қышқылымен әрекеттескенде түзілген сутектің массасы
ІІ нұсқа
1.Төмендегі қосылыстардың формулаларындағы элементтер таңбаларының үстіне валенттілігін көрсетіңдер.
BaO, NH3, Al2O3, K2O
2.Алюминий оксиді құрамындағы элементтердің массалық үлестерін есептеңдер.
3.Зат мөлшері 2 мольге тең амммиактың массасы есептеңдер
4. Сызбанұсқа бойынша коэффиценттерді қойып теңестіріңдер
Cu+O2→CuO, Cu(NO3)2→CuO+NO2+O2
5.Химиялық реак. Теңдеуі бойынша 27 г су айырылғанда түзілген оттектің массасын есептеңдер
Оқушылардың бақылау жұмыстарын бағалауы

-орындай аламын

-сенімді емеспін

-орындай алмаймын
| Сыныбы | 8 | сабақ | Күні: |
| Сабақтың тақырыбы: | Химиялық элементтің ХЭПЖ орны бойынша сипаттамасы
| ||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы ,Н. Нұрахметов,К.Сарманова, К.Жексембина. 8 сынып оқулығы, Алматы «Мектеп» 2012 жыл. | ||
| Жалпы мақсаты | Химиялық элементті ХЭПЖ бойынша сипаттама беру | ||
| Күтілетін нәтиже | Химиялық элементті ХЭПЖ бойынша сипаттама береді
| ||
| Негізгі идеялар | Реттік номері, период, топ, металл, бейметалл, оксид негіздік, қышқылдық, негіз, қышқыл | ||
| Құрал-жабдықтар: | Интерактивті тақта, 8 сынып электронды оқулық.
| ||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | ||
| Әдіс-тәсілдер | «Химиялық диктант» , жас ерекшеліктеріне байланысты сұрақтар мен тапсырмалар
| ||
| Сабақ бойынша мұғалім жазбалары | Мұғалімнің іс-әрекеті а)Оқушылармен амандасып,сыныптағы оқушыларды 3 топқа бөлу. ә)Сынып құрамын түгелдеп, тақтаға күн ретін жазады. Кіріспе бөлім а)Оқушылардан «химиялық диктантты» орындауға нұсқау беріледі. Негізгі бөлім а)Тақтаға жаңа сабақтың тақырыбы жазылады. ә)Тақырып бойынша берілген термин сөздермен жұмыс жасалады. б)Оқушылар жеке дара мәтінмен танысып шығу тапсырылады. в)Әр топқа мәтін бөлініп беріледі. (Көрсетілім№1 (1.1)) І-топ: 12,14 ІІ-топ:11,17 ІІІ-топ: 4,3 элементтерді сипаттау г)Эксперименттік бөлім Топтарға Қоспаларды бөлу әдістеріне тәжірибе көрсету.
Қорытынды бөлім Өтілген тақырып бойынша оқушылар жұптық жұмыс жасайды. Сабақ рефлексиясын жасайды. Сабақтан кейінгі көңіл күйім. Кейінгі тапсырма: Тақырып бойынша тест тапсырмаларын құрастыру (5 тест) Үйге тапсырма беру:
| Оқушылардың іс-әрекеті
а)Оқушылар 3 топқа бөлініп отырады.
ә)Тақтадан күн ретін көшіріп алады.
Оқушылар берілген тапсырманы жеке орындап шығады. Орындалған жұмысты дайын жауап арқылы тексеріп, өзін-өзі бағалайды. Толық орындаған оқушы жұмысын шапалақ ұру арқылы мадақтау.
ә)Оқушылар көрсетілген элементтерге қарап өз ойларын айтады. .
Оқушылар тақырыппен танысып шығады. Тақырып мазмұнын топтық талқылауға салады.
Топ атынан баяндамашы қорғайды, топ жұмысын екі жұлдыз, бір ұсыныс арқылы бағалайды.
Көрсетілген тәжірибе бойынша оқушылар өз ойларын білдіреді.
Оқушылар жұптық жұмысты орындап, бүгінгі сабақтан не түсінгеніне анализ жасайды.
Жұптық жұмысты бір-біріне ауыстыра отырып бағалайды.
| |
| Сыныбы | 8 | 40 сабақ | Күні: | |||||
| Сабақтың тақырыбы: | Сутек – химиялық элемент және жай зат. Сутектің изотоптары. | |||||||
| Сілтеме | Білім стандарты, пән бағдарламасы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||||||
| Жалпы мақсаты | Сутек атомының, сутек молекуласының, жай зат ретінде сутектің құрамын, құрылысын, қасиеттерін сипаттайды. Сандық сипаттамаларын анықтайды. Табиғаттағы кездесуін талдай отырып, изотоптарының құрылысын біледі. | |||||||
| Күтілетін нәтиже | Сутектің құрылысына, сандық сипаттамаларына толық талдау жасай біледі. | |||||||
| Негізгі идеялар | Сутек – жеңіл, жанатын, иіссіз, түссіз, табиғатта кең таралған, белсенді газ. | |||||||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||||||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||||||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар, «Аялдама» әдісі | |||||||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Сергіту сәті. Оқушыларды топқа бөліп отырғызу. ІІ. Негізгі кезең .Жаңа сабақ : Синтетикалық каучук (көксағыз) 1. Тірек сөздер тақтада ілініп тұрады: Сутектің периодтық жүйедегі орны, табиғатта таралуы. Жай зат, күрделі зат, химиялық элемент, изотоп. Осы сөздерді ІҮ топқа бөлеміз. 2. «Аялдама » әдісі . І топқа Сутектің периодтық жүйедегі орны.; ІІ топқа Сутектің табиғатта таралуы; ІІІ топқа жай зат, күрделі зат, химиялық элемент; ІҮ топқа изотоп беріледі. Тірек білім мен біліктер. Сутек, оның физикалық қасиеті, химиялық реакция. Тотықсыздандырғыш. Виртуалды тәжірибе: а/ сутегінің оттегінде жануы; ә/ Сутегінің тазарғанын тексеру; б/ Сутегінің ауада және оттегінде жануы; Судың түзілуі. Жасалған тәжірибелерден шығатын қортынды: Сутегі –жанғыш зат оттегімен қосып жандырғанда қопарылыс береді. Топтарға мынадай сұрақтар беріледі: Сутегі күрделі заттың құрамында оттегімен әрекеттеседі ме ? Құрамында оттегі бар қандай күрделі заттарды білесіндер?
Кестенің оң жағын кітаппен өздігіннен жұмыс істеу арқылы оқушылар өздері толтырылады. Мұғалім жазған жуаптарын тексереді. Үйге тапсырма. §31. 3,4,6 –жаттығулар. Темір /ІІ/, алюминий АІ, литий /Lі/ металдармен тұз қышқылын арасындағы реакция теңдеулерін жазындар.
| Оқушы іс-әрекеті Топқа бөлінеді «Аялдама» әдісі бойынша оқушылар әр топтың тапсырмасына барып тапсырманы топта талдап өз ойларын постерге түсіріп кетеді. Соныңда әр топ өз жұмыстарын қорғайды. Жұмыстары бағаланады. Оқушылар зерттеу жұмыстарын интернет желісінен, оқулықтардан іздейді. | ||||||
| Сыныбы | 8 | 41 сабақ | Күні: | |
| Сабақтың тақырыбы: | Сутектің қасиеттері, қолданылуы және алынуы. | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Сутектің әр түрлі заттармен реакцияласу жағдайларын көреді. Сутектің физикалық және химиялық қасиеттеріне сүйене отырып, қолданылу салаларын талдайды. | |||
| Күтілетін нәтиже | Сутектің химиялық қасиеттеріне сүйене отырып реакция теңдеулерін жазуға қалыптасады. Теңдеуді теңестіруге жаттығады. | |||
| Негізгі идеялар | Сутек – белсенді газ, сондықтан әр түрлі жай және күрделі заттармен реакцияға түседі. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар. «Галлереяға саяхат» әдісі | |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Сергіту сәті. Оқушыларды топқа бөліп отырғызу. ІІ Үй тапсырмасын сұрау «Лездеме сұрақтар» Қай топ сұрақтарға көбірек жауап береді? 1.Сутектің таңбасы қандай? 2. Сутекті ашқан кім? 3. Сутекті не себепті жеңіл газ дейміз? 4. Периодтық жүйеде нешінші топта орналасқан? 5. Жай зат ретінде сутекті сипатта. 6. Химиялық элемент ретінде сутекті сипатта. 7. Сутектің агрегаттық күйі қандай? 8. Сутектің қолданылу салаларын талда. 9. Сутектің табиғатта таралуына сипаттама бер. ІІ. Кіріспе кезеңі . Виртуалды зертхана. Сутектің химиялық қасиеттері. Сутектің қолданылу салалары. ІІІ кезең Негізгі кезең .Жаңа сабақ : Жоғары молекулалы қосылыстар 1- тапсырма «Галлереяға саяхат» әдісі І топқа: Сутектің физикалық қасиеттеріне сипаттам бер. ІІ топқа: Сутектің химиялық қасиеттеріне сипаттама бер. ІІІ топқа : Сутектің алыну жағдайларын талда. 2- тапсырма .Топпен жұмыс: І топқа: Сутектің жай заттармен реакцияларын талдаңдар. ІІ топқа: Сутектің күрделі заттармен реакцияларын талдаңдар. ІІІ топқа: Сутекті алу жолдарын талдаңдар. ІҮ кезең Қорытынды 1. Есеп. Бір ыдысқа 22,4 мл, екіншісіне 44,8 мл сутек жиналды. Ыдыстардағы сутектің массасын және мөлшерін есептеңдер. 2. Мөлшері 0,05 моль және 30 моль болатын сутектің массасын және көлемін (қ.ж.) есептеңдер. 3. Реакцияға 44,8 л сутек қатысқан болса, неше грамм су түзіледі?
Ү йге тапсырма: қосымша есептер. Бағалау Жұптық бағалау. Критериалды бағалау Рефлексия
| Оқушы іс-әрекеті Топқа бөлінеді 1) Ассоциация әдісі арқылы оқушылар сутек туралы білімдерін жүйелейді. 2) Оқушылар алдымен топта талдайды, Бір оқушы постерде қорғайды. Ұпай жинау арқылы оқушылар бағаланады. 3) Оқушылар реакция теңдеулерін жазып , сутектің химиялық қасиеттеріне анықтама береді. 4) Оқушылар есепті шығарады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 42 сабақ | Күні: | |
| Сабақтың тақырыбы: | Химиялық элементтердің тотығу дәрежелері. Формулалары бойынша қосылыстардағы химиялық элементтердің тотығу дәрежелерін анықтау. Сутектің бинарлы қосылыстары. | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Жай зат пен күрделі зат құрамында элементтің тотығу дәрежелерінің анықтайды. Теңдеулер жүйесі арқылы тотығу дәрежесін табуды үйренеді. | |||
| Күтілетін нәтиже | Бинарлы қосылыстардағы элементтердің тотығу дәрежелерін табуды үйренеді. | |||
| Негізгі идеялар | Тотығу, тотықсыздану процестері. Тотығу дәрежесі мәні бір элемент атомының екінші элемент атомына ығысқан электрондар саны. Бинарлы қосылыс – екі элементтен тұратын күрделі заттар. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар«Интервью» әдісі
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Сергіту сәті. Оқушыларды топқа бөліп отырғызу. ІІ Үй тапсырмасын сұрау «Интервью» әдісі Мұғалім сабақ барысында «нтервьюге» шығаратын оқушылардың орындықтарына стикер жабыстырып кетеді.Әрбір дұрыс жауап берген оқушыға фишка сыйға тару етіп отыруға болады. Сонында фишканың санына қарай оқушыларды бағалайды. Шыққан оқушы жауап бере алмаған жағдайда сыныптан көмек сұрайды. Сұрақтар: 1. Сутекті жинаудың неше әдісі бар? 2. Сутектің физикалық қасиетеріне талдау жаса. 3. Сутекті алу жолдарын ата, реакция теңдеулерін жаз. 4. Сутектің жай заттармен әрекеттесуіне мысалдар келтір. 5. Сутектің күрделі заттармен әрекеттесуіне мысалдар келтір. 6. Сутекті қандай жағдайларда қолданамыз? 7. Сутекті бір ыдыстан екінші ыдысқа қалай құюға болады?
ІІ. Кіріспе. Химиялық элементтер туралы ертегі. Ертегі сутектің физикалық қасиеттерін сипаттайды. ІІІ кезең Негізгі кезең .Жаңа сабақ : Химиялық элементтердің тотығу дәрежелері. Формулалары бойынша қосылыстардағы химиялық элементтердің тотығу дәрежелерін анықтау. Сутектің бинарлы қосылыстары. Оқушылар топқа бөлінеді. Әр опқа мынадай жазудағы таратпа материал беріледі. Сутекті оттекпен әрекеттесу теңдеуін мысалға алып, теңестіру керек. Есіңде сақта! Оттек жай зат ретінде қатысатын барлық реакция теңдеулерінде, бірінші кезекте сол және оң жақтағы оттек атомдарының саны, содан кейін ғана басқа элементтер саны теңестіріледі. Жай заттарда тотығу дәрежесі әрқашан 0 – ге тең. Тотықтырғыш – электрон алатын элемент; Тотықсыздандырғыш – электрон беретін элемент. Тотықтырғыш тотықсызданады, тотықсыздандырғыш тотығады. Бұдан соң бейнеролик арқылы арқылы Әуелі бинарлы қосылыстардағы AI2+3O3-2 тотығу дәрежесін анықтауды одан соң күрделі заттағы H2+1C+4O3-2 элементтің тотығу дәрежелерін анықтауға жаттығу жасайды. Оқушыларға мына заттардың формулаларындағы элементтердің тотығу дәрежесін анықтайды:H2SO4, MnCI2, MgSO4,SiO2, CuO,HMnO4,K2Cr2O7. Жаттығулар орындау. 1. Мына қосылыстардағы хлордың:HCI,CI2,HCIO, HCIO2, HCIO4 тотығу дәрежелерін анықтаңдар. 2. Мына қосылыстардағы фосфордың:PH3,HPO3,H3PO4,H3PO3 тотығу дәрежелерін анықтаңдар. 3. Мына қосылыстардағы күкірттің: H2S,ZnS,SO2, H2SO3, H2SO4 тотығу дәрежелерін анықтаңдар. Екінші сабақ алдына мынадай сұрақтар қойылады: 1. Қандай жағдайда химиялық элементтер оң, теріс, нөл тотығу дәрежесін көрсетеді? 2. H2,HCI,H2O,F2,PCI5 қосылысындағы элементтердің тотығу дәрежесін анықтаңдар. 3. Иондық,атомдық және молекулалық кристалл торлы заттардың физикалық қасиеттері қандай? Оксидтер тақырыбындағы тотығу деген сөздің мағнасын еске түсіру. Реакциялардың бәрі ТТР-на жатпайды, тек теңдеуде тотығу дәрежелері өзгеретін элемент атомдары болса, ондай теңдеулер ТТР – на жатады. Енді оны заттың құрылысы тұрғысынан қарастыру қажет. Магнийдің күкіртпен әрекеттесуін қарастырамыз: Mg0 + S0 = Mg+2S-2 ЭБТ құру арқылы теңдеуді теңестіру: Mg0 – 2е = Mg+2 тотығады S0 + 2е = S-2 тотықсызданады Mg-тотықсыздандырғыш, S –тотықтырғыш, Магний сульфидіндегі +2,-2 тотығу дәрежесінің мәні айтылады. Солдан оңға қарай ТД өсетін болса,элемент атомдары тотықсыздандырғыш (ТСШ) қасиет көрсетеді: -4, -3, -2, -1 ,0, +1, +2, +3, +4, +5,+6 Оңнан солға қарай ТД кемитін болса, элемент атомдары тотықтырғыш (ТТШ) қасиет көрсетеді: Оқушыларға тотықтырғыш,тотықсыздандырғыш ұғымдарының анықтама сын,тотығу-тотықсыздану реакциясының мәнін түсіндіру. Тотығу-тотықсыздану реакциясының теңдеуін құру алгоритмі берілген кесте ілініп, оқушылар жаттығу жұмысын орындайды. Алгоритмі: 1. Химиялық теңдеуді құру. 2. Теңдеудің оң және сол бөлігіндегі барлық элементтердің тотығу дәрежесін анықтап, оны жазу. 3. Тотығу дәрежесі өзгерген элементті табу. 4. Электрондық баланс теңдеуін құру. 5. Химиялық теңдеуге коэффициенттерін қою. 6. Теңдеудің оң және сол бөлігіндегі оттегінің саны бойынша коэффициенттің дұрыс қойылғандығын тексеру. 7. Тотықтырғышты, тотықсыздандырғышты, тотығу – тотықсыздандыру процесін анықтау. Сабақты пысықтау мақсатында жаттығулар орындау. 1. Тотығу – тотықсыздану реакцияларының теңдеулерін құру: AI + S = H2S + O2 = PbO + H2 = AI + Br2 = 2. ТТР теңдеулерінің коэффициенттерін қойыңдар.H2S + CI2 = HCI + S ; HNO3 + Cu = Cu(NO3)2 + NO2 + H2O; Үйге тапсырма беру: §64. 5-6-7 жаттығуларын орындау. Бағалау Топтық бағалау Рефлексия
| Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 43 сабақ | Күні: | |
| Сабақтың тақырыбы: | Тотықтырғыш пен тотықсыздандырғыш туралы түсінік. Тотығу – тотықсыздану реакциялары. | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Сутектің химиялық қасиеттеріне сүйене отырып реакция теңдеулерін жазу арқылы тотығу дәрежелерінің өзгеруін анықтайды. Тотықтырғыш пен тотқсыздандырғышты ажыратады. Электрондарды беру және алу механизмдерін есте сақтайды. | |||
| Күтілетін нәтиже | Электрондық баланс тәсілімен танысады. Оны қарапайым теңдеулерге пайдалана бастайды. Нәтижесінде тотығу – тотықсыздану реакцияларын таниды. | |||
| Негізгі идеялар | Тотығу, тотықсыздану процестері. Тотығу дәрежесі мәні бір элемент атомының екінші элемент атомына ығысқан электрондар саны. Бинарлы қосылыс – екі элементтен тұратын күрделі заттар. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар«Интервью» әдісі
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Сергіту сәті. Оқушыларды топқа бөліп отырғызу. Химиялық элементтердің тотығу дәрежелері. Формулалары бойынша қосылыстардағы химиялық элементтердің тотығу дәрежелерін анықтау. Сутектің бинарлы қосылыстары. Оқушылар топқа бөлінеді. Әр опқа мынадай жазудағы таратпа материал беріледі. Сутекті оттекпен әрекеттесу теңдеуін мысалға алып, теңестіру керек. Есіңде сақта! Оттек жай зат ретінде қатысатын барлық реакция теңдеулерінде, бірінші кезекте сол және оң жақтағы оттек атомдарының саны, содан кейін ғана басқа элементтер саны теңестіріледі. Жай заттарда тотығу дәрежесі әрқашан 0 – ге тең. Тотықтырғыш – электрон алатын элемент; Тотықсыздандырғыш – электрон беретін элемент. Тотықтырғыш тотықсызданады, тотықсыздандырғыш тотығады. Бұдан соң бейнеролик арқылы арқылы Әуелі бинарлы қосылыстардағы AI2+3O3-2 тотығу дәрежесін анықтауды одан соң күрделі заттағы H2+1C+4O3-2 элементтің тотығу дәрежелерін анықтауға жаттығу жасайды. Оқушыларға мына заттардың формулаларындағы элементтердің тотығу дәрежесін анықтайды:H2SO4, MnCI2, MgSO4,SiO2, CuO,HMnO4,K2Cr2O7. Жаттығулар орындау. 1. Мына қосылыстардағы хлордың:HCI,CI2,HCIO, HCIO2, HCIO4 тотығу дәрежелерін анықтаңдар. 2. Мына қосылыстардағы фосфордың:PH3,HPO3,H3PO4,H3PO3 тотығу дәрежелерін анықтаңдар. 3. Мына қосылыстардағы күкірттің: H2S,ZnS,SO2, H2SO3, H2SO4 тотығу дәрежелерін анықтаңдар. Екінші сабақ алдына мынадай сұрақтар қойылады: 4. Қандай жағдайда химиялық элементтер оң, теріс, нөл тотығу дәрежесін көрсетеді? 5. H2,HCI,H2O,F2,PCI5 қосылысындағы элементтердің тотығу дәрежесін анықтаңдар. 6. Иондық,атомдық және молекулалық кристалл торлы заттардың физикалық қасиеттері қандай? Оксидтер тақырыбындағы тотығу деген сөздің мағнасын еске түсіру. Реакциялардың бәрі ТТР-на жатпайды, тек теңдеуде тотығу дәрежелері өзгеретін элемент атомдары болса, ондай теңдеулер ТТР – на жатады. Енді оны заттың құрылысы тұрғысынан қарастыру қажет. Магнийдің күкіртпен әрекеттесуін қарастырамыз: Mg0 + S0 = Mg+2S-2 ЭБТ құру арқылы теңдеуді теңестіру: Mg0 – 2е = Mg+2 тотығады S0 + 2е = S-2 тотықсызданады Mg-тотықсыздандырғыш, S –тотықтырғыш, Магний сульфидіндегі +2,-2 тотығу дәрежесінің мәні айтылады. Солдан оңға қарай ТД өсетін болса,элемент атомдары тотықсыздандырғыш (ТСШ) қасиет көрсетеді: -4, -3, -2, -1 ,0, +1, +2, +3, +4, +5,+6 Оңнан солға қарай ТД кемитін болса, элемент атомдары тотықтырғыш (ТТШ) қасиет көрсетеді: Оқушыларға тотықтырғыш,тотықсыздандырғыш ұғымдарының анықтама сын,тотығу-тотықсыздану реакциясының мәнін түсіндіру. Тотығу-тотықсыздану реакциясының теңдеуін құру алгоритмі берілген кесте ілініп, оқушылар жаттығу жұмысын орындайды. Алгоритмі: 8. Химиялық теңдеуді құру. 9. Теңдеудің оң және сол бөлігіндегі барлық элементтердің тотығу дәрежесін анықтап, оны жазу. 10. Тотығу дәрежесі өзгерген элементті табу. 11. Электрондық баланс теңдеуін құру. 12. Химиялық теңдеуге коэффициенттерін қою. 13. Теңдеудің оң және сол бөлігіндегі оттегінің саны бойынша коэффициенттің дұрыс қойылғандығын тексеру. 14. Тотықтырғышты, тотықсыздандырғышты, тотығу – тотықсыздандыру процесін анықтау. Сабақты пысықтау мақсатында жаттығулар орындау. 2. Тотығу – тотықсыздану реакцияларының теңдеулерін құру: AI + S = H2S + O2 = PbO + H2 = AI + Br2 = 2. ТТР теңдеулерінің коэффициенттерін қойыңдар.H2S + CI2 = HCI + S ; HNO3 + Cu = Cu(NO3)2 + NO2 + H2O; Үйге тапсырма беру: §64. 5-6-7 жаттығуларын орындау. Бағалау Топтық бағалау Рефлексия
| Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 44 сабақ | Күні: | |
| Сабақтың тақырыбы: | Сан есептерін шығару
| |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Сутек тарауына байланысты және тотығу – тотықсыздану реакцияларына байланысты сандық есептерге жаттығады.
| |||
| Күтілетін нәтиже | Математикалық біліктілік қалыптасады, химиялық формулалар мен теңдеулер бойынша есептеулер жүргізе алады | |||
| Негізгі идеялар |
| |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар«Интервью» әдісі
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Тірек білім мен біліктер. Сутегі, оксид, қышқыл, тұз окидтері. Олардың индикаторға әсері. Масса, мольдік массамен есептер шығару. Сабақты эксперименттік есептер шығару үшін тақтаға оқушылар шақырылады. 1. Үстелде бар реактивтерді пайдаланып, сутегін алыңдар. Сутегі жанғанда су түзілетінін дәлелде. Реакция теңдеуін жаз. 2. Ыдыста тұз қышқылы бар екенін бірнеше жолдармен анықта. Реакция теңдеуін жаз. 3. Қышқылдың химиялық қасиетін түсіндіретін реакциялар жаса, олардың маңызын түсіндір. Реакция теңдеуін жаз. 4. Темір /ІІ/ сульфатын алу реакциясын жүргіз және жеке бөліп ал. Оқушылармен әңгімелесу мына сұрақтар арқылы жүргізіледі 1.Бейорганикалық заттардың қандай кластарын оқып үйреңдіндер? Олардың қандай ұқсастығы және ерекшелігі бар. 2.Окидттерге, қышқылдарға тұздарға анықтама беріңдер. 3."Бейорганикалық қосылыстар" жинақтамасын пайдалана отырып, қосылыстардың аттарын ата, қай класқа жатқызасын, мысал келтр. 4. а/ оксидттерді; ә/ тұздарды алудың екі түрлі жолын реакция теңдеуімен көрсет. Қосымша дидактикалық материалдар бойынша сан есептерін шығару жұмыстары жүргізіледі. 1) 8г мыс(ІІ) оксидін алу үшін қанша грамм мыс реакцияға түседі? 2) Нәтижесінде 4 моль сутек алу үшін қанша грам суды айыруға болады? 3) Массасы 6,5г цинк оттекпен әрекеттессе цинк оксидінің қанша зат мөлшерін алуға болады? 4) 1 моль алюминий күкіртпен реакцияға түсу үшін қанша күкірт қажет және түзілген алюминий сульфидінің массасын есептеңдер? 5) Оттегінде 54г алюминий жанған кезде, алынған алюминий оксидінің массасы қандай? 6) Массасы 360г алюминий сульфидін алу үшін, оған жұмсалған алюминий мен күкірттің массасын есептеп шығар. 7) 8г мыс(ІІ) оксидінен мысты жеке бөліп алу үшін, қанша грамм сутегі жұмсалады? 8) 8г сутегі жанғанда түзілетін судың массасы және зат мөлшері қанша? 9) Реакцияға 16г оттегі түскенде судың қандай зат мөлшері шығады? 10) Реакциядан 9г су түзіледі. Реакцияға түскен сутектің массасын және зат мөлшерін табыңдар. Сабақты қорытындылау ретінде оқушыларға өзіндік жұмыс тапсырамыз. Сызбанұсқа бойынша реакция теңдеулерін жаз.
Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және жұптасып орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 45 сабақ | Күні: | |
| Сабақтың тақырыбы: | №4 бақылау жұмысы.
| |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Тарау бойынша алған білімдерін қолдана біледі. | |||
| Күтілетін нәтиже | Математикалық біліктілік қалыптасады, химиялық формулалар мен теңдеулер бойынша есептеулер жүргізе алады | |||
| Негізгі идеялар |
| |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі 1. Берілген теңдеуден орынбасу реакциясын көрсетіңдер: А) 2H2 + O2 = 2H2O B) 2N + 2H2O =2NaOH + H2 C) 2H2O =2H2 + O2 D) C + O2 = CO2 2. Күкірт (ІҮ) оксидінде оттектің индексі қанша? А) 1 В) 2 С) 3 Д) 4 3. Массасы 4г мыс (ІІ) оксидін тотықсыздандыру үшін неше моль сутек қажет болады: А) 1 моль В) 0,1 моль С) 0,05 моль Д) 2 моль 4. Тұз қышқылымен әрекеттеспейтін металл қайсысы: А) мырыш В) магний С) темір Д) мыс 5. Қышқылдың формуласын көрсетіңдер: А) Ca3(PO4)2 B) H2SO4 C) CaO D) KNO3 6. Қай заттар орынбасу реакциясына түскенде магний сульфаты мен сутек газы түзіледі? А) магний оксиді мен күкірт қышқылы В) магний мен су С) магний мен күкірт қышқылы Д) магний мен оттек 7. Натрий фосфатындағы натрийдің индексі қанша? А) 1 В) 2 С) 3 Д) 4
Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және жұптасып орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 46 сабақ | Күні: | |
| Сабақтың тақырыбы: | Табиғаттағы су. Судың құрамы, қасиеттері және қолданылуы. №6 зертханалық тәжірибе.
| |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Судың табиғатта таралуы жөнінен талдау жасайды. Судың сапалық және сандық құрамымен танысады. Судың физикалық және химиялық қасиеттерімен танысып, қолданылу салаларына ассоциациялық карта құрастырады. | |||
| Күтілетін нәтиже | Судың сандық және сапалық құрамын біледі. Физикалық және химиялық қасиеттерімен біліп, өмірде қолдана біледі. | |||
| Негізгі идеялар | Су – тіршіліктің көзі. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Тірек білім мен біліктер. Заттардың агрегаттық күйлері, қоспаларды ажырата және бөле білу біліктері, заттың құрлысы мен құрылымы, суда заттардың еруі. Оқушылардың географиядан, табиғаттанудан алған білімдеріне сүйене отырып, бұл сабақты әңгімелесумен бастаған жөн. Әңгіме төмендегі сұрақтар төңірегінде болады. 1.Судың қандай агрегаттық күйлерін білесіңдер? 2.Табиғаттағы судың таралуына, оның тіршіліктегі маңызына мысалдар келтір. 3.Табиғи суда қандай қоспалар болуы мүмкін? Себебін түсіндір. 4.Суды қандай мақсатта тазарту қажет деп ойлайсыңдар? Бұл сұрақты талдағанда оқушылар таза судың кеңінен қолданатындығын, оның адам өмірінде, тұрмыста, өнеркәсіпте орны ерекше екендігін қорытындылайды.
Бұл сабақта ерекше көңіл аударатын мәселе судың еріткіш екендігіне мысалдар арқылы көз жеткізу. Оқушылар судың түрлі заттарды ерітетінін табиғаттану курсынан білетіндігін ескере отырып, негізгі жұмыс "ерітінді" ұғымының мәнін ашуға бағытталады. Ол үшін төмендегі сөйлемдер қандай мағына ұқтыратыны талданады. 1. Тұз, қант және басқа заттар суда ериді. 2. Су көп заттарды ерітеді. 3. Суда заттардың еру құбылысы жүреді. 4. Су –жақсы еріткіш. 5. Ерітінді тұнбай, біркелкі болып тұрады. Мұнда еріткіш ретінде судың қандай рөл атқаратындығы, заттардың еруі қалай жүретіндігі түсіндіріледі. Сонан соң тотиянның суда еруін көрсету қажет. Тәжірибені жүргізу барысында еруді жылдамдататын жағдай ескеріліп, оқушылар заттың еруі; а) ерітіндіні араластырғанда: ә) қыздырғанда; б) зат пен еріткіш бетінің жанасуын арттырғанда; в) еритін заттың тығыздығы еріткіштің тығыздығынан артық болғанда тез жүретіндігін қорытындылайды. Оқушылардың табиғаттану курсынан заттардың шексіз ерімейтіндігін білетінін ескере отырып, қанықпаған және қанық ерітіндіге анықтама бергеннен кейін заттың ерігіштігі туралы ұғымды түсіндіру қажет. Ол үшін " заттардың ерігіштігі ерітінді қанық болуы үшін берілген температурада судың белгілі мөлшерінде заттың қандай массасы ери алатынын көрсетеді " –деген анықтамаға талдау жасалады. Мысалдар келтіре отырып , заттар суда еритін, аз еритін, ерімейтін болып бөлінетіндігін қорытындаланады. Өтілген материалдарды бекітуге арналған сұрақтар: 1. Суды тазартудың қандай әдістері бар? Олар қандай жағдайда қолданылатынына мысалдар келтр. 2. Тұрмыста қолданылатын заттардың судағы ерітіндісіне мысалдар келтір. 3. Алтын мен мұнай көзін іздеуге қарағанда табиғи су көзін табуға 4. ерекше күш пен еңбек жұмсалатын себебі неде? Дәлелді жауап беріндер. 5. Географиядан, биологиядан алған біліміне сүйене отырып, төмендегі ойлардың мәнін түсіндіріңдер: а) су –біздің ғаламшарымызда жер бедерін түзуші негізгі геологиялық фактор; ә) су -өнеркәсіп пен ауыл шаруашылығы дамуының негізі: б)өзендер, көлдер, мұхиттар азық –түліктің және минералды заттардың энергия мен жылу көздерінің, қатынас жолдарының, жер бетіндегі ауа райының, климаттың және егін шығымының анықтауышы; в) табиғатты аялау, оның байлықтарын қорғау міндеттерін өзің қалай орындайтының туралы хабар дайында. Үйге тапсырма беру: § 36-37. Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және топпен орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 47 сабақ | Күні: | |
| Сабақтың тақырыбы: | Сулы ерітінділер мен жүзгіндер. Қоспаларды бөлу жолдары. | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Сулы ерітінділердің табиғаттағы түрлерін, маңызын біледі. Сулы ерітінділердің қолдану салаларын талдайды. | |||
| Күтілетін нәтиже | Сулы ерітінділердің түзілу жодарын, маңызын, қолдану салаларын біледі. | |||
| Негізгі идеялар | Су – тіршіліктің көзі. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Тірек білім мен біліктер. Суды қолданылатын мақсатына сәйкес қосымшалардан тазартудың түрлі әдістері болатындығына тоқталып өткен жөн. Ол үшін оқушылардың тірек білімін естеріне түсіреміз. Қоспаларды бөлудің қандай әдістері бар? Фильтрлеу әдісі суды қандай қосымшаларынан тазартуға қолданылады? т.б. сұрақтар қоюға болады. Мұнан кейін оларды тазалаудың басқа әдістерімен де таныстырамыз. 1.Айдау әдісі. Бұл әдіс суды еріген заттардан бөлу үшін қолданылатындықтан айта келіп, зертханада қолданылатын құралдың құрлысымен таныстыру қажет. Көрнекі көрсету. 1. Ол үшін айдауға арналған құрал құрастырып, суды айдау процесі зертханада көрсетіледі. Зертханалық құралдардың жұмыс істеу принципін негізге ала отырып, өндірісте дистильденген су алуға арналған айдау кубына сипаттама беріледі. 2. Суды ерімейтінтығыздығы әр түрлі сұйық қосымшалардан бөлуге қолданылатын тағы бір зертханалық құрал бөлгіш варонкамен таныстыру. Ол үшін бөлгіш варонкаға су мен жанармай қоспасын құйып, олардың бөлу тәсілін көрсетуге болады. Айтылған әдістердің суды тазартуда кеңінен қолданылатынына тоқтала отырып, бірақ бұл әдістерді қолдану су ресурстарын пайдалану мәселелерін толық шеше алмайтындығына, қазіргі таңда елімізде оны қорғау және табиғи ресурстарды тиімді пайдалану туралы заң заң қабылданып отырғанына баса назар аударылады. Бұл сабақта тағы бір ерекше көңіл аударатын мәселе судың еріткіш екендігіне мысалдар арқылы көз жеткізу. Оқушылар судың түрлі заттарды ерітетінін табиғаттану курсынан білетіндігін ескере отырып, негізгі жұмыс "ерітінді" ұғымының мәнін ашуға бағытталады. Ол үшін төмендегі сөйлемдер қандай мағына ұқтыратыны талданады. 1. Тұз, қант және басқа заттар суда ериді. 2. Су көп заттарды ерітеді. 3. Суда заттардың еру құбылысы жүреді. 4. Су –жақсы еріткіш. 5. Ерітінді тұнбай, біркелкі болып тұрады. Мұнда еріткіш ретінде судың қандай рөл атқаратындығы, заттардың еруі қалай жүретіндігі түсіндіріледі. Сонан соң тотиянның суда еруін көрсету қажет. Тәжірибені жүргізу барысында еруді жылдамдататын жағдай ескеріліп, оқушылар заттың еруі; а) ерітіндіні араластырғанда: ә) қыздырғанда; б) зат пен еріткіш бетінің жанасуын арттырғанда; в) еритін заттың тығыздығы еріткіштің тығыздығынан артық болғанда тез жүретіндігін қорытындылайды. Оқушылардың табиғаттану курсынан заттардың шексіз ерімейтіндігін білетінін ескере отырып, қанықпаған және қанық ерітіндіге анықтама бергеннен кейін заттың ерігіштігі туралы ұғымды түсіндіру қажет. Ол үшін " заттардың ерігіштігі ерітінді қанық болуы үшін берілген температурада судың белгілі мөлшерінде заттың қандай массасы ери алатынын көрсетеді " –деген анықтамаға талдау жасалады. Мысалдар келтіре отырып , заттар суда еритін, аз еритін, ерімейтін болып бөлінетіндігін қорытындаланады. Өтілген материалдарды бекітуге арналған сұрақтар: 1. Суды тазартудың қандай әдістері бар? Олар қандай жағдайда қолданылатынына мысалдар келтр. 2. Тұрмыста қолданылатын заттардың судағы ерітіндісіне мысалдар келтір. 3. Алтын мен мұнай көзін іздеуге қарағанда табиғи су көзін табуға 4. ерекше күш пен еңбек жұмсалатын себебі неде? Дәлелді жауап беріндер. 5. Географиядан, биологиядан алған біліміне сүйене отырып, төмендегі ойлардың мәнін түсіндіріңдер: а) су –біздің ғаламшарымызда жер бедерін түзуші негізгі геологиялық фактор; ә) су -өнеркәсіп пен ауыл шаруашылығы дамуының негізі: б)өзендер, көлдер, мұхиттар азық –түліктің және минералды заттардың энергия мен жылу көздерінің, қатынас жолдарының, жер бетіндегі ауа райының, климаттың және егін шығымының анықтауышы; в) табиғатты аялау, оның байлықтарын қорғау міндеттерін өзің қалай орындайтының туралы хабар дайында. Үйге тапсырма беру: § 36-37. Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және топпен орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 48 сабақ | Күні: | |
| Сабақтың тақырыбы: | Суды лас қоспалардан тазарту. №3 сарамандық жұмыс. | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Сулы ерітінділерді қоспалардан тазалау жолдарымен танысады. | |||
| Күтілетін нәтиже | Сулы ерітінділерді тазарту жолдарын виртуалдық зертхана арқылы біледі. Өмірде қолдана біледі. | |||
| Негізгі идеялар | Су – тіршіліктің көзі. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Суды қолданылатын мақсатына сәйкес қосымшалардан тазартудың түрлі әдістері болатындығына тоқталып өткен жөн. Ол үшін оқушылардың тірек білімін естеріне түсіреміз. Қоспаларды бөлудің қандай әдістері бар? Фильтрлеу әдісі суды қандай қосымшаларынан тазартуға қолданылады? т.б. сұрақтар қоюға болады. Мұнан кейін оларды тазалаудың басқа әдістерімен де таныстырамыз. 1.Айдау әдісі. Бұл әдіс суды еріген заттардан бөлу үшін қолданылатындықтан айта келіп, зертханада қолданылатын құралдың құрлысымен таныстыру қажет. Көрнекі көрсету. 1. Ол үшін айдауға арналған құрал құрастырып, суды айдау процесі зертханада көрсетіледі. Зертханалық құралдардың жұмыс істеу принципін негізге ала отырып, өндірісте дистильденген су алуға арналған айдау кубына сипаттама беріледі. 2. Суды ерімейтінтығыздығы әр түрлі сұйық қосымшалардан бөлуге қолданылатын тағы бір зертханалық құрал бөлгіш варонкамен таныстыру. Ол үшін бөлгіш варонкаға су мен жанармай қоспасын құйып, олардың бөлу тәсілін көрсетуге болады. Айтылған әдістердің суды тазартуда кеңінен қолданылатынына тоқтала отырып, бірақ бұл әдістерді қолдану су ресурстарын пайдалану мәселелерін толық шеше алмайтындығына, қазіргі таңда елімізде оны қорғау және табиғи ресурстарды тиімді пайдалану туралы заң заң қабылданып отырғанына баса назар аударылады.
Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және топпен орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 49 сабақ | Күні: | |
| Сабақтың тақырыбы: | Ерітінділер концентрацияларының түрлері. Қатты, сұйық және газ тәрізді заттардың судағы ерігіштігі. Кристаллогидраттар. | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Қаныққан және қанықпаған, концентрациялы және сұйылтылған ерітінділерді ажыратады. Әр түрлі агрегаттық күйдегі заттардың суда еру механизмдерімен танысады. | |||
| Күтілетін нәтиже | Еріткіш пен еріген заттың арасындағы сандық қатынасты ажыратады. | |||
| Негізгі идеялар | Су – тіршіліктің көзі. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Тірек білім мен біліктер: Зат мөлшері, мольдік масса, элементтің күрделі заттағы массалық үлесін есептеу білігі. Физика курсынан еріген заттың массалық үлесі. Сабақ барысы: Үй тапсырмасын төмендегі сұрақтармен тексереміз. 1. Судың физикалық қасиеттерін сипатта. 1. Суды қолданылатын мақсатына қарай тазарту әдістерінің қандай түрлері бар? 2. Молекулалық теорияға сүйеніп, еру құбылысын қалай түсіндіруге болады? 3. Қаныққан және қанықпаған ерітінділер дегеніміз не? Қанықпаған ерітіндісінің анықтамасын еске түсіргеннен кейін, оқушылармен осы ерітіндінің сандық құрамын қалай анықтауға болатындығы қарастырылады. Ол үшін оқушыларға "күрделі заттағы элементтің массалық үлес қалай есептеледі?" –деген сұрақ беріліп, бір мысалды талдаған соң, бұл әдіс еріген заттың массасы жалпы массаның қандай бөлігін құрайтынын есептеуге қолданылатынын ескертіледі. Физика курсынан еріген зат массаның ерітіндінің жалпы массасына қатынасын еріген заттық массалық үлесі деп айтатыны оқушыларға белгілі болғандықтан, енді осы массалық үлесті өрнектеу әдістері қарастырылады. 1. Массалық үлес бірліктерімен: а) ω = m еріген зат m ерітінді немесе процентпен өрнектеледі: ә) ω%= m еріген зат . 100% m ерітінді Оқушылардың физика мен математика сабақтарынан алған есептеу біліктерін қолдана отырып, еріген заттың массалық үлесін есептеуге жаттығу жұмыстары жүргізіледі. Ол үшін, мысалы 25% -дық ерітінді туралы сөз болғанда, оқушылар 100г мұндай ерітіндіде 25г тұз бар екенін білуге қажет. Ол есептеу жүргізу барысында пропорция құруды жеңілдетеді. Бұл жерде процент дегеніміз – санның жүзге қатынасы екенін де ескерген жөн, яғни 25 % дегеніміз 25 , бұл жағдайда пропорцияның мәні өзгеріп, 100 мындай түрде өрнектеледі. 20 = 25 не 0,25=25% 80 100 Бұл пропорцияда оның кез келген мүшесі есеп шартына орай белгісіз болуы мүмкін:
1. х = 25 2. 20 = 25 3. 20 = х 80 100 х 100 80 100 Бірінші пропорцияға мынадай есеп сәйкес келед: 80г 25% -тік тұз ерітіндісі берілген. Еріген тұздың массасы қандай? Екінші пропорция: 20г тұзды ерітіп, 25% -тік ерітінді алу үшін, судың қандай массасын алу қажет? Үшінші пропорция: егер 80г ерітіндіде 20г тұз бар екені белгілі болса, еріген заттың массалық үлесі қандай? Осылайша мұғалім бір белгісіз бар теңдеуді шешу арқылы ерітінді дайындау үшін тұздың, судың қандай массасы қажет екенін, еріген заттың массалық үлесін табуға болатынын оқушыларға басқа пәндерден белгілі әдістермен түсіндіре алады. Сонымен қатар еріген заттың массалық үлесін анықтауға арналған формулалардан: m еріген зат = ω% (ер.зат) · m ерітінді 100% еріген заттың және судың массасын біле отырып, массалық үлесі белгілі ерітінді даярлауға болатындығын оқушылар өз бетінше қорыта алады. Ерітіндінің белгілі мөлшерінде еріген зат мөлшері тек пайыздық концентрациясымен ғана өрнектелмейтіндіктен және іс жүзінде өте жиі қолданылатындықтан бұл сабақта молярлық концентрация туралы ұғым қалыптастырылады. Молярлық концентрация 1000мл (1л) ерітіндіде еріген заттың қанша мөлшері болатындығын көрсетеді. Осыған орай оқушылар зат мөлшері деген шама не білдіретіндігін оның өлшем бірліктерін еске түсіреді. Егер, мысалы, 1000мл ерітіндіде 1моль зат еріген болса, онда мұндай ерітінді бір мольді (1М) деп аталады. Егер 100мл ерітіндіде 0,5 моль зат еріген болса, оның концентрациясын анықтау үшін 1000мл осындай ерітіндіде еріген заттың қанша молі бар екенін табу керек. 0,5 · 1000 = 5 моль, яғни ерітінді 5М. Көрсетілген концинтрация түрінің 100 өзіндік ерекшелігі бар екеніне көңіл аудару қажет. Мәселен, молярлық концентрациясы бірдей ерітінділердің бірдей көлемдегі зат мөлшері (моль) бірдей болады. Бірақ әр түрлі массаларының моль саны әр түрлі болғандықтан, еріген заттың массасы бірдей болмайды. Мысалы, 100г 10% -тік ас тұзы және қант ерітіндісінде көрсетілген заттар 10г болады. Сарамандық жұмыста – оқушыларды түрлі концентрациялы ерітінділер даярлауға дайындау мақсатында мынадай есептеулер жүргізуге жаттықтыру қажет. Есеп:0,4М 100мл глюкоза ерітіндісін даярлау қажет. Глюкозаның формуласы С6Н12О6 салыстырмалы малекулалық массасы 180. Молярлық концентрациясы анықтамасы бойынша 1000мл, 0,4М ерітіндіде 0,4 моль еріген зат болады, яғни 180г/моль · 0,4моль =72г Ал 100мл ерітіндіде, еріген зат бір литрдегіден 10 есе аз болатындықтан, мұндай ерітінді даярлау үшін 7,2г глюкоза өлшеп алу қажет болады. Мұндай есептеулер жүргізген соң, оқушыларға молярлық ерітіндіні даярлау барысында өлшеуіш колба мен өлшеуіш цилиндр қолдану ыңғайлы екені ескертіліп, онымен жұмыс істеу технологиясы көрсетіледі. Оқыған материялды бекіту үшін орындалатын жаттығу жұмыстары. 1. Оқулықтағы 2, 3, 4, 5 ,6–жаттығу. 2. 50мл ерітіндіде 0,1 моль еріген зат бар. Ерітіндінің молярлық концентра циясы қандай? 3. Қай ерітіндіде зат көп мөлшерде болады: 150г 10% -тік натрий хлоридінің ерітіндісіне ме, әлде осы тұздың 0,1 моль 1л ерітіндісіне ме? Үйге тапсырма беру: §38. Есептер жинағынан:3-25,3-26,3-28,3-30,3-31
Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және топпен орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||||
| Сыныбы | 8 | 50 сабақ | Күні: | |||
| Сабақтың тақырыбы: | Берілген массалық үлесі бойынша қант ерітіндісін дайындау.
| |||||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||||
| Жалпы мақсаты | Ерітіндінің проценттік концентрациясына байланысты сандық мәліметтерге жүгіне отырып, әр түрлі ерітінділер дайындайды.
| |||||
| Күтілетін нәтиже | Математикалық біліктілік қалыптасады, теориялық білімді практикаға ұштастырады. | |||||
| Негізгі идеялар | Су – тіршіліктің көзі. | |||||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Сарамандық жұмыс №6. №5 сабақтың тақырыбы: Еріген заттың белгілі массалық үлестері бар заттың ерітінділерін дайындау. Мақсаты: Оқу үрдісінде алған білімнің нәтижесін ерітінділер даярлауда іске асыру. Өлшеу, есептеу дағдыларын дамытып, белгілі концентрацияда ерітінді йындау іскерлігін қалыптастыру. Құралдар мен реактивтер: 50мл,25 мл, 100 мл көлемдегі стақандар, шыны таяқша, таразы, гирлер, қалақша, өлшегіш цилиндр, өлшемі бар құтылар 25 мл,50 мл,100 мл.
1.Заттың массалық үлесі көрсетілген тұз ерітіндісін дайындау; 1. Заттың массалық үлесі көрсетілген ерітіндіні дайындау үшін тиісті тапсырманы мұғалімнен ал. 2. Есептің шарты бойынша қажетті тұздың массасын және судың көлемін есепте; 3. Таразыға тұзды өлшеп конусты құтыға сал; 4. Дистилденген судың қажетті көлемін ал (сұйықтықтың көлемін өлшеу ереже сін есіңе түсір) және оны конусты құтыдағы тұздың үстіне құй; 5. Конусты құтыдағы тұз ерігенше араластыр; 6. Есепті төменде берілген үлгіде жазып шығар;
1-есеп. Массалық үлесі 5%-дық ас тұзының 50 грамм ерітіндісін дайында. 2-есеп. Массалық үлесі 5%-дық ас тұзының 25 грамм ерітіндісін дайында. 3-есеп. Массалық үлесі 10%-дық ас тұзының 10грамм ерітіндісін дайында. Берілгені: Шешуі: ω(%)= ___________________________________________________ mерітінді(г)= ___________________________________________________ _____________ ___________________________________________________ Табу керек: ___________________________________________________ _________________________________________________ Жауабы:___________ 2. Мольдік концентрациясы көрсетілген тұз ерітіндісін дайындау; 1. Мольдік концентрациясы көрсетілген тұз ерітіндісін дайындау үшін тиісті тап сырманы мұғалімнен ал. 2. Заттың мольдік концентрациясы көрсетілген ерітіндіні дайындау үшін тұздың массасын және судың көлемін есепте; 3. Тұздың қажетті массасын өлше және құтыға сал; 4. Құтыға аз ғана су құй, тұзы толық ерігенше араластыр. Содан соң қажетті белгісіне дейін құтыға су құй. 5. Есепті төменде берілген үлгіде жазып шығар; 1-есеп. Мольдік концентрациясы 0,2 моль/л 50мл ас содасының ерітіндісін дайында. 2-есеп. Мольдік концентрациясы 0,5 моль/л 50мл ас содасының ерітіндісін дайында. 3-есеп. Мольдік концентрациясы 0,1 моль/л 50мл ас содасының ерітіндісін дайында.
Берілгені: Шешуі: CM = Vер(мл)= _____________________________________________________ C(моль/л)= _____________________________________________________ _______________ _____________________________________________________ Табу керек: _____________________________________________________ mтұз(г)=? _____________________________________________________ _____________________________________________________ Жауабы:___________ Есте сақта !!! Мольдік концентрация 1 литр ерітіндідегі еріген заттың моль санымен анықталады. Мольдік концентрацияның өлшем бірлігі – моль/л. Назар аудар !!! Өлшеуіш құтының мойнында ерітіндінің нақты көлемін шектейтін дөңгелек сақина болады. Бұл жоғарыдағы белгі сұйықтың құйылатын ең жоғарғы шегін көрсетеді. Үйге тапсырма беру:
Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және топпен орындайды. | ||||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 51 сабақ | Күні: | |
| Сабақтың тақырыбы: | Сан есептерін шығару | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Ерітіндінің проценттік концентрациясына байланысты теориялық сан есептерін шығарады. | |||
| Күтілетін нәтиже | Математикалық біліктілік қалыптасады, қажетті формулалар арқылы есептеулер жүргізе алады | |||
| Негізгі идеялар | Су – тіршіліктің көзі. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі 1. 400 г суға 100 г ас тұзын еріткенде алынған ерітіндінің массалық үлесін табыңдар. 2. 300 г массалық үлесі 3% мыс (ІІ) хлоридінің ерітіндісін даярлау үшін қанша тұз, қанша су қажет? 3. 90 г суға 30 г қантты еріткенде алынатын ерітіндінің массалық үлесін табыңдар. 4. Массасы 500г 20% - тік ерітінді дайындау үшін қанша тұз, қанша су қажет? 5. 80 г суға 20 г тұз салынса, сол ерітіндінің массалық үлесі қандай болады? 6. 300 г 15% - дық ерітіндіге 100 г су қосылған. Содан кейін ерітіндінің массалық үлесі қандай болады? 7. Массасы 400 г суға 50 г тұз ерітілді. Алынған ерітіндінің массалық үлесі қандай? 8. Массасы 40 г 2% - тік қанта ерітіндісіне 5г қант қосылған. Ерітіндінің массалық үлесі қандай болғанын табыңдар. 9. 300г 2% - тік ерітінді мен 200г 3%-тік ерітінділер араластырылды. Алынған ерітіндінің массалық үлесі қандай болғанын табыңдар.
Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және топпен орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 52 сабақ | Күні: | |
| Сабақтың тақырыбы: | №5 бақылау жұмысы | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Тарау бойынша алған білімдерін қолдана біледі | |||
| Күтілетін нәтиже | Математикалық біліктілік қалыптасады, қажетті формулалар арқылы есептеулер жүргізе алады | |||
| Негізгі идеялар | Су – тіршіліктің көзі. | |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі 1. Судың мына металдармен: кальциймен натриймен әрекеттесу реация теңдеулерін жазыңдар, өнімді атаңдар. 2.Кальций мен натрий оксидтерінің сумен әрекеттесу теңдеулерін жазыңдар. 3. 30 г тұзды 170 г суда еріткенде түзілетін ерітіндідегі тұздың массалық үлесін есептеңдер. 4. Электр тогының әсерінен су айырылған кезде 6 г сутек түзілген болса, судың қандай массасы реакцияға түскен? 5. Массасы 7,2 г фосфор (Ү) оксиді сумен әрекеттескенде қанша грамм ортофосфор қышқылы түзілетіндігін есептеңдер.
Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және топпен орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||
| Сыныбы | 8 | 53 сабақ | Күні: | |
| Сабақтың тақырыбы: | Жай және күрделі бейорганикалық заттардың жіктелуі. Металдар және бейметалдар. | |||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||
| Жалпы мақсаты | Табиғаттағы заттардың түрлерімен, бейорганикалық заттардың жай зат ретінде және күрделі зат ретінде кездесуімен танысады. Периодтық жүйе бойынша металдар мен бейметалдардың орнын анықтайды. | |||
| Күтілетін нәтиже | Жай зат пен күрделі затты, металл мен бейметалды ажырата біледі. | |||
| Негізгі идеялар |
| |||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Мұғалім алдымен периодтық жүйеге қысқаша шолу жасай отырып, бейметалдар түзетін заттардың ерекшелігімен танысу үшін оларды период бойынша емес, топшадағы орны бойынша қарастыру тиімді екнін баяндайды. Табиғатта кездесетін бейметалдар саны аз. Периодтық жүйенің жоғары сол жақ бұрышынан бастап диагональ жүргізсек, бордан басталып астатпенаяқталады екен. Көбінесе бейметалл атомдарының (сутек, гелийден басқасы) сыртқы электрондық қабатындағы электрон саны 3-тен артық болады. Неғұрлым периодтық кестедегі элемент фторға (оң жаққа) қарай жақын орналасса, соғұрлым тотықтырғыштық қасиеті артады. Ол бейметалға тән қасиет. Физикалық қасиеттері де ерекше. Кейбір элемент бірнеше жай зат түзе алады. Оның себебі бейметалдарға тән құрылысында: а)кристалды торлары әртүрлі (О2 және О3азон). Нағыз белсенді бейметалдар VII топтың А топшасында орналасқан. Оттек және оның қасиеттерін қайталауға бірнеше тапсырма орындатқан жөн. Металдардан жасалған бұйымдардың қалай және қайда қолданылатыны сөз болады. Өте ерте кезден адам баласының металды қолдануынан бастап, бүгінгі техника дамыған заманда металлдарды пайдаланбайтын бірде-бір өндіріс саласы жоқ екені туралы мағлұматты оқушыларды белсенді қатыстыра отырып беруге болады. Периодтық жүйеде орналасуы түсіндіріледі. I-III топта сутек пен бордан басқалары –металдар. Барлық қосымша топшада және басқа топтардың негізгі топшасында металдар орналасқан. Период бойынша қарастырсақ кіші периодтардың бас жағында, ал үлкен периодтардың жұп қатары түгелімен және тақ қатардың бас жағында металдар орналасқан. Мұғалім оқушылармен сұрақ-жауап әдісін пайдалана отырып, сабақты түсіндіреді. Металдардың атом құрылысында бейметалдарға қарағанда қандай айырмашылығы бар екенін металдардың электрондық құрылысынан бастап түсіндіреді. Және олардың химиялық қасиеттеріне келгенде металл атомы электронын беріп, оң зарядталатыны айтылады: Ме0 - пē→Ме+п Металдар атомдардарының радиусы бейметалл атомымен салыстырғанда үлкендеу болады. Бұл тек металдарға тән қасиет. Тағы бір себебі металл атомдары электронын оңай беретіндіктен, тотықсыздандырғыштық қасиет көрсетеді. Металдық кристалдық тордың түйіндеріндегі металл атомының радиусы үлкендеу және сыртқы электрондар ядромен әлсіз байланысқандықтан тор-түйінінде атомдар және катиондар болады да, олардың аралығында бос электрондар немесе «электрон газы» пайда болады. Осы «электрон газы» металдың жалпы физикалық қасиеттерін анықтайды.
Бағалау Топтық бағалау Рефлексия | Оқушы іс-әрекеті Топқа бөлінеді Ұпай жинау арқылы оқушылар бағаланады. Оқулықпен жұмыс. Оқушылар тапсырманы топта талдайды, сосын топтың бір мүшесі басқа топтарға қорғайды , жұмыстары бағаланады. Оқушылар жұмысты жеке және топпен орындайды. | ||
Бекітемін:
Мектеп басшысының
оқу ісі жөніндегі орынбасары ________________
| Мұғалімнің аты-жөні | № _______ орта мектебі | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сыныбы | 8 | 54 сабақ | Күні: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сабақтың тақырыбы: | Сілтілік металдар мен галогендер. Химиялық элементтер және жай заттар. Сілтілік металдар, галогендер және олардың қосылыстарының биологиялық рөлі. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сілтеме | Білім стандарты, пән бағдарламасы, «Химия» оқулығы, Н.Нұрахметов. 8 - сынып оқулығы. К. Жексембина әдістемелік нұсқау. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Жалпы мақсаты | Сілтілік металдар мен галогендердің орнын анықтап, олардың жай зат және химиялық элемент ретіндегі рөлін ажыратады. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Күтілетін нәтиже | Сілтілік металдар мен галогендердің қосылыстарын, олардың маңызын біледі. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Негізгі идеялар |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Құрал-жабдықтар: | Интерактивті тақта, интерактивтік тақта арқылы Power Point, флипчарт, маркер, қарындаш, слайдтар. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сабақтың түрі | Жаңа білімді игеру сабағы. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Әдіс-тәсілдер | Сергіту сәті, АКТ-ны пайдаланып, жас ерекшеліктеріне сай сұрақтар мен тапсырмалар
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сабақ бойынша мұғалім жазбалары | Мұғалім іс-әрекеті І.Ұйымдастыру кезеңі Өткен тақырыпқа қайталау сұрақтары қойылғаннан кейін, сынып оқушылары үш топқа бөлінеді. Әрбір топқа жетекші сайланады, жетекшілер тақтаға шығып, жасырын тұрған топ аттарын таңдайды, соған сәйкес әрбір топ өздерінің атаулары бойынша түсініктеме беріп, таныстыруы тиіс (ашылуы, қолданылуы, маңызды қосылыстары). Мысалы: Йод. Мені 1811 жылы француз фабриканты химик-технолог Бернер Куртуа ашты. Атым грекше иодус- күлгін, қара көк деген мағына береді. Минералдарым лаутарит (СаІО3) және дицеит 7Са(ІО3)2·8СаСrO4, тұздарым иодидтер аз мөлшерде гидросферада- теңіз суында, скважиналанған мұнай суларында кездесемін. Теңіз орман- жапырағы деп аталатын ламинария балдырының құрамында 0,1-0,6 %-мын. Организмдеріңізге йод жетіспесе бақшаңкөз ауруына шалдығасыздар, сондықтан құрамында йоды бар асты пайдаланыңыздар. Менен медицинада дәрілер даярлайды, тамақ өнеркәсібінде, фото, кино ісінде, лабораториялық реактив ретінде де қолданыламын.
Фтор. Мен бүлдіргіш элементпін, қ.ж. солғын сары түсті бейметалмын. Өткір иісті улы газбын. Қосылыстарымда бір валенттімін, өте белсендімін, қалыпты температурада көптеген элементтермен әрекеттесемін. Менімен жанасқан кезде натрий, кальций, кремний, күкірт, фосфор мына тұрған галогендер: бром мен йод та жанады, ал су айырылады. Мені органикалық қосылыстар синтездеуде, шыны өңдеуде, ағашты шіруден сақтауда, т.б. мақсаттарда да қолданылады. Өсімдіктер мен жануарлар, адам өмірінде де елеулі рөл атқарамын. Ауыз суда мен жетіспесем тістеріңіз ауыратын болады. Мен адамзатқа қажетті элементпін.
Бром. Мені 1826жылы француз ғалымы Ж.Балар ашқан. Иісім сасық болғандықтан менен бәрі қашады. Мен қалыпты жағдайда өткір иісті қызыл-қоңыр түсті ауыр сұйықтықпын, ауада тез буланып, сары қоңыр бу түземін. Судағы ерітіндім бром суы деп аталады. Менің қосылыстарым өнеркәсіпте сурет, кино материалдарын жасауда, медицинада дәрі-дәрмектер алуда, іштен жанатын двигательдердің (автокөлік, авиация) бензин сапасын жақсартып, этилдеуде қолданыламын.
Үш топқа «Ойлан,тап» атты 3 сұрақ беріледі:
I. Кезең Әрбір топқа галогендер тақырыбы бойынша сөзжұмбақтар беріледі. Тез шешкен топқа жоғары ұпай берілсе, ал кейін шешкен топтарға тиісті ұпай сандары беріледі.
Сөзжұмбақ «Химиктер»
1. Заттар және олардың бір – біріне айналуы туралы ғылым. 2. Орыс химиясының атасы. 3. Тізбекті реакцияны шығарған химик. 4. Әрі, композитор, әрі химик – ғалым. 5. Тұзды көлдердің тұзын өнеркәсіп мүдделеріне пайдалану мүмкіндіктерін зеттеген ғалым. 6. Гипстен күкірт өндірген химик. 7. Химия ғылымының тарихында ұлы алтын заң ашқан ғалым. 8. Химияның құрылыс теориясын ашқан органик – химик.
Шешуі: Химия. 2. Зинин. 3. Семенов. 4. Бародин. 5. Морковников. 6. Бекетов. 7. Менделеев. 8. Бутлеров Сөзжұмбақ «Металдар»
1. Күмістей ақшыл, женіл металл.
 Мы поможем в написании ваших работ! | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

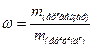 ; m(су) = mерітінді·mтұз
; m(су) = mерітінді·mтұз 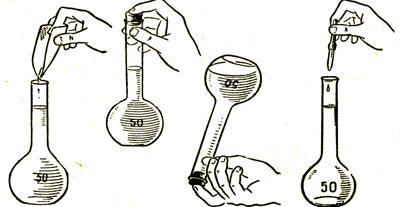
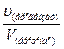 ;
; 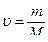 ;
; 
 1. Жеңіл 1 ұпайлық ( );
1. Жеңіл 1 ұпайлық ( ); 2. Орташа 2 ұпайлық( );
2. Орташа 2 ұпайлық( );
