Роль воды в химических реакциях.
Огромное число хим. реакций протекает в водной среде. По отношению к воде как к растворителю все вещ-ва делят на 3 группы: 1) растворимые (в 100г воды растворяется более 1г вещ-ва: щелочи, нитраты, моносахариды, низшие спирты) 2) малорастворимые ( в 100г воды растворяется от 0,01 до 1 г вещ-ва: гидроксид кальция, сульфаты серебра и свинца, анилин и фенол) 3) практически нерастворимые ( в 100г воды растворяется менее 0,01 вещ-ва: фосфаты, карбонаты, углеводороды, высшие спирты, альдегиды). Растворение- это результат диффузии. При растворении вещ-в в воде происходит гидратация, результатом чего является образование растворов. Водные растворы - это гомогенные системы, состоящие из молекул воды, частиц растворенного вещ-ва и продуктов их взаимодействия. Растворы делят на молекулярные, ионные и ионно-молекулярные. В молекулярных растворах вещ-в содержатся молекулы, окруженные оболочкой из молекул воды (гидратированные молекулы), результат гидратации (взаимодействия с водой). Электролиты- это вещ-ва, которые в растворах распадаются на ионы- диссоциируют. Отношение числа молей вещ-ва распавшегося на ионы, к общ. кол-ву растворенного вещ-ва называют степенью электрической диссоциации. Электролиты по степени диссоциации делят на сильные и слабые. Сильные практически полностью распадаются на ионы, уравнение диссоциации записывают как необратимый процесс: NAOH=NA++OH-, Al2(SO4)3=2Al3++SO2-4. Слабые диссоциируют незначительно, этот процесс обратим: HNO2 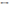 H++NO2-, СH3COOH
H++NO2-, СH3COOH  CH3COO+H+. Вода, будучи причиной диссоциации, сама незначительно диссоциирует: H2O
CH3COO+H+. Вода, будучи причиной диссоциации, сама незначительно диссоциирует: H2O 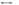 H++OH-. По хар-ру образующихся после диссоциации ионов различают три типа электролитов: кислоты, основания и соли. Кислоты - это электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка: HCl=H++Cl-, HCOOH
H++OH-. По хар-ру образующихся после диссоциации ионов различают три типа электролитов: кислоты, основания и соли. Кислоты - это электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка: HCl=H++Cl-, HCOOH  H++HCOO-. Основания - это электролиты, диссоциирующие на катионы металла и гидроксид анионы: KOH=K++OH-, CH3NH2
H++HCOO-. Основания - это электролиты, диссоциирующие на катионы металла и гидроксид анионы: KOH=K++OH-, CH3NH2  CH3NH3++OH-. Соли- это электролиты, диссоциирующие на катионы металла и анионы кислотного остатка: BaCl2=Ba2++2Cl-, CH3COONa=Na++CH3COO-. Взаимодействие ацетилена с водой: HCl
CH3NH3++OH-. Соли- это электролиты, диссоциирующие на катионы металла и анионы кислотного остатка: BaCl2=Ba2++2Cl-, CH3COONa=Na++CH3COO-. Взаимодействие ацетилена с водой: HCl  CH+H2O
CH+H2O  CH3-C
CH3-C 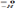 . С водой также реагируют щелочные и щелочноземельные металлы, при этом образуются щелочь и водород: 2Na+2H2O= 2NaOH+H2
. С водой также реагируют щелочные и щелочноземельные металлы, при этом образуются щелочь и водород: 2Na+2H2O= 2NaOH+H2  , Ca+2H2O=Ca(OH)2+ H2
, Ca+2H2O=Ca(OH)2+ H2  . Галогены по-разному взаимодействуют с водой. Вода горит во фторе, а хлор взаимодействует с водой медленно и обратимо: 2H2O+2F2=4HF+O2, H2O+Cl2
. Галогены по-разному взаимодействуют с водой. Вода горит во фторе, а хлор взаимодействует с водой медленно и обратимо: 2H2O+2F2=4HF+O2, H2O+Cl2  HCl+HClO. С основными и кислотными оксидами вода реагирует с образованием соответствующих гидроксидов- щелочей и растворимых кислот: BaO+H2O=Ba(OH)2
HCl+HClO. С основными и кислотными оксидами вода реагирует с образованием соответствующих гидроксидов- щелочей и растворимых кислот: BaO+H2O=Ba(OH)2
|
|
|
Гидролиз.
Гидролизом называют реакции обменного взаимодействия вещ-ва с водой, приводящие к их разложению. По направлению реакции гидролиз бывают обратимые и необратимые. Некоторые вещ-ва подвергаются необратимому гидролизу. Чаще всего такими солями являются соли, образованные слабым нерастворимым основанием и слабой летучей кислотой. Например, сульфид алюминия существует в сухом виде, так как в растворе полностью гидролизуется: Al2S3+6H2O=2Al(OH)3  +3H2S
+3H2S  . Также гидролизу подвергаются многие бинарные соединения- фосфиды, нитриды, силициды, гидриды: Zn3P2+6H2O=3Zn(OH)2
. Также гидролизу подвергаются многие бинарные соединения- фосфиды, нитриды, силициды, гидриды: Zn3P2+6H2O=3Zn(OH)2  +2PH3
+2PH3  . Необратимый гидролиз используют для получения ацетилена из карбида кальция: CaC2+2H2O=Ca(OH)2+C2H2
. Необратимый гидролиз используют для получения ацетилена из карбида кальция: CaC2+2H2O=Ca(OH)2+C2H2  . Боле значим обратимый гидролиз. В результате гидролиза соли сильного основания (щелочи) и слабой кислоты образуется кислая соль и щелочь: Na2CO3+H2O
. Боле значим обратимый гидролиз. В результате гидролиза соли сильного основания (щелочи) и слабой кислоты образуется кислая соль и щелочь: Na2CO3+H2O 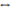 NaHCO3+NaOH. В ионном виде: CO32-+H2O
NaHCO3+NaOH. В ионном виде: CO32-+H2O 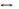 HCO-3+OH- (гидролиз по аниону). Кислые соли как продукт гидролиза по аниону получаются только в том случае, если исходная соль образована многоосновной кислотой. Когда исходная соль образована одноосновной кислотой, получаются щелочь и кислота. Гидролиз цианида калия: KCN+H2O
HCO-3+OH- (гидролиз по аниону). Кислые соли как продукт гидролиза по аниону получаются только в том случае, если исходная соль образована многоосновной кислотой. Когда исходная соль образована одноосновной кислотой, получаются щелочь и кислота. Гидролиз цианида калия: KCN+H2O  KOH+HCN. Гидролиз соли слабого основания сильной кислоты приводит к образованию сильной кислоты и основной соли: ZnCl2+H2O
KOH+HCN. Гидролиз соли слабого основания сильной кислоты приводит к образованию сильной кислоты и основной соли: ZnCl2+H2O  ZnOHCl+HCl. В ионном виде: Zn2++H2O
ZnOHCl+HCl. В ионном виде: Zn2++H2O  ZnOH++H+ (гидролиз по катиону). Основные соли как продукт гидролиза по катиону получаются в том случае, если соль образована много кислотным основанием. Если соль образована одно кислотным основанием, в результате гидролиза образуются кислота и основание. В результате гидролиза нашатыря (хлорида аммония) выделяется аммиак, который и приводит людей в чувства: NH4Cl+H2O
ZnOH++H+ (гидролиз по катиону). Основные соли как продукт гидролиза по катиону получаются в том случае, если соль образована много кислотным основанием. Если соль образована одно кислотным основанием, в результате гидролиза образуются кислота и основание. В результате гидролиза нашатыря (хлорида аммония) выделяется аммиак, который и приводит людей в чувства: NH4Cl+H2O  HCl+NH3●H2O. Гидролиз соли сильного основания сильной кислоты не происходит и, следовательно, среда раствора будет нейтральной. Например, не гидролизуется хлориды, нитраты, сульфаты щелочных металлов. Получение гидролизного спирта: отходы деревообрабатывающей промышленности содержат целлюлозу, которую подвергают гидролизу (с участием серной кислоты в кач-ве катализатора): (C5H10O5)n+NH2O
HCl+NH3●H2O. Гидролиз соли сильного основания сильной кислоты не происходит и, следовательно, среда раствора будет нейтральной. Например, не гидролизуется хлориды, нитраты, сульфаты щелочных металлов. Получение гидролизного спирта: отходы деревообрабатывающей промышленности содержат целлюлозу, которую подвергают гидролизу (с участием серной кислоты в кач-ве катализатора): (C5H10O5)n+NH2O  nC6 H12O6. Получается глюкоза, которую потом перерабатывают в спирт: C6H12O6
nC6 H12O6. Получается глюкоза, которую потом перерабатывают в спирт: C6H12O6 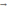 2C3H5OH+2CO2
2C3H5OH+2CO2  . Получение мыла: низкосортные жиры подвергают щелочному гидролизу. Получившиеся при этом жирные карбоновые кислоты связываются щелочью или водой в мыло: жиры+вода=мыло+глицерин. Еще более важное значение имеет гидролиз для обменных процессов, которые лежат в основе жизнедеятельности организмов. Энергетический обмен- тоже процесс гидролиза.
. Получение мыла: низкосортные жиры подвергают щелочному гидролизу. Получившиеся при этом жирные карбоновые кислоты связываются щелочью или водой в мыло: жиры+вода=мыло+глицерин. Еще более важное значение имеет гидролиз для обменных процессов, которые лежат в основе жизнедеятельности организмов. Энергетический обмен- тоже процесс гидролиза.
Дата добавления: 2019-02-12; просмотров: 353; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
