Гибридизация атомных орбиталей
Атомные орбитали одного энергетического уровня, например s- и p-АО, с
различной симметрией в свободном атоме при образовании химической связи
с другими атомами могут приобретать одинаковую форму. Этот процесс называется гибридизацией атомных орбиталей. Идею о гибридизации орбиталей в атоме выдвинул Полинг в 1931 г.
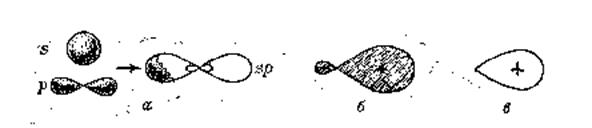
Пусть в некотором атоме одна s- и одна p-АО одного энергетического уровня участвуют в образовании двух ковалентных связей с атомами-партнерами. При этом орбитали центрального атома меняют своюсимметрию так, что обе становятся одинаковыми по форме рис. 13. Такие орбитали называют гибриднымирис. 136,б; их часто условно изображают в виде связывающих «лепестков» рис. 136. Две гибридные орбитали располагаются в пространстве так, как показано на рис. 13, а.
|
|
Рис. 13. Гибридизация одной s - и одной p -АО: а — образование двух гибридных sp -орбиталей; б— геометрическая форма одной ги бридной АО; в — условное изображение гибридной орбитали — связывающий «лепесток»
|
|
Рис. 14. Типы гибридизации: (а) – sp 2 , (б) — sp 3
По числу участвующих в гибридизации атомных орбиталёй различают следующие, наиболее распространенные типы гибридизации:
sp-гибридизация одной s- и одной p-АО (рис. 13а)
sр2-гибридизация одной s- и двух p-АО (рис. 14а)
sр3-гибридизация одной s- и трех p-АО (рис. 14б)
Число орбиталей в результате их гибридизации не изменяется. На одном энергетическом уровне центрального атома могут быть:
|
|
|
две sр-гйбридных и две p-АО;
три sр2-гибридных и одна p-АО;
четыре sр8-гибридных АО
Взаимная направленность гибридных орбиталей, которые всегда формируют s-составляющие ковалентной связи (иначе, s-связи), различна в зависимости от их числа.
Стереометрическое расположение осей валентных гибридных орбиталей центрального атома после образования связей с атомами-партнерами характеризуется углом между связями, или валентным углом.
Две sр2-гибридные орбитали некоторого центрального атома лежат на одной оси и имеют противоположное направление от ядра атома; угол между осями sp-гибридных орбиталей равен 180° (рис, 13а).
Три sp-гибридные орбитали имеют оси, лежащие в одной плоскости, и направлены в вершены равностороннего (правильного) треугольника; углы между осями sp2-гибридных орбиталей составляют 120° (рис. 14а).
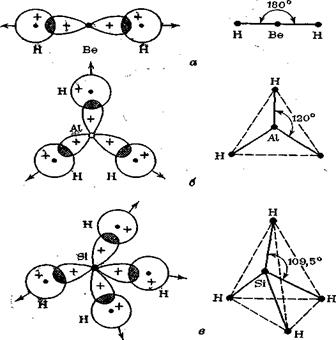 |
Четыреsр3-гибридные орбитали имеют оси, лежащие в пространстве под углами 109,5°; они Направлены в вершины правильного (идеального) тетра-эдра (рис. 14б).
Рис. 15. Геометрическая форма молекул ВеН2 — линейная (а), А1Н3 — тригональная (б) и Si Н4 — тетраэдрическая (в)
П р и м е р ы:
1. Перекрывание sp-гибридных орбиталей атома бериллия с 1s-АО двух атомов водорода приведет к образованию линейной молекулы гидрида бериллия ВеН2; валентный угол Н—Ве—Н в молекуле ВеН2 равен 180° (рис. 15,а).
|
|
|
2. Перекрывание sр2-гибридных орбиталей атома алюминия с 1s-АО трех атомов водорода приводит к образованию треугольной молекулы гидрида алюминия А1Н3 (рис. 15б), в которой валентный угол Н—А1—Н равен 120°.
3. При перекрывании sр3-гибридных орбиталей атома кремния с 1s-АО четырех атомов водорода образуется тетраэдрическая молекула силана SiH4 (рис. 15в), в которой угол Н—Si—Н равен 109,5°.
Другие примеры соединений с указанными типами гибридизации орбиталей центрального атома см. в табл. 2.
Таблица 2.
Дата добавления: 2019-02-12; просмотров: 230; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


