Тема: « d -элементы VII Б-группы и элементы семейства железа»
Учебно-целевые вопросы
1. Общая характеристика VIIБ-группы. Марганец. Химическая активность простого вещества.
2. Соединения марганца(II) и марганца(IV). Кислотно-основная и окислительно-восстановительная характеристика соединений.
3. Соединения марганца(VI): манганаты, их образование, термическая устойчивость, диспропорционирование в растворах.
4. Соединения марганца(VII) – оксид, перманганаты, кислотно-основные и окислительно-восстановительные свойства, продукты восстановления перманганатов при различных значениях рН. Химические основы применения перманганата калия и его раствора как антисептического средства и в фармацевтическом анализе.
5. Железо. Химическая активность простого вещества.
6. Соединения железа(II) и железа(III) – кислотно-основная и окислительно-восстановительная характеристика. Комплексные соединения железа(II) и железа(III) с цианид- и тиоцианат-ионами. Гемоглобин.
Задачи и упражнения для самостоятельного решения
1. Закончите уравнения реакций.
а) KМnO4 + HCl(конц.); г) KМnO4 + K2SO3 + KOH;
б) KМnO4 + KI + H2SO4; д) KМnO4 + H2O2 + H2O;
в) KМnO4 + K2SO3 + H2O; е) KМnO4 + H2S + H2O.
2. Соли марганца(II) окисляются при нагревании бромом в щелочной среде, переходя при этом в ион MnO 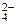 . Напишите уравнение реакции.
. Напишите уравнение реакции.
3. Сколько граммов FeSO4×7H2O можно окислить в сернокислом растворе при действии 40 мл 0,12 н. раствора KМnO4?
|
|
|
4. Что происходит при добавлении раствора Na2CO3: а) к сульфату железа(II); б) к сульфату железа(III)? Чем вызвано различие в характере образующихся продуктов реакции? Напишите уравнения реакций.
5. Закончите уравнения реакций, протекающих при сплавлении:
а) Fe2O3 + KNO3 + KOH; б) Fe2O3 + KСlO3 + KOH.
6. Закончите уравнения практически осуществимых реакций:
а) FeCl2 + K3[Fe(CN)6]; г) FeCl3 + K3[Fe(CN)6];
б) FeCl3 + K4[Fe(CN)6]; д) FeCl3 + KCNS;
в) FeCl2 + K4[Fe(CN)6]; е) K3[Fe(CN)6] + NH3×6H2O.
7. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
FeCl2 ® Fe(OH)2
Fe ® FeCl3 ® Fe(NO3)3 ® Fe2O3 ® Fe3O4
¯
FeCl3 ® Fe(OH)3
Занятие 16
Защита модуля: «Свойства s-, p-элементов. Свойства d-элементов»
Повторите материал всех занятий модуля.
Вопросы к контрольной работе по теме: «Химия элементов»
1. Водород. Характеристика с точки зрения положения в ПСЭ, химические свойства. Строение катиона гидроксония.
|
|
|
2. Общая характеристика элементов I-А группы с точки зрения положения в ПСЭ. Образование оксидов, надоксидов, пероксидов, взаимодействие их с водой. Взаимодействие пероксида натрия с СО2, биологическая роль этой реакции. Образование гидридов щелочных металлов, взаимодействие их с водой. Роль комплексных соединений натрия и калия в мембранном переносе.
3. Взаимодействие щелочных металлов с водой и кислотами. Соли щелочных металлов: сульфаты, карбонаты, галогениды, фосфаты. Ионы щелочных металлов как комплексообразователи. Их участие в формировании мембранного переноса, биологическая роль.
4. Общая характеристика элементов II-А группы. Химические свойства: взаимодействие с простыми веществами (О2, С, S, N2, Hal) и со сложными (Н2О, кислотами). Амфотерность оксида и гидроксида бериллия. Антагонизм и синергизм Са и Мg, синергизм Са и Sr (стронциевый рахит). На чем основана токсичность бария? Ионы магния и кальция как комплексообразователи.
5. Алюминий. Общая характеристика. Соединения алюминия оксид, гидроксид, соли алюминия, их гидролиз. Амфотерность оксида и гидроксида алюминия. Квасцы. Применение соединений алюминия в медицине и фармации.
|
|
|
6. Общая характеристика углерода, его аллотропные модификации. Углерод как основа всех органических молекул, типы гибридизации атомных орбиталей углерода. Физические и химические свойства простых веществ. Карбиды активных металлов и соответствующие им углеводороды.
7.Оксид углерода (II). Его кислотно-основные и окислительно-восстановительные свойства. Оксид углерода (II) как лиганд, химические основы его токсичности. Цианистоводородная кислота, простые и комплексные цианиды. Химические основы токсичности цианидов. Тиоцианаты: строение, комплексообразование.
8.Оксид углерода (IV). Строение и природа связи. Угольная кислота. Карбонаты и гидрокарбонаты: гидролиз, термическое разложение. Биологическая роль углерода и его соединений.
9.Кремний. Общая характеристика. Химические свойства. Силициды. Соединения с водородом (силаны). Оксид кремния (IV). Силикагель. Кремниевые кислоты. Биологическая роль соединений кремния, их применение в медицине и фармации.
10. Азот. Общая характеристика. Соединения с отрицательными степенями окисления азота: нитриды, амиды, аммиак. Ион аммония и его соли, кислотные свойства, термическое разложение Гидразин и гидроксиламин: строение, кислотно-основные и окислительно-восстановительные свойства.
|
|
|
11.Соединения азота с положительными степенями окисления. Оксиды азота: строение и природа связи, кислотно-основные и окислительно-восстановительные свойства. Способы получения. Биологическая роль соединений азота, их применение в медицине и фармации.
12.Азотистая кислота и нитриты. Кислотно-основные и окислительно-восстановительные свойства.
13.Азотная кислота и нитраты: получение, строение, кислотно-основные и окислительно-восстановительные свойства. «Царская водка»
14.Фосфор. Общая характеристика, аллотропные модификации. Соединения фосфора с отрицательными степенями окисления: фосфин, фосфиды. Кислотно-основные и окислительно-восстановительные свойства. Сравнение с соответствующими соединениями азота.
15.Соединения фосфора с положительными степенями окисления. Оксиды, строение природа связи. Фосфорноватистая, фосфористая, пирофосфорная, полифосфорные и метафосфорные кислоты: строение, химические свойства. Биологическая роль соединений фосфора, их применение в медицине и фармации.
16.Кислород. Особенности его электронного строения, химические свойства. Озон, его химическая активность в сравнении с кислородом (на примере взаимодействия с Ag, PbS, KI). Применение в медицине.
17.Общая характеристика элементов VII-А группы с точки зрения положения в ПСЭ. Особенность химических свойств фтора, галогеноводородные кислоты, их кислотно-основные и окислительно-восстановительные свойства.
18.Соединения, содержащие галогены в положительных степенях окисления. Взаимодействие хлора с водой и растворами щелочей. Кислородсодержащие кислоты хлора и их соли. Зависимость кислотных и окислительно-восстановительных свойств от степени окисления. Принцип дезинфицирующего действия хлорной извести.
19.Сера. Электронная формула, возможные степени окисления и валентности. Примеры соединений. Сероводород. Его окислительно-восстановительные и кислотно-основные свойства. Сульфиды металлов, гидролиз. Полисульфиды.
20.Соединения серы (IV) – оксид, хлорид, тионилхлорид, сернистая кислота, сульфиты. Кислотно-основные и окислительно-восстановительные свойства. Взаимодействие сульфитов с серой с образованием тиосульфатов. Взаимодействие тиосульфатов с окислителем. Химические основы применения соединений серы в медицине и фармации.
21.Осуществите превращения: S ® SO2 ® SO2Cl2 ® H2SO4 ® SO2 ® Na2SO3 ® Na2S2O3. Назовите полученные вещества. Какие вещества называют тиоловыми ядами? На чем основан принцип их действия?
22.Осуществите превращения, назовите вещества: НСl ® Cl2 ® CaOCl2 ® HСlO.На чем основан принцип дезинфицирующего действия хлорной извести? Как изменяются кислотные и окислительные свойства в ряду кислот НСl-HClO2-HClO3-HClO4.
23.Закончите уравнения практически осуществимых реакций, укажите их биологическую роль: СаСО3 + НСl ; ВаSO4 + НСl ; MgO + HCl ; MgO2 + HCl ; MgO + H3PO4 .Какое применение в медицине и фармации находят белая магнезия (Mg(OH)2*4MgCO3*H2O), горькая соль (MgSO4*7H2O), CaCl2, жженый гипс (CaSO4*1/2H2O). Укажите механизм их действия.
24.Закончите уравнения реакций, укажите роль Н2О2: Н2О2+КМnО4+Н2SO4 ® ; Н2О2+KI+H2O®. Применение Н2О2 в медицине как дезинфицирующего средства.
25.Закончите уравнения реакций: HNO3(конц.)+Cu ® ; NO2+KOH ® ; HNO3(разб.)+Ag ® ; NO2+NaOH+O2 ® ; HNO3(разб.)+Ca ®. Строение НNO3. Возможные степени окисления и валентности атома азота. Примеры соединений.
26.Закончите уравнения реакций, укажите роль NH3: NH3+O2 ® ; NH3+O2  ; NH3+HCl ® ; NH3+CuO
; NH3+HCl ® ; NH3+CuO 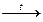 . Тип гибридизации атома азота в молекуле NH3, ее пространственное строение. Валентность и степени окисления атома азота в NH3 и NH4+. Механизм образования катиона аммония из аммиака.
. Тип гибридизации атома азота в молекуле NH3, ее пространственное строение. Валентность и степени окисления атома азота в NH3 и NH4+. Механизм образования катиона аммония из аммиака.
27.Закончите уравнения реакций: Са(НСО3)2  ; СаСl2+Na2CO3 ® ; Ca(HCO3)2+Ca(OH)2
; СаСl2+Na2CO3 ® ; Ca(HCO3)2+Ca(OH)2  ; Mg(HCO3)2
; Mg(HCO3)2  ; Ca(HCO3)2 ; Ca(OH)2+CO2(недост.) ® ; CaCO3+CO2+H2O ® . Какое применение находят эти реакции?
; Ca(HCO3)2 ; Ca(OH)2+CO2(недост.) ® ; CaCO3+CO2+H2O ® . Какое применение находят эти реакции?
28.Закончите уравнения реакций, укажите условия, назовите вещества: СО2+Са(ОН)2 ® ; СаСО3+СО2+Н2О ® ; СО+Сl2 ® ; СОСl2+Н2О ® ; Fe+CO ® ; CO2+Mg ® ; C+N2 ® ; C+N2+H2 ® . В чем заключаются химические основы токсичности угарного газа и синильной кислоты? Все ли изомеры HCN токсичны?
29.По значениям соответствующих стандартных электродных потенциалов сделайте заключение о возможности протекания реакций: а) KBr+FeCl3; б) KI+FeCl3. Сопоставьте восстановительные свойства галогенид-анионов.
30.Приведите примеры и докажите, что соединения, содержащие атом S4+, обладают окислительно-восстановительной двойственностью. Подберите коэффициенты в ОВР ионно-электронным методом.
31.Закончите уравнения реакций: Cl2+NaOH 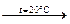 ; Cl2+NaOH
; Cl2+NaOH  . Подберите коэффициенты ионно-электронным методом. По значениям стандартных электродных потенциалов сопоставьте интенсивность протекания этих процессов.
. Подберите коэффициенты ионно-электронным методом. По значениям стандартных электродных потенциалов сопоставьте интенсивность протекания этих процессов.
32.Напишите уравнения реакций, отражающих лабораторные способы получения хлора. Подберите коэффициенты ионно-электронным методом. Какой из методов: взаимодействие с KMnO4 или с K2CrO7 – предпочтительнее по значениям стандартных электродных потенциалов.
39.Закончите уравнения реакций, учитывая, что в реакции (1) осадок не образуется, а в реакции (2) – образуется: 1) H2S+Cl2; 2) H2S+Br2. Подберите коэффициенты ионно-электронным методом. По значениям стандартных электродных потенциалов сделайте заключение о возможности протекания процессов.
40.Напишите в молекулярном и ионном видах уравнения реакций, протекающих при пропускании углекислого газа через известковую воду. Опишите визуальные наблюдения. Какие процессы будут протекать при кипячении полученного раствора? Напишите уравнения реакций и укажите роль этого процесса.
41.Докажите, что нитрит калия проявляет оксилительно-восстановительную двойственность при взаимодействии с KMnO4 и KI в кислой среде. Подберите коэффициенты ионно-электронным методом. По значениям стандартных электродных потенциалов определите какие свойства (окислительные или восстановительные) более характерны для нитрита калия.
42. Напишите уравнения гидролиза в молекулярном и ионном виде Na3PO4. По какой ступени и почему гидролиз протекает наиболее полно? Как можно усилить гидролиз этой соли? Определите рН среды на основании сопоставления табличных данных рКа и рКв кислотно-основных сопряжённых пар.
43.При добавлении к раствору AgNO3 разбавленного раствора аммиака образуется бурый осадок Ag2O , растворяющийся в избытке реактива. Напишите уравнения реакций.
Дата добавления: 2019-01-14; просмотров: 316; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
