Задачи и упражнения для самостоятельного решения
1.Объясните, почему ZnS и PbS можно получить обменной реакций в водном растворе, а Al2S3 и Cr2S3 нельзя?
2. Закончите уравнения реакций:
а) S + NaOH 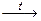 ; б) H2S + Cl2 + H2O ®; в) FeCl3 + H2S ® ;
; б) H2S + Cl2 + H2O ®; в) FeCl3 + H2S ® ;
г) KМnO4 + SO2 + H2O ® ; д) FeCl3 + Na2S + H2O ® ;
е) H2S + H2SO4(конц.) ® ; ж) P + H2SO4(конц.) ® ; з) Ag + H2S + O2 ®.
3. С какими из перечисленных веществ взаимодействует при соответствующих условиях концентрированная серная кислота:
а) Na; б) Cu; в) S; г) C; д) HCl; е) HBr; ж) HI; з) SO2; и) S?
Напишите соответствующие уравнения реакций.
4.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
H2SO4 ® SO2 ® S ® FeS2 ® SO2 ® Na2SO3 ® Na2SO4
5. Закончите уравнения реакций: а) KClO3 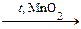 ; б) KClO3
; б) KClO3 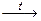 ;
;
в) KМnO4 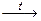 ; г) Na2O2 + CO2 ® ; д) СО2 + уН2О ® ;
; г) Na2O2 + CO2 ® ; д) СО2 + уН2О ® ;
е) NaOH 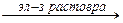 ; ж) Н2О2
; ж) Н2О2 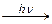 ; з) AgNO3
; з) AgNO3 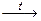 .
.
6.Закончите уравнения реакций, укажите роль пероксида водорода:
а) Н2О2 + KМnO4 + KOH ® ; б) Н2О2 + K2Cr2O7 + H2SO4 ® ;
в) Н2О2 + H2S ®; г) Н2О2 + KI + H2SO4 ® ; д) Н2О2 + KI ®
.
1. С какими из перечисленных веществ взаимодействует хлор: О2, Н2, Н2О, Na, Fe, H2S, NH3, SO2, KOH, Ca(OH)2? Напишите соответствующие уравнения реакций.
2. Закончите уравнения реакций: а) NaCl(тв) + H2SO4 (конц.) ;
б) NaBr(тв) + H2SO4 (конц.) ; в) NaI(тв) + H2SO4 (конц.).
3. С какими из веществ взаимодействует соляная кислота: Mg, Hg, Fe(OH)3, CuO, K2SO4, AgNO3, CH3COONa, MnO2, KMnO4, K2Cr2O7? Напишите соответствующие уравнения реакций.
4. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
KCl ® HCl ® FeCl2 ® FeCl3
Cl2 ® KClO3 ® KClO4
¯
Cl2 ® CaOCl2 ® HClO
|
|
|
Хлорная вода имеет запах хлора. При подщелачивании хлорной воды запах исчезает, а при последующем подкислении появляется вновь. Объясните наблюдаемое яв
Занятие №14
Тема: « d -элементы I Б, II Б, VI Б-группы»
.
Учебно-целевые вопросы
1. Общая характеристика группы элементов IБ-группы. Соединения меди(I) и меди(II), их кислотно-основная и окислительно-восстановительная характеристика, способность к комплексообразованию. Комплексные соединения меди(II) с аммиаком, аминокислотами, многоатомными спиртами.
2. Соединения серебра, их кислотно-основная и окислительно-восстано-вительная характеристики. Способность к комплексообразованию, комплексные соединения серебра с галогенидами, аммиаком, тиосульфатом.
3. Золото. Соединения золота(I) и золота(II), их кислотно-основные и окислительно-востановительные характеристики, способность к комплексообразованию.
4. Общая характеристика IIБ-группы. Цинк. Кислотно-основная и окислительно-восстановительная характеристика соединений цинка.
5. Общая характеристика VI-Б-группы. Хром. Соединения хрома(I), (III) и (VI). Кислотно-основные и окислительно-восстановительные характеристики соединений. Окислительные свойства хроматов и дихроматов в зависимости от рН среды.
|
|
|
Задачи и упражнения для самостоятельного решения
1. Напишите уравнения реакций взаимодействия меди с разбавленной и концентрированной кислотой. Почему медь не растворяется в соляной кислоте?
2. Как взаимодействуют соли меди с растворами щелочей и гидроксида аммония? Напишите соответствующие уравнения реакций.
3. Объясните почему AgCl, AgBr и AgI хорошо растворяются в растворе KCN, а в растворе аммиака растворимы только AgCl и AgBr.
4. Почему при действии хлорида натрия на раствор соли K[Ag(CN)2] не получается осадка хлорида серебра, а сульфид натрия с тем же раствором образует осадок Ag2S?
5. Закончите уравнения реакций, сопровождающихся переходом металла в растворе: а) Au + HCl + HNO3 ® ; б) Au + KCN + H2O + O2 ® .
6. Напишите уравнения реакций, с помощью которых можно осуществить превращения: Cr2O3 ® K2CrO4 ® K2Cr2O7 ® Cr2(SO4)3 ® K3[Cr(OH)6]
7. Что происходит при добавлении раствора сульфида натрия к растворам:
а) хлорида хрома(II); б) хлорида хрома(III)? Напишите соответствующие уравнения реакций.
8. Составьте уравнения реакций взаимодействия в щелочной среде хлорида хрома(III): а) с бромом; б) с пероксидом водорода.
Занятие№15
|
|
|
Дата добавления: 2019-01-14; просмотров: 281; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
