Тема: «Термодинамика фазовых равновесий»
Министерство здравоохранения Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
ПЕРВЫЙ МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ имени И.М.СЕЧЕНОВА
Фармацевтический факультет
КАФЕДРА АНАЛИТИЧЕСКОЙ, ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ ФФ
Тестовые задания по дисциплине Физическая и коллоидная химия для специальности «Медицинская биофизика»
Составители: Хачатурян М.А., Плахотная О.Н., Краснюк И.И.(мл.)
под редакцией профессора кафедры АФКХ Харитонова Ю.Я.
Тема: «Основные понятия и законы химической термодинамики. Химическое равновесие»
1. Термодинамически обратимый процесс - это процесс, в котором:
1) все промежуточные состояния равновесны;
2) все промежуточные состояния неравновесны;
3) хотя бы одно из состояний равновесно;
4) хотя бы одно из состояний неравновесно.
2. Равновесное состояние - это состояние, при котором все свойства системы не меняются во времени и:
1) в системе отсутствуют потоки вещества и энергии;
2) имеются только потоки энергии;
3) имеются потоки энергии и вещества;
4) система переходит из одного стационарного состояния в другое.
3. Выберите правильное определение стационарного состояния системы:
1) Это равновесное состояние изолированной системы;
2) Это состояние, при котором термодинамические переменные постоянны во времени, но в системе имеются потоки;
|
|
|
3) Равновесное состояние закрытой системы;
4) Равновесное состояние открытой системы.
4. Термодинамическая система – это:
1) Микроскопический объект, выделенный из внешней среды;
2) Макроскопический материальный объект, который обменивается с внешней средой теплотой;
3) Материальный объект, который обменивается с внешней средой веществом;
4) Любой макроскопический материальный объект, выделенный из внешней среды с помощью реально существующей или воображаемой граничной поверхности.
5. Энтальпия реакции может быть вычислена по энтальпиям сгорания продуктов (Р) и реагентов (R): 1) DНрц = SnDН(R) - SnDH(P)
2) DНрц = SnDН(Р) - SnDН(R)
3) DНрц = SnDН(R) + SnDН(Р)
4) DНрц = SDН(R)/DH(P)
6. Энтальпия реакции возрастает с увеличением температуры, если изменение теплоемкости DСр:
1) DСр > 0 2) DСр < 0 3) DСр ® ¥ 4) DCр = 0
7. В изохорно-изотермических условиях в системе самопроизвольно могут осуществляться только процессы, в результате которых:
1) DA > 0, 2) DA < 0, 3) DA = 0, 4) DA = const
8. Зависимость химического потенциала от активности компонента раствора может быть выражена уравнением:
1) mi = (∂G/∂T)р,ni
2) mi = (∂G/∂ni)р,т,ni
|
|
|
3) mi = moi(T,P) + RТlnai
4) mi = moi(T,P) - RTlnai
9. Теплоты сгорания графита и алмаза при стандартных условиях составляют 393,5 кДж/моль и 395,4 кДж/моль соответственно. Чему равна энтальпия перехода графита в алмаз?
1) -1,9 кДж/моль;
2) 1,9 кДж/моль;
3) 0 кДж/ моль;
4) 788,9 кДж/моль;
5) - 788,9 кДж/моль
10. Уравнение изотермы химической реакции имеет вид:
1) DGрц = - RTln(Ка/Па)
2) DGрц =Δ Н - ТΔS
3) DGрц = RTln(Ка/Па)
4) DGрц = 0
5) DG0рц = RTln(Па/Ка)
11. Из уравнения изобары химической реакции следует, что если DHрц > 0, то с ростом температуры константа равновесия:
1) уменьшается 2) растет 3) не изменяется 4) значение константы зависит от изменения энтропии системы.
12. Примером термодинамической системой можно считать:
1) 10 молекул 2) ампулу с лекарством 3) окружающую среду
13. Изолированной называется такая система, для которой:
1) Dm=0, DU=0 2) Dm ¹ 0, DU ¹ 0 3) Dm = 0, DU ¹ 0 4) Dm ¹ 0, DU=0
14. В соответствии с первым началом термодинамики для адиабатического процесса справедливо выражение: 1) DU = QV 2) QТ = -WТ 3) WТ = RTlnP1/P2 4) DU= W 5) DH = Qр
15. Энтропия - это функция состояния, приращение которой в обратимом процессе при постоянной температуре определяется:
|
|
|
1) энергией Гиббса 2) теплотой 3) энтальпией 4) внутренней энергией
16. Энергия Гельмгольца определяется соотношением:
1) А = U + pV 2) A = U - TS 3) A = H – TS 4) A = PV
17. Энергия Гиббса определяется соотношением:
1) G = U + pV 2) G = H - TS 3) G < TS 4) G = H+А.
18. В соответствии с определением, химический потенциал i-го компонента многокомпонентной системы равен:
1) (∂G/∂P)т,ni = mi 2) (∂G/∂T)р,ni = mi 3) (∂G/∂ni)р,т, ∟ni = mi 4) (∂G/∂T)р,ni = - mI
19. Стандартный химический потенциал i-го компонента при mi = 0 равен:
1) moi(T,P) = -RТlnai 2) moi = (∂Go/∂T)р,ni 3) moi(T,P) = -RТlnCi 4) moi = (∂Go/∂P)т,ni
20. Укажите интенсивные величины (свойства) термодинамической системы:
1) Т 2) V 3) А 4) S
21. Уравнение изотермы химической реакции имеет вид:
1) DGрц = - RTln(Ка /Па)
2) DGрц = - RTlnКа
3) DGрц = - RTln(Па /Ка)
4) DG0 рц = - RTln(Ка /Па)
22. В соответствии с изотермой химической реакции при Ka > Па:
1) DGрц = 0 2) DGрц > 0 3) DGрц = DGoрц 4) DGрц < 0
23. По аналогии с уравнением изобары dlnKp/dT = DHр,т/RT2 запишите уравнение изохоры химической реакции:
1) (∂U/∂S)v = Т
2) (∂lnKc/∂T)р = DUv,т/RT2
3) (∂lnKp/∂T)v = ∂Нр,т/RT2
|
|
|
4) (∂lnKc/∂T)v = DUv,т/RT2
24. Какие термодинамические характеристики из перечисленных ниже являются функциями состояния:
1) работа, 2) внутренняя энергия, 3) теплота, 4) энтальпия, 5) энтропия
25. Состояние системы, при котором ее свойства постоянны во времени при наличии потоков энергии и вещества, называется:
1) начальным, 2) стационарным, 3) переходным, 4) стандартным, 5) конечным.
26. Каково соотношение между Ср и Сv для идеального газа?
1) Сp + Сv = R 2) Сp = Сv + R 3) Сp / Сv = R
27. Как соотносятся величины ∆Н и ∆U для следующей химической реакции:
4NO(г) + 6Н2О(ж) = 4 NH3(г) + 5О2(г)
1) ∆Н > ∆U 2) ∆Н < ∆U 3) ∆Н = ∆U 4) ∆Н = ∆U = 0
28. В соответствии с уравнением Кирхгофа и на основании графика можно утверждать, что для исследуемой реакции изменение теплоемкости: 1) DCр < 0 2) DCp > 0 3) DCp = 0 4) DCp = ¥
DH
 |

T 
29. По изменению энтропии можно судить о направлении протекания процесса в системах:
1) закрытых 2) изолированных 3) открытых 4) в любых типах систем 5) только в гетерогенных
30. Свойства внутренней энергии системы в общем случае:
1) Функция состояния системы
2) Функция процесса
3) Экстенсивная функция
4) Интенсивная функция
5) Функция, равная теплоте процесса
6) Функция равная работе процесса
7) Абсолютное значение функции неизвестно
31. Термохимическое уравнение Кирхгофа может выражать зависимость:
1) Энтальпии вещества от температуры при постоянном давлении
2) Теплоемкости вещества от температуры при постоянном давлении
3) Энтальпии вещества от давления при постоянной температуре
4) Теплоемкости вещества от давления при постоянной температуре
5) Изменения энтальпии в процессе от температуры при постоянном давлении
6) Изменения энтальпии в процессе от давления при постоянной температуре
32. Какое из данных выражений, определяющих энергию Гиббса, является неправильным?
1) G = U – TS
2) G = H – TS
3) G = А + PV
4) G = U – TS + PV
33. Число микросостояний в термодинамической системе равно 1. Значение энтропии S равно:
1) 1 2) 0 3) е  4) е -
4) е - 
34. Зависимость химического потенциала от активности компонента реакции:
1) линейная 2) параболическая 3) логарифмическая 4) экспоненциальная
35. В соответствии с изотермой химической реакции при Ka < Па:
1) DGрц > 0 2) DGрц < 0 3) DGрц = 0 4) DGрц = DG0рц
36. Уравнение изобары химической реакции демонстрирует зависимость константы равновесия от:
1) изменения энергии Гиббса 2) теплоты процесса
3) давления в системе 4) температуры
37. Правильным является утверждение: внутренняя энергия - функция состояния, приращение которой равно теплоте
1) изохорного процесса, 2) изобарного процесса
3) изотермического процесса, 4) в условиях равновесия
38. В каком соотношении находятся энтальпия и внутренняя энергия термодинамической системы?
1) ΔН = ∆U - P∆V, 2) ∆Н = ∆U–kБТ, 3) Н = U + R, 4) Н = U + PV
39. Энтропия веществ, образующих идеальный ("бездефектный") кристалл при абсолютном нуле:
1) So = 0, 2) So ® ¥, 3) So << 0, 4) So > 0 5) So >> 0 6) So ® 0
40. Вычислить энтропию испарения бензола при температуре кипения 353 К, если теплота испарения бензола DН 0исп = 30,9 кДж/моль.
1) 20,81 Кал/моль 2)87,5 кДж/моль 3) 87,5 кДж/моль К 4) 87,5 Дж/моль К
41. Выберите уравнение реакции, соответствующее стандартной энтальпии образования соединения Ca(H2PO4)2∙H2O
1) Ca(H2PO4)2(кр) + H2O(ж) = Ca(H2PO4)2∙H2O(кр)
2) Ca(тв) + 6 H(г) + 2 P(красный) + 9 O(г) = Ca(H2PO4)2∙H2O(кр)
3) Ca(тв) + 2 P(белый) + 4,5 O2(г) = Ca(H2PO4)2∙H2O(кр)
4) Ca(тв) + 3 H2(г) + 2 P(красный) + 4,5 O2(г) = Ca(H2PO4)2∙H2O(кр)
42. К какому значению стремится энтропия правильно образованного кристалла при приближении температуры к абсолютному нулю:
1) к ∞ 2) к 0 3) к некоторой постоянной величине, характерной для каждого вещества 4) к ½ R.
43. В соответствии с уравнением Кирхгофа и на основании графика можно утверждать, что для исследуемой реакции изменение теплоемкостей реагентов:
1) DCp < 0 2) DCp > 0 3) DCp = 0 4) DCp →∞
 ΔН
ΔН
 |
Т
44. В соответствии с фундаментальным равенством термодинамики можно утверждать:
1) (∂G/∂P)т,ni = P 2) (∂G/∂T)р,ni = P 3) (∂G/∂T)р,ni = - S 4) (∂G/∂n)р,т,∟ni = S
45. Стандартный химический потенциал i-го компонента равен химическому потенциалу (mi = moi) при:
1) аi = 0 2) аi = 1 3) сi = 0 4) сi = 1
46. Укажите экстенсивные величины (свойства) термодинамической системы:
1) S 2) U 3) P 4) r
47. Вычислите температуру, при которой равновероятны оба направления процесса:
СО2(г) + С (тв) ↔ 2 СО(г), ΔН0рц = 173 кДж/моль, ΔS0рц = 176 Дж/моль К
1)983 К 2) 1983 К 3) 830 К 4) 1017 К
48. Зависимость химического потенциала от активности компонента реакции может быть выражена уравнением:
1) mi = (∂G/∂T)р,ni
2) mi = (∂G/∂ni)р,т,ni
3) mi = moi(T,P) + RТlnai
4) mi = moi(T,P) - RTlnai
49. Даны две реакции с соответствующими тепловыми эффектами:
1. СО(Г) + 0,5О2(Г) = СО2(Г); ∆H01
2. С(ГРАФИТ) + О2(Г) = СО2(Г); ∆H02
В каком случае правильно рассчитана стандартная энтальпия образования СО из простых веществ:
1) ∆Н01 – ∆Н02, 2) ∆Н02 – ∆Н01, 3) ∆Н01 + ∆Н02.
50. При каких значениях ∆H и ∆S изменение температуры может обратить направление самопроизвольного процесса:
1) -∆H, +∆S 2) -∆H, -∆S 3) +∆H, +∆S 4) +∆H, -∆S.
51. В соответствии с 1 началом термодинамики для изохорного процесса справедливо выражение:
1) DU = QV, 2) QT = -Wт 3) Wт = RTlnP1/P2 4) DU = W
52. Энтальпия реакции может быть вычислена по энтальпиям образования реагентов (R) и продуктов (Р):
1) DHрц = DH(P)/DH(R)
2) DHрц = SnDН(Р) + SnDН(R)
3) DНрц = SnDН(Р) - SnDН(R)
4) DНрц = SnDН(R) - SnDH(P)
53. В соответствии с уравнением Кирхгофа и на основании графика можно утверждать, что для исследуемой реакции изменение теплоемкости:
 DН
DН

 Т
Т
1) ∆Ср < 0 2) ∆Ср > 0 3) ∆Ср = 0 4) ∆Ср → ¥
54. Для реакции А(тв) + В(ж) = А(раствор). ∆Hрц > 0; ∆Sрц > 0. Какой из факторов способствует самопроизвольному растворению вещества?
1) энтальпийный
2) энтропийный
3) оба способствуют
4) оба препятствуют
5) не влияют на прохождение процесса
55. В изохорно-изотермических условиях в системе самопроизвольно могут осуществляться только процессы, в результате которых:
1) ∆A > 0, 2) DA < 0, 3) DA = 0, 4) DG > 0, 5) DG < 0 6) DG = 0
56. В изобарно-изотермических условиях в системе самопроизвольно могут осуществляться только процессы, в результате которых:
1) DG < 0, 2) DG > 0, 3) G = const, 4) DA < 0, 5) DA > 0, 6) DA = 0
57. В изобарно-изотермическом обратимом процессе изменение энергии Гиббса системы:
1) - ∆G > Wполез, 2) - ∆G < Wполез, 3) - ∆G = Wполез, 4) ∆G > Wполез
58. В изобарно-изотермическом необратимом процессе изменение энергии Гиббса системы:
1) - ∆G > Wполез, 2) - ∆G < Wполез, 3) - ∆G = Wполез, 4) ∆G > Wполез
59. В изохорно-изотермическом обратимом процессе изменение энергии Гельмгольца системы:
1) - ∆А > Wмакс, 2) - ∆А < Wмакс, 3) ∆А > Wмакс, 4) - ∆А = Wмакс
60. В изохорно-изотермическом необратимом процессе изменение энергии Гельмгольца системы:
?1) - ∆А > Wмакс, 2) - ∆А < Wмакс, 3) ∆А > Wмакс, 4) - ∆А = Wмакс
61. В состоянии равновесия энергия Гельмгольца системы:
1) A = const 2) ΔA ≥ 0 3) ΔA ≤ 0 4) A = 0
62. Закрытой называется система, для которой:
1) Dm = 0, DU = 0 2) Dm ¹ 0, DU ¹ 0 3) Dm = 0, DU ¹ 0 4) Dm ¹ 0, DU = 0
63. В соответствии с 1-ым началом термодинамики для изотермического процесса справедливо выражение:
1) DU=Qv 2) QT = WT 3) WT = RTlnP2/P1 4) DU = W
64. Какое утверждение правильно?
1) цельная кровь - это гетерогенная система
2) плазма крови - это гетерогенная система
3) кровь и плазма - это гетерогенные системы
4) кровь и плазма - это гомогенные системы.
65. Уравнение изотермы химической реакции представлено следующим выражением:
1) DGрц = RTln (Па / Ка)
2) DGрц. = Sn DGобр(прод.) - Sn DGобр (реаг.)
3) DGрц. = DH - TDS
4) DGрц. = DH + T(∂DG/∂T)р
66. Из уравнения изобары химической реакции следует, что если DHр,т<0, то с ростом температуры константа равновесия:
1) уменьшается 2) увеличивается 3) не изменяется
67. Уравнению изобары химической реакции соответствует:
1. 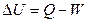 .
.
2. 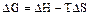 .
.
3. 
4.  .
.
5. 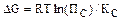 .
.
68. Константа равновесия для реакции Cu2+ + 4 NH3 ↔ [Cu(NH3)4]2+ имеет следующую оценку измерения:
1. моль/л
2. моль2/л2
3. моль3/л3
4. моль4/л4
5. л4/ моль4
69. Зависимость константы равновесия химической реакции от температуры дается уравнениями:
1) Вант-Гоффа
2) Кирхгофа
3) Гиббса-Гельмгольца
4) Клапейрона-Клаузиуса
70. К изменению значения термодинамической константы равновесия химической реакции приведет:
1) введение катализатора;
2) изменение температуры;
3) изменение концентрации реагирующих веществ;
4) отвод продуктов реакции
71. Как повлияет на смещение равновесия H2PO4- + H2O ↔ HPO4- + H3O+?
Подберите соответствующие пары «вопрос–ответ».
| Вопросы | Ответы |
| 1. Разбавление раствора водой. 2. Прибавление к раствору соляной кислоты. 3. Прибавление к раствору натрий хлорида. 4. Прибавление к раствору натрий водородфосфата. 5. Прибавление к раствору катализатора. 6. Прибавление к раствору КОН. | А. Равновесие сместится вправо. В. Равновесие сместится влево. С. Равновесие НЕ сместится. ОТВЕТ: ABCBCA |
Тема: «Термодинамика фазовых равновесий»
1. Рассчитать число степеней свободы в системе, представляющей собой порошок аспирина и амидопирина, водный раствор этих лекарств над твердыми лекарствами и пары воды над раствором (принять n = 2). 1) 0 2) 2 3) 1 4) 3
2. В соответствии с уравнением Клапейрона – Клаузиуса теплота фазового перехода может быть найдена по тангенсу угла наклона экспериментальной прямой в координатах:
1) lnP-1/T 2) ΔНф.п. – 1/Т 3) ΔSф.п .– 1/Т 4) μпар – μж
3. Укажите, какими свойствами и какого компонента – растворителя или растворенного вещества – определяется эбулиоскопическая постоянная:
1) химическими потенциалами растворенного вещества и растворителя
2) концентрацией растворенного вещества.
3) соотношением температур кипения раствора и растворителя
4) нормальной температурой кипения и удельной теплотой испарения растворителя
4. Укажите, какими свойствами и какого компонента – растворителя или растворенного вещества – определяется величина криоскопической постоянной:
1) соотношением температур замерзания растворителя и растворенного вещества
2) концентрацией растворенного вещества
3)температурой замерзания и удельной теплотой плавления растворителя
4) только химическим потенциалом растворенного вещества.
5. При экстракции распределение лекарственного вещества между двумя несмешивающимися жидкостями подчиняется закону:
1) Ka=[Kt+][An-]/[KtAn], 2) Kп= сα(х)/сβ(х), где α,β–фазы 3) Кр=е - ΔG/RT
6. Укажите максимальное число фаз однокомпонентной системы, которые могут одновременно находиться в состоянии термодинамического равновесия.
1) 4 2) 2 3) 3 4) 1
7. Чему равно число термодинамических степеней свободы у водяного пара, находящегося при давлении 100 мм ртутного столба и температуре 100ºС? 2
8.Рассчитать число степеней свободы в системе, представляющей собой порошок аспирина, водный раствор этого лекарства над твердым лекарством и пары воды над раствором(принять n = 2).
1) 0 2) 2 3) 1 4) 3
9. Уравнение Клапейрона - Клаузиуса позволяет определить, как надо изменить давление при изменении температуры, чтобы сохранить равенство:
1) энтропий S(ж) = S(п)
2) температур Т(ж) = Т(п)
3) энтальпий Н(ж) = Н(п)
4) химических потенциалов m(ж) = m(п)
10. Дать определение «составляющим веществам» системы:
1) Сумма катионов и анионов, на которые способны диссоциировать вещества.
2) Сумма агрегатных состояний веществ при данных условиях.
3) Вещества, которые могут быть выделены из системы и существовать вне её.
4) Вещества, определяющие однозначно состав системы.
11. Чему равно число термодинамических степеней свободы у воды при давлении 1,0133 · 105 Н/м2 и температуре 373 К ? 1
12. Можно ли для расчёта теплоты плавления льда использовать уравнение dP /dT = ΔH·P / (RT2)?
1) Можно, если подставить в уравнение ΔН пл, Тпл и Р- давление при Тпл.
2) Нельзя, поскольку уравнение является приближённым.
3) Поскольку для воды dP /dT < 0, то можно, но с учётом того, что ΔН пл, должна быть меньше нуля.
13. Что такое тройная точка на диаграмме состояния однокомпонентной системы?
1) Точка, в которой возможен фазовый переход первого рода тв  газ.
газ.
2) Точка, в которой заканчивается кривая равновесия тв  газ.
газ.
3) Точка начала кривой равновесия ж – г.
4) Точка сосуществования трех равновесных фаз.
14. Чему равна мольная доля бензола в паре над жидкой смесью с толуолом, если парциальное давление бензола РС6Н6 = 20,5 кПа и общее давление насыщенного пара над раствором Робщ = 31,6 кПа? 0,65
15. Имеется разбавленный раствор летучего вещества Х в жидком летучем растворителе. По какому закону изменяется парциальное давление насыщенного пара растворенного вещества Х в зависимости от его мольной доли в жидкой фазе?
1) Р(х) = Рº(х) · N(х), ж
2) Р(х) = Робщ. · N(х),ж
3) Р(х) = Робщ - Рºр-ля · N(х),ж.
4) Р(х) = Робщ ∙Рº(х) · N(х),ж
16. В соответствии с уравнением Клапейрона - Клаузиуса для процессов возгонки dP/dT принимает значения:
1) только положительные
2) только отрицательные
3) ноль
4) больше или меньше нуля
17. Данная диаграмма есть диаграмма
1) кипения двух жидкостей с ограниченной растворимостью
2) кипения двух неограниченно смешивающихся жидкостей
3) растворимости двух несмешивающихся жидкостей

17. Кривая 1 есть:
1) кривая зависимости Р насыщенного пара от состава жидкости
2) кривая температур кипения жидкости для различных составов пара
3) кривая температуры насыщенного пара для различных составов.

18. Заштрихованная область на диаграмме соответствует существованию:
1) жидкой фазы 2) газовой фазы 3) жидкости и пара 4) 3-х фаз одновременно

19. Представленная диаграмма соответствует:
1) бинарной идеальной системе
2) однокомпонентной идеальной системе
3) 3-компонентной системе
4) системе с положительным отклонением от закона Рауля
5) системе с отрицательным отклонением от закона Рауля.

20. Каким количеством степеней свободы обладает система фигуративной точке "а"? 2

21. Рассчитать число степеней свободы в системе, представляющей собой раствор сульфата бария над порошком этой соли и пары воды над раствором (принять n = 2). 1
22. Что называется «компонентом» системы?
1) Вещества, которые могут быть выделены из системы и существовать вне ее.
2) Составляющие вещества, наименьшее число которых необходимо и достаточно для образования всех возможных равновесных фаз.
3) Вещества, входящие в состав термодинамической системы.
4) Совокупность всех возможных частиц (молекул, ионов, радикалов, атомов), находящихся во всех фазах равновесной термодинамической системы.
23. Чему равно число термодинамических степеней свободы однокомпонентной системы, содержащей жидкую и твердую фазы в состоянии равновесия? 1
24. Данная диаграмма есть диаграмма зависимости давления насыщенного пара от состава бинарной системы, состоящей из:
1) двух жидкостей с ограниченной растворимостью
2) двух неограниченно смешивающихся жидкостей
3) двух несмешивающихся жидкостей
  Р T = const PВ0 Диаграмма Р – состав. Р T = const PВ0 Диаграмма Р – состав.
  (Т= const)
• a (Т= const)
• a
 PА0 1
PА0 1
 А В
состав А В
состав
|
24 а. Кривая 1 есть:
1) кривая зависимости давления насыщенного пара от состава пара
2) кривая зависимости температуры кипения жидкости для различных составов жидкости
3) кривая зависимости температуры насыщенного пара для различных составов пара
24 б. Заштрихованная область на диаграмме соответствует существованию:
1) жидкой фазы
2) газовой фазы
3) жидкости и пара
4) 3-х фаз одновременно
24 в. Представленная диаграмма соответствует:
1) бинарной идеальной системе
2) однокомпонентной идеальной системе
3) 3-компонентной системе
4) системе с отрицательным отклонением от закона Рауля
5) системе с положительным отклонением от закона Рауля
24 г. В фигуративной точке "а" система обладает числом степеней свободы, равным:
1) 2 2) 1 3) 0
25. В каком соотношении находятся величины изменения температуры замерзания двух растворов: сильного электролита (эл.) и неэлектролита (н/э), с одинаковой моляльной концентрацией?
1) D Тзам. эл. = D Тзам. н/э 2) D Тзам. эл. > D Тзам. н/э 3) D Тзам. эл. < D Тзам. н/э
26. Чему равно число термодинамических степеней свободы у воды, находящейся при давлении 760 мм ртутного столба и температуре 250 С? 2
27. Чему равна мольная доля пара толуола над жидкой смесью с бензолом, если парциальное давление толуола Р(толуол)=11,1 кПа и общее давление пара раствора Робщ=31,66 кПа? 0,35
28. Каково общее термодинамическое условие фазового равновесия?
1) равенство концентраций всех компонентов в равновесных фазах
2) равенство температур и давлений сосуществующих фаз
3) равенство значений химических потенциалов компонентов в равновесных фазах
4) равенство энергий Гиббса сосуществующих фаз.
29. Для каких растворов справедливо уравнение π = С(Х) RT:
1) для любых растворов и условий
2)для растворов летучих веществ в летучих растворителях
3)для концентрированных растворов неэлектролитов
4) для разбавленных растворов неэлектролитов, подчиняющихся закону Рауля.
30. Чем определяется полнота извлечения вещества экстракцией для определенных растворителей?
1) Временем экстракции
2) Температурой процесса экстракции
3) Массой экстрагированного вещества
4) Количеством порций экстрагента.
31. Уравнение Клапейрона - Клаузиуса позволяет определить, как надо изменить температуру при изменении давления, чтобы сохранить равенство:
1) энтропий S(ж) = S(п)
2) температур Т(ж) = Т(п)
3) энтальпий Н(ж) = Н(п)
4)химических потенциалов m(ж) = m(п); п-пар, ж-жидкость
32. Рассчитать число степеней свободы в системе, представляющей собой раствор амидопирина над твердым лекарством и пары воды над раствором (принять n = 2). 1
33. Уравнение Клапейрона - Клаузиуса нельзя применять к процессу:
1) испарения 2) возгонки 3) электролитической диссоциации 4) плавления
34. Чему равно число термодинамических степеней свободы у льда, находящегося при температуре 273 К и давлении 760 мм рт. ст.? 1
35. По уравнению Клапейрона - Клаузиуса можно оценить, как при фазовом превращении с изменением температуры изменяется:
1) энтальпия фазового перехода
2) энтропия фазового перехода
3) химический потенциал
4) давление
36. В каком соотношении находятся величины осмотического давления πа/πб двух водных растворов глюкозы и сульфата натрия с концентрацией, равной 0,0005 моль/л 1К3
37. Чему равна мольная доля этанола в паре над жидкой смесью с толуолом, если парциальное давление этанола равно 40,5 кПа и общее давление пара раствора равно 61,6 кПа? 0,66
38. Фракционная перегонка для идеального раствора возможна, если
1) Р0А = Р0В 2) Р0А > Р0В 3) Р0А < Р0В.
39. Закон Рауля – это:
1) РА = Р0А · xА (ж) 2)  3) РА = Р0А · xА (г) 4) Р0А - РА = Р0А · x (В) ,
3) РА = Р0А · xА (г) 4) Р0А - РА = Р0А · x (В) ,
где А – летуч. в-во, В – нелетуч.в-во
40. Зависимость Рi = Pi (состав) для идеальных растворов при Т = const имеет вид:
1) РА = Р0А · хА (ж);
2) РА = Р0А · хА (г);
3) РВ = хВ (ж) · Робщ.;
4) РВ = Р0В · хВ (ж).
где А, В – летучие компоненты раствора.
41. Как идеальные растворы, ведут себя следующие смеси:
1) СHCl3 – CH3СOCH3
2) C2H5OH – H2O
3) C6H6 – C6H5CН3
4) C6H14 – С7H16
42. Согласно 1 закону Коновалова, справедливо соотношение:
1) Рi = хi · Pобщ.;
2) Рi = Р0i · xi (ж) ;
3) хi = 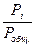 ;
;
4)  при
при 
43. Закон Дальтона – это:
1) Рi = Р0i · xi (ж);
2) ∑ Рi = Pобщ.;
3) Рi = хi (г) · Pобщ.
4) хi (ж) = 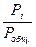
44. Если для двух компонентов идеального раствора А и В Р0А > Р0В , то
1) хА (ж) > хB (ж); 2) хА (п) > хА (ж); 3) хА (п) < хB (п),
где хi – мольная доля компонента.
45. Число степеней свободы на кривой ж « пар фазовой диаграммы воды равно:
1) 3; 2) 2; 3) 1; 4) 0
46. Для соотношения между теплотами процессов возгонки и испарения воды справедливо:
1) ΔН возг. = ΔН исп.; 2) ΔН возг. < ΔН исп. ;
3) ΔН возг. > ΔН исп. ; 4) ΔН возг. = - ΔН исп.
47. С ростом температуры в бинарной гетерогенной системе с ограниченной растворимостью, растворимость А в В растет, если:
1) ΔНраств > 0; 2 ) ΔНраств < 0; 3) ΔНраств = const
48. Каково молярное соотношение С6Н5Вr и Н2О в дистиллате  , если
, если  ,
,
 при температуре 95,20 С? 0,16
при температуре 95,20 С? 0,16
49. При кипении 2х несмешивающихся жидкостей:
1) Ткип. смеси > Ткип. А и Ткип. В;
2) Ткип. А > Ткип. смеси > Ткип. В
3) Ткип. смеси < Ткип. А, Ткип. В ;
4) Ткип. В > Ткип. смеси > Ткип. см.
50. Для диаграмм с ВКТР (верхней критической температурой растворимости) с ростом температуры характерно
1) увеличение взаимной растворимости компонентов А и В
2) уменьшение взаимной растворимости компонентов А и В
3) сохранение постоянства взаимной растворимости
51. Одновременное существование ВКТР (верхней критической температуры растворимости) и НКТР (нижней критической температуры растворимости) наблюдается на диаграмме растворимости двух веществ А и В, если при смешении:
1) ΔНраств > 0 2) ΔНраств < 0 3) ΔНраств = 0 4) ΔНраств меняет знак.
52. В точке ВКТР (верхней критической температуры растворимости) соотношение составов насыщенных растворов А/В и В/А следующее:
1)  ; 2)
; 2)  ; 3)
; 3) 
53. Какое количество парообразной воды (моль) необходимо для перегонки 1 моль органической жидкости при 900 С и давлении 101,3 кПа. 
54. При перегонке с водяным паром массовое отношение  в дистиллате:
в дистиллате:
1) растет с ростом  в жидкой смеси
в жидкой смеси
2) уменьшается с ростом  в жидкой смеси
в жидкой смеси
3) остается постоянным
55. Данная диаграмма есть диаграмма зависимости давления насыщенного пара от состава бинарной системы, состоящей из:
1) двух жидкостей с ограниченной растворимостью
2) двух неограниченно смешивающихся жидкостей
3) двух несмешивающихся жидкостей

56. Кривая 1 есть:
1) кривая зависимости давления насыщенного пара от состава паровой фазы
2) кривая зависимости давления насыщенного пара от состава жидкой бинарной системы
3) кривая зависимости температуры от давления

57. Заштрихованная область на диаграмме соответствует существованию:
1) жидкой фазы 2) газовой фазы 3) жидкости и пара 4) 3-х фаз одновременно

58. Представленная диаграмма соответствует:
1) бинарной идеальной системе
2) системе с отрицательным отклонением от закона Рауля
3) 3-компонентной системе
4) системе с положительным отклонением от закона Рауля

59. В фигуративной точке "а" система обладает числом степеней свободы, равным:
1) 2 2) 1 3) 0 
60. Отрицательный наклон на диаграмме состояния воды (в координатах Р-Т) может иметь кривая:
1) кипения
2) плавления
3) возгонки
4) давления пара над переохлажденной жидкостью
61. Точка на диаграмме состояния двухкомпонентной системы (в координатах температура – состав), в которой могут находиться в равновесии три фазы (расплав и два вида кристаллов), называется:
1) Тройной
2) Критической
3) Эвтектической
4) Фигуративной
62. Относительное понижение давления пара растворителя над раствором определяется:
1) Законами Коновалова
2) Законом Рауля
3) Правилом рычага
4) Законом действующих масс
63. Какое из приведенных утверждений является верным:
1) Температура кипения раствора меньше, чем температура кипения чистого растворителя
2) Температура замерзания раствора меньше температуры замерзания чистого растворителя
3) С увеличением концентрации растворенного вещества увеличивается давление пара растворителя над раствором
4) С уменьшением концентрации растворенного вещества уменьшается давление пара растворителя над раствором
5) С увеличением концентрации растворенного вещества уменьшается осмотическое давление раствора
64. Распределение каждого из растворенных веществ между двумя равновесными жидкими фазами при постоянной температуре определяется индивидуальной константой распределения, величина которой не зависит от присутствия других веществ – это:
1) закон Нернста - Шилова
2) закон действующих масс
3) закон Коновалова
4) закон Дальтона
5) закон Бугера-Ламберта-Бера
65. Процесс извлечения растворенного вещества из раствора другим растворителем, который не смешивается с первым растворителем и лучше растворяет извлекаемое вещество – это:
1) Экстракция
2) Перегонка
3) Адсорбция
4) Кристаллизация
66. Над каким из водных растворов, в которых мольные доли растворенных веществ равны, давление насыщенного пара при данной температуре будет наименьшим?
1) KNO3
2) С12Н22О11
3) FeCl3
4) Ca(NO3)2
67. Уравнение Клапейрона-Клаузиуса описывает зависимость равновесного давления от температуры для:
1) Однокомпонентной однофазной системы
2) Однокомпонентной двухфазной системы
3) двухкомпонентной однофазной системы
4) двухкомпонентной двухфазной системы
5) двухкомпонентной трехфазной системы
68. Наибольшая степень извлечения будет достигнута в том случае, если экстракцию (при объёме экстрагента 60 мл) проводить:
1) однократно
2) пятикратно по 12 мл
3) двукратно по 30 мл
4) четырёхкратно по 15 мл
69. Согласно 1 закону Коновалова в паре над раствором больше по сравнению с раствором:
1) Растворителя
2) Растворенного вещества
3) Растворителя и растворенного вещества поровну
4) Легколетучего компонента
70. Для проведения перегонки с водяным паром необходимое условие:
1) Неограниченная растворимость жидкостей друг в друге
2) Ограниченная растворимость жидкостей друг в друге
3) Взаимная нерастворимость жидкостей друг в друге
71. Представленная диаграмма соответствует:
1) бинарной идеальной системе
2) бинарной системе с отрицательным отклонением от закона Рауля
3) 3-х компонентной системе
4) бинарной системе с положительным отклонением от закона Рауля

71а. Кривая 1 есть:
1) кривая зависимости давления насыщенного пара от состава паровой фазы
2) кривая зависимости температуры кипения смеси от состава жидкой бинарной системы
3) кривая зависимости температуры от давления
71б. Заштрихованная область на диаграмме соответствует существованию:
1) жидкой фазы
2) газовой фазы
3) жидкости и пара
4) 3-х фаз одновременно
71в. Представленная диаграмма соответствует:
1) бинарной идеальной системе
2) системе с отрицательным отклонением от закона Рауля
3) 3-компонентной системе
4) системе с положительным отклонением от закона Рауля
71 г. В фигуративной точке "а" система обладает числом степеней свободы, равным:
1) 2 2) 1 3) 0
72. Данная диаграмма есть диаграмма
1) кипения двух жидкостей с ограниченной растворимостью
2) кипения двух неограниченно смешивающихся жидкостей
3) кипения двух несмешивающихся жидкостей

72а. Кривая 1 есть:
1) кривая зависимости давления насыщенного пара от состава паровой фазы
2) кривая зависимости температуры кипения от состава жидкой бинарной системы
3) кривая зависимости температуры от давления
72б. Заштрихованная область на диаграмме соответствует существованию:
1) жидкой фазы
2) газовой фазы
3) жидкости и пара
4) 3-х фаз одновременно
72в. Представленная диаграмма соответствует:
а) бинарной идеальной системе
б) системе с отрицательным отклонением от закона Рауля
в) 3-компонентной системе
г) системе с положительным отклонением от закона Рауля
72г. В фигуративной точке "а" система обладает числом степеней свободы, равным:
1) 2 2) 1 3) 0
73. Данная диаграмма есть диаграмма зависимости давления насыщенного пара от состава бинарной системы, состоящей из:
1) двух жидкостей с ограниченной растворимостью
2) двух неограниченно смешивающихся жидкостей
3) двух несмешивающихся жидкостей

73а. Кривая 1 есть:
1) кривая зависимости давления насыщенного пара от состава паровой фазы
?2) кривая зависимости давления насыщенного пара от состава жидкой бинарной системы
3) кривая зависимости температуры от давления
73б. Заштрихованная область на диаграмме соответствует существованию:
1) жидкой фазы
2) газовой фазы
3) жидкости и пара
4) 3-х фаз одновременно
73в. Представленная диаграмма соответствует:
?1) бинарной идеальной системе
2) однокомпонентной идеальной системе
3) системе с положительным отклонением от закона Рауля
4) системе с отрицательным отклонением от закона Рауля
73г. В фигуративной точке "а" система обладает числом степеней свободы, равным:
1) 2 2) 1 3) 0
74. Каково давление насыщенного пара бензола над жидкой смесью его с толуолом, если мольная доля толуола в растворе равна 0,60, а давление пара чистого бензола 51,3 кПа? 20,52 кПа
75. Правило фаз Гиббса для бинарной гетерогенной системы имеет вид:
1) С = К + Ф – 2 2) С = 4 – Ф 3) С = 3 – Ф (при n=1) 4) К = Ф + 2
76. Данная диаграмма есть диаграмма
1) кипения двух несмешивающихся жидкостей
2)кипения двух неограниченно смешивающихся жидкостей
3)растворимости двух ограниченно смешивающихся жидкостей
4) распределения веществ в 3-х компонентной системе

77. Укажите свойства присущие азеотропам:
1) Одинаковые составы пара и раствора
2) Изменение состава раствора при перегонке
3) Изменение температуры кипения при перегонке
4) Изменение состава пара при перегонке
78. Каким способом азеотроп можно разделить на составляющие компоненты?
1) Простой перегонкой
2) Перегонкой с водяным паром
3) Химическим связыванием одного из компонентов
4) Фракционной перегонкой
Тема: «Основы электрохимии»
1. Какой процесс (окисления или восстановления) протекает на положительном электроде гальванического элемента?
1) Восстановления
2) Восстановления, если потенциал электрода более положительный, чем  электрохимической пары.
электрохимической пары.
3) Окисления
4) Окисления, если потенциал электрода более отрицательный, чем 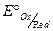 электрохимической пары.
электрохимической пары.
2. Согласно теории Дебая - Хюккеля связь коэффициента активности иона с зарядом иона выражается формулой:
1) fi.= (fz+ + f z-)·1 / (Z+ + Z-)
2) f i = 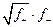
3) 
3. Для измерения рН желудочного содержимого можно взять в качестве индикаторного электрода:
1) стеклянный
2) хлорсеребряный
3) каломельный
4) графитовый
4. Уравнение Вант-Гоффа  справедливо:
справедливо:
1) для любых растворов и условий
2) для растворов электролитов
3) для растворов неэлектролитов
4) для разбавленных растворов, подчиняющихся закону Рауля
5. Что такое ΔS гидратации ионов? Каков знак ΔS гидратации?
1) Изменение энтропии при растворении электролита в воде, Δ S > 0.
2) Изменение энтропии в процессе распада электролита на ионы, ΔS >0.
3) Изменение энтропии в процессе образования акватированного иона, ΔS < 0.
4) Изменение энтропии в процессе образования ассоциатов, ΔS < 0.
6. Уравнение Нернста для хлорсеребряного электрода:
1) 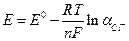
2) 
3) 
4) 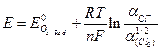
7. Вычислить потенциал водородного электрода (давление водорода составляет 101,3 кПа), погруженного в раствор нитрата аммония с концентрацией 0,1 моль/л. Т = 298 К, Ка(NH4+) = 5,6∙10-10, рКа = 9,25. Ответ дать в виде ±Х,ХХ -0,30
8. Буферный раствор - это:
1) раствор соли сильного основания и слабой кислоты и соответствующего основания
2) раствор сильной кислоты и избытка слабого основания.
3) раствор, способный поддерживать постоянство состава при добавлении к нему других веществ.
4) раствор, способный поддерживать постоянство рН при добавлении небольших количеств сильных кислот или оснований, а также при разбавлении.
9. Сравните рН водных растворов хлорида аммония(I) и хлорида калия(II) одинаковых концентраций
1) рНI = рНII 2) рНI < рНII 3) рНI < НII 4) рНI > рНII
10. Удельная электропроводность раствора сильного электролита зависит от разведения следующим образом:
1) Линейно возрастает с ростом разведения
2) Линейно убывает с ростом разведения
3) С ростом разведения проходит через максимум
4) С ростом разведения проходит через минимум
5) Не зависит
11. Укажите, какие свойства сильных электролитов типа 1-1изменяются пропорционально корню квадратному молярной концентрации
1) α, λ 2) λ, lg fi 3) 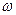 , α 4)
, α 4) 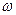 , λ
, λ
12. Как влияет давление СI2 на величину потенциала хлорного электрода?
1) Потенциал хлорного электрода определяется только 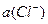
2) не влияет
3) 
4)  ½
½
13. Каково термодинамическое условие образования положительного заряда на поверхности металла,
опущенного в раствор соли этого металла?
1) Потенциал  более положительный, чем потенциал стандартного водородного электрода.
более положительный, чем потенциал стандартного водородного электрода.
2) 
3) 
4) 
14. Кольрауш установил, что эквивалентная электропроводность сильного электролита равна:
1) разнице между электропроводностью катионов и анионов,
2) сумме вкладов отдельных ионов,
3)молярной электропроводности слабого электролита той же концентрации
15. При тщательном эксперименте с низкими концентрациями для определения электропроводности электролита необходимо принять во внимание, что:
1) λ0 = z+ ·λ+0 + z- ·λ- 0,
2) λ = ϰ /С
3) ϰ=Кяч. /R
4) ϰ (электролит) = ϰ (раствор) - ϰ (растворитель).
16. Гальванический элемент состоит из двух водородных
электродов, из которых один - стандартный. В какой из перечисленных растворов следует погрузить другой электрод для получения наибольшей ЭДС:
1) 0,1 моль/л НС1
2) 0,1 моль/л СН3СООН
3) 0,1 моль/л Н3РО4
4) 0,1 моль/л Н2SO4
17. ЭДС элемента Сu | Сu2+ (а=х) || Сu2+ (а=1) | Сu при 250 С равна на 0,0785 В. Определите активность ионов меди у анода (х):
1) 5,0∙10-2 моль/л
2) 1,2∙10-3 моль/л
3) 1,4∙ 10-4 моль/л
4) 2,2∙10-3 моль/л
18. Вычислить потенциал водородного электрода (давление водорода равно 101,3 кПа), погруженного в дистиллированную воду. Т = 298 К. Ответ дать в виде ±Х,ХХ
19. При каком соотношении концентраций окисленной и восстановленной форм потенциал системы [Fe(CN)6]3- + е ↔ [Fe(CN)6]4- будет равен 0,28 В? Е0 = 0,36 В. Ответ дать в виде Х,ХХ
20. Зона буферного действия основной буферной системы В/ВН+ ограничена интервалом:
1) рКв ±1 2) рКа ВH+ ±1 3) рОН ± рКв 4) рОН + рН
21. Сравните рН растворов гидроксида натрия с концентрацией 0,1 моль/л (I) и раствора ацетата натрия такой же концентрации (II):
1) рНI = рНII 2) рНI < рНII 3)рНI » рНII 4) рНI > рНII
22. Какое свойство растворителя является определяющим для его способности ионизировать растворенное вещество (помимо способности взаимодействовать с этим веществом)?
1) Вязкость
2) Химический потенциал
3)Диэлектрическая проницаемость
4) Коэффициент активности.
23. Каково термодинамическое условие образования отрицательного заряда на поверхности металла, опущенного в раствор своей соли?
1) Потенциал  более положительный, чем потенциал стандартного водородного электрода.
более положительный, чем потенциал стандартного водородного электрода.
2) 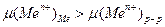
3) 
4) 
24. Сравните рН растворов сульфида натрия с концентрацией 0,1 моль/л (I) и сульфата меди с такой же концентрацией(II).
1) рНI = рНII 2) рНI <рНII 3) рНI >>рНII 4) рНI > рНII
25. Существуют ли гальванические элементы, для которых величина э.д.с. не зависит от величин стандартных электродных потенциалов?
1) не существуют ни при каких условиях.
2) существуют, если подобрать в соответствии с уравнением Нернста активности потенциалобразующих ионов.
3) существуют, это концентрационные элементы
4) существуют, это топливные элементы
26. На кривой потенциометрического титрования слабой кислоты щелочью буферной называется область:
1) рН >> рКа, 2) рН < < рКа, 3) рН ≈ рКа.
27. Аммонийно-аммиачную буферную систему могут образовывать следующие пары веществ:
1. NH4Cl + HCl; HCl – в недостатке
2. NH4Cl + NaOH; NaOH – в недостатке
3. NH4Cl + НCl, взяты в эквивалентном количестве
4. NH4Cl + NaOH, взяты в эквивалентном количестве
5. NH4Cl + NH3, взяты в эквивалентном количестве
28. Буферные растворы приготовлены смешением растворов одинаковой концентрации (0,1 моль/л):
Муравьиной кислоты Формиата натрия
V, мл V, мл V, мл
I 5,0 5,0
II 7,5 2,5
III 2,5 7,5
IV 1,0 9,0
Расположите буферные растворы в порядке возрастания их буферной емкости по кислоте
29. При каком соотношении концентраций окисленной и восстановленной форм потенциал системы: Fe 3+ + e ↔ Fe 2+ будет равен 0,8 В? E0 = +0,77 В. Ответ дать в виде Х,ХХ.
30. Обратимо работающий гальванический элемент выделяет теплоту в окружающую среду. Зависит ли ЭДС этого элемента от температуры?
1) не зависит от температуры
2) с ростом температуры ЭДС понижается
3) с ростом температуры ЭДС повышается
4) приведенных данных недостаточно для ответа
31. От каких факторов преимущественно зависит рН буферного раствора?
1) от давления
2) от разбавления
3) от концентрации веществ, входящих в буферную систему
4) от отношения концентраций компонентов буферной системы
32. От каких факторов преимущественно зависит буферная емкость раствора?
1) от давления
?2) от разбавления
3) от концентрации веществ, входящих в буферную систему
4) от отношения концентраций компонентов буферной системы
33. В 100 мл воды растворили 3,94 г манганата калия и 1,58 г перманганата калия. Вычислите редокс-потенциал образовавшейся системы (изменением объема при растворении пренебречь). E0 (MnO4-|MnO42-) = 0,56 B. М(КMnO4) = 158 г/моль; M(K2MnO4) = 197 г/моль. Ответ дать в виде Х,ХХ.
34. Выберите формулу, связывающую удельную электропроводность, константу ячейки и сопротивление раствора электролита.
1) Кяч = æ·Rx 2) Кяч = æ/Rx 3)Кяч = Rx/æ 4) Кяч = æ 
35. Какой объем раствора с молярной концентрацией эквивалента 0,15 моль/л нужно залить в сосуд с электродами на расстоянии 1 м, чтобы измеренная электропроводность была эквивалентной электропроводностью этого раствора? Ответ дать в формате Х,ХХ.
36. Как должен быть составлен элемент, чтобы в нем протекала реакция Zn + 2 Fe3+ ↔ Zn2+ + 2 Fe2+?
1)Pt| Zn | Zn2+ || Fe2+ , Fe3+ | Pt
2) Pt| Fe2+ , Fe3+ || Zn2+ | Zn| Pt
3) Cu| Zn | Zn2+ || Fe3+ | Fe| Cu
37. Можно ли приготовить ацетатный буферный раствор с рН = 5,2? (рКа (CH3COOH) = 4,75)
1) можно,
2) нельзя,
3) можно при добавлении кальций хлорида,
4) можно при достаточном разбавлении.
38. К электродам сравнения относят:
1) Водородный электрод
2) Хлорсеребряный электрод
3) Стеклянный электрод
4) Хингидронный электрод
5) Каломельный электрод
Дата добавления: 2019-01-14; просмотров: 1863; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
