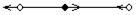Дипольные моменты некоторых молекул
В газообразном состоянии
| Молекула | μ,D |
| Н2 | 0 |
| N2 | 0 |
| CO | 0,1098 |
| NO | 0,15872 |
| HF | 1,82178 |
| HC1 | 1,1086±0,0003 |
| HBr | 0,8272±0,0003 |
| HI | 0,448±0,001 |
| C,O2 | 0 |
| H2O | 1,8546±0,004 |
| H2S | 0,97833 |
| NO2 | 0,319±0,01 |
| SO2 | 1,63305 |
| NH3 | 1,4718±0,0002 |
| PH3 | 0,5740±0,0003 |
| SO3 | 0 |
| Молекула | μ,D |
| CH4 | 0 |
| CH3C1 | 1,8963±0,02 |
| CH2C12 | 1,60±0,032 |
| CHC13 | 1,04±0,02 |
| CC14 | 0 |
| C2H5OH(trans) | 1,44±0,03 |
| C6H6 | 0 |
| C6H5C1 | 1,69±0,03 |
| C6H5Br | 1,70±0,03 |
| C6H5NO2 | 4,22±0,08 |
| С2Н6 | 0 |
| С2Н5О С2Н5 | 0,99 |
Дипольный момент молекул, диэлектрическая
Проницаемость и поляризация жидкостей
| Вещество | Вода | Хлороформ | ||||||
| μ, D | 1,84 | 1,18 | ||||||
| t, 0С | ε | Р∞,см3/моль | ε | Р∞,см3/моль | ||||
| 0 | 87,83 | - | 5,19 | 51,1 | ||||
| 10 | 83,86 | - | 5,00 | 50,0 | ||||
| 20 | 80,08 | - | 4,81 | 49,7 | ||||
| 25 | 78,25 | - | 4,72 | 47,5 | ||||
| 30 | 76,47 | - | 4,64 | 48,8 | ||||
| 40 | 73,02 | - | 4,47 | 48,3 | ||||
| 50 | 69,73 | - | 4,31 | 47,5 | ||||
| Вещество | Четыреххлористый углерод | Этиловый спирт | ||||||
| μ, D | 0 | 1,67 | ||||||
| t, 0С | ε | Р∞,см3/моль | ε | Р∞,см3/моль | ||||
| 0 | - | - | 27,88 | 74,3 | ||||
| 10 | - | - | 26,41 | 72,2 | ||||
| 20 | 2,24 | - | 25,00 | 70,2 | ||||
| 25 | 2,23 | 28,2 | 24,25 | 69,2 | ||||
| 30 | - | - | 23,52 | 68,3 | ||||
| 40 | - | - | 22,16 | 66,5 | ||||
| 50 | 2,18 | - | 20,87 | 64,8 | ||||
| Вещество | Ацетон | Этиловый эфир | ||||||
| μ, D | 2,71 | 1,22 | ||||||
| t, 0С | ε | Р∞,см3/моль | ε | Р∞,см3/моль | ||||
| 0 | 23,3 | 184 | 4,80 | 57,4 | ||||
| 10 | 22,5 | 178 | 4,58 | 56,2 | ||||
| 20 | 21,4 | 173 | 4,38 | 55,0 | ||||
| 25 | 20,9 | 170 | 4,27 | 54,5 | ||||
| 30 | 20,5 | 167 | 4,15 | 54,0 | ||||
| 40 | 19,5 | 162 | - | - | ||||
| 50 | 18,7 | 158 | - | - | ||||
| Вещество | Бензол
| Бромбензол | ||||||
| μ, D | 0 | 1,53 | ||||||
| t, 0С | ε | Р∞,см3/моль | ε | Р∞,см3/моль | ||||
| 0 | - | - | 5,7 | 107,9 | ||||
| 10 | 2,30 | - | 5,5 | 105,5 | ||||
| 20 | 2,29 | - | 5,4 | 103,3 | ||||
| 25 | 2,27 | 26,6 | - | - | ||||
| 30 | 2,26 | - | 5,3 | 100,2 | ||||
| 40 | 2,25 | - | 5,1 | 97,6 | ||||
| 50 | 2,22 | - | 5,0 | 95,4 | ||||
| Вещество | Хлорбензол | Нитробензол | ||||||
| μ, D | 1,57 | 3,93 | ||||||
| t, 0С | ε | Р∞,см3/моль | ε | Р∞,см3/моль | ||||
| 0 | 6,09 | 85,5 | - | - | ||||
| 10 | - | - | 37,85 | 365 | ||||
| 20 | 5,65 | 81,5 | 35,97 | 354 | ||||
| 25 | 5,63 | 82,0 | - | 348 | ||||
| 30 | - | - | 33,97 | 339 | ||||
| 40 | 5,37 | 77,8 | 32,26 | 320 | ||||
| 50 | 5,23 | 76,8 | 30,5 | 316 | ||||
Строение и константы многоатомных молекул в газообразном состоянии
Число атомов в молекуле n>3. Число колебаний 3n-5 у линейный и 3n-6 у нелинейных молекул. Число частот валентных колебаний n-1, число частот деформационных колебаний 2n-4 у линейных и 2n-5 у нелинейных молекул.
ОБОЗНАЧЕНИЕ: υ - валентные; δ - деформационные, s - симметричные, as -ассиметричные, γ - крутильные колебания, σ - колебательный момент, перпендикулярный оси молекулы, π- колебательный момент, паралелльный оси молекулы.
| Молекула и форма | Межъядерное расстояние, 10-10м | Тип колебания | |||
| Направление колебания | Обозначение | ||||
| СО2 (О=С=О) линейная, симметричная | 1,13 |
υs
υаs
δas | υs υаs δas | ||
| СS2 (S=C=S) линейная, симметричная | 1,54 | υs υаs δas | |||
| N2О(N-=N+=O) Линейная, несимметричная | N+=O 1,22 N-=N+ 1,1· | υs υаs δas | |||
NO2, изогнутая
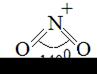
| 1,18 |
υs
υ аs
δs | υs υаs δs | ||
Н2О, изогнутая
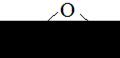
| О-Н 0,97 Н-Н 1,53 | υs υаs δs | |||
Н2S, изогнутая
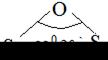
| S-Н 1,35 | υs υаs δs | |||
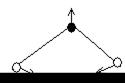
SO2, изогнутая
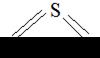
| S=O 1,45 | υs υаs δs | |||
| Молекула и форма | Межъядерное расстояние, 10-10м | Тип колебания | |||
| Направление колебания | Обозначение | ||||
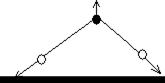
NH3, симметричная пирамида
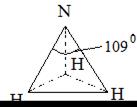
| H-N 1,01 H-H 1,61 Высота пирамиды 0,3 |
υs
υ аs
δs
δаs | υs υаs δs δаs | ||
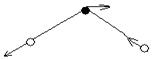
РС13, симметричная пирамида
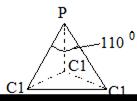
| С1-С1 3,1 Р-С1 2,0 | υs υаs δs δаs | |||
| С2Н2, линейная, симметричная Н-С≡С-Н | С-Н 1,06 С≡С 1,20 |
 υ1s
υ1s
 υ2s
υ2s
 υаs
υаs
 δ1аs
δ1аs
 δ2аs
δ2аs
| υ1s υ2s υаs δ1аs δ2аs | ||
| Молекула и форма | Межъядерное расстояние, 10-10м | Тип колебания | |||
| Направление колебания | Обозначение | ||||
СН3С1, тетраэдр
| С-Н 1,1 С-С1 1,77 |
υs
δs
υаs
δаs | υs (С-С1) υs (С-Н) υаs (С-Н) δs (Н-С-Н) δ аs (Н-С-С1) δаs(Н-С-Н) | ||
СНС13, тетраэдр

| С-Н 1,1 С-С1 1,8 С1-С 2,93 | υs (С-С1) υs (С-Н) υаs (С-С1) δs (С1-С-С1) δ аs (Н-С-С1) δаs(С1-С-С1) | |||
СС14, правильный тетраэдр
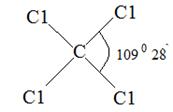
| С-С1 1,76 С1-С1 2,99 | υs υаs δs δаs | |||
СН4, правильный тетраэдр
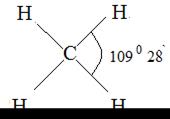
| С-Н 1,09 | υs (С-Н) υаs (С-Н) δs (Н-С-Н) δ аs (Н-С-Н) | |||
С2Н4, плоская
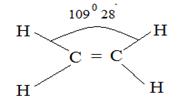
| С-Н 1,071 С=С 1,353 |  υ2(π,s)
υ2(π,s)
| υ1(π,s) υ2(π,s) υ(π,as) υ (σ,s) υ(σ,as) δ (π,s) | ||
| Молекула и форма
| Межъядерное расстояние, 10-10м | Тип колебания | |||
| Направление колебания | Обозначение | ||||
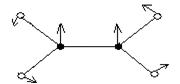
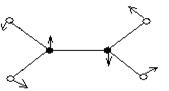
С2Н4, плоская

|  υ1(π,s)
υ1(π,s)
 δ (π,s)
δ (π,s)
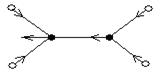 υ(π,as)
υ(π,as)
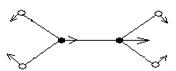 δ (π,as)
δ (π,as)
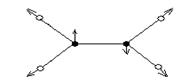 υ (σ,s)
υ (σ,s)
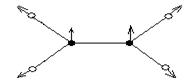 υ(σ,as)
υ(σ,as)
 δ (σ,as)
δ (σ,as)
 δ (σ,s)
δ (σ,s)
| δ (π,as) δ (σ,s) δ (σ,as) δ` (σ,s) δ` (σ,as) γ(r) | |||
| Молекула и форма | Межъядерное расстояние, 10-10м | Тип колебания | |||
| Направление колебания | Обозначение | ||||
С2Н4, плоская

| 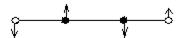 δ (s)
δ (s)
 δ (аs)
δ (аs)
| ||||
Энергия кристаллических решеток
|
| Энергия кДж/моль | |||||||
| F | C1 | Br | I | O | S | OH | H | |
| Li | 1024 | 841,.8 | 802,0 | 748,0 | 2900 | - | 854,0 | 920,8 |
| Na | 940,0 | 774,0 | 741,0 | 694,0 | - | - | 884,5 | 840,0 |
| K | 830,0 | 730,0 | 677,5 | 637,5 | - | - | 790,0 | 690,0 |
| Rb | 774,0 | 678,0 | 654,0 | 618,0 | - | - | 766,0 | 678,0 |
| Cs | 732,0 | 646,0 | 625,5 | 592,0 | - | - | 720,0 | 653,0 |
| NH4 | 816,0 | 640,0 | 615,0 | 578,0 | - | - | - | - |
| Ag | 871,0 | 783,0 | 757,0 | 736,6 | 2455 | - | - | - |
| Cu+ | - | 866,0 | 829,0 | 787,0 | 2720 | 2580 | - | - |
| Mg | 2920 | 2500 | 2420 | 2505 | 3950 | 3320 | - | - |
| Ca | 2620 | 2240 | 2155 | 2060 | 3530 | 3110 | 2580 | - |
| Sr | 2460 | 2120 | 2048 | 1945 | 3340 | 2900 | 2425 | - |
| Ba | 2315 | 2020 | 1950 | 1845 | 3140 | 2240 | 2300 | - |
| Cu2+ | - | 2762 | - | - | 4140 | 3725 | - | - |
| Zn | - | - | - | - | 4130 | 3442 | - | - |
| Cd | 2638 | - | - | - | 3655 | 3230 | - | - |
|
|
|
Температура плавлениея, атомный (молекулярный) объем вблизи температуры плавления и характеристическая температура некоторых веществ в кристаллическом состоянии
| Вещество | Т плавл,0К | Vсм3/моль | Характеристическая температура |
| Ag | 1235 | 10,28 | 214 |
| A1 | 931,5 | 10,19 | 389 |
| Au | 1337 | 10,21 | 173 |
| Ba | 1120 | 36,34 | 115 |
| Be | 1551 | 5,26 | 1000 |
| Bi | 544,1 | 21,26 | 80 |
| Br2 | 265,8 | 25,08 | 86 |
| C(алмаз) | 3800 | 3,41 | 1910 |
| Ca | 1123 | 25,22 | 228 |
| Cd | 594 | 12,99 | 168 |
| C12 | 171,9 | 21,36 | 115 |
| Co | 1762,9 | 6,76 | 385 |
| Cr | ~2150 | 7,72 | 490 |
| Cu | 1356 | 7,12 | 313 |
| F2 | 50 | 16,66 | 100 |
| Fe | 1806 | 7,11 | 433 |
| H2 | 13,96 | 13,21 | 91 |
| I2 | 386,6 | 25,93 | 76 |
| K | 336,1 | 45,30 | 100 |
| Li | 456 | 11,76 | 385 |
| Mg | 923 | 13,98 | 290 |
| N2 | 62,7 | 13,65 | 68 |
| Na | 370,7 | 22,85 | 172 |
| Ni | 1725,4 | 6,59 | 375 |
| O2 | 54,7 | 11,22 | 89 |
| Pb | 600,6 | 18,28 | 88 |
| Pt | 2024 | 8,66 | 229 |
| Si | 1724 | 11,37 | 660 |
| Ti | 2098 | 10,5 | 430 |
| W | 3653 | 9,83 | 370 |
| KBr | 1003 | 44,0 | 177 |
| Вещество | Т плавл,0К | Vсм3/моль | Характеристическая температура |
| KC1 | 1049 | 37,5 | 230 |
| NaC1 | 1073 | 27,0 | 281 |
| BaF2 | 1553 | 36,4 | 177 |
| CaF2 | 1633 | 24,5 | 474 |
| H2O | 273,15 | 1 | 192 |
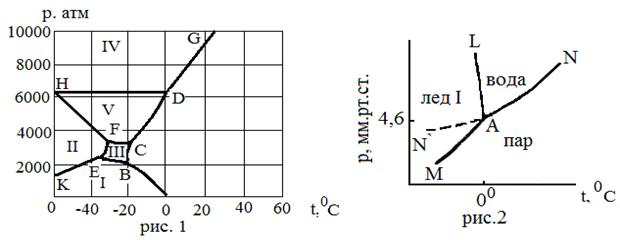
Фазовые диаграммы
| Вещество | Система | № рисунка | Температура,0С | Давление, атм | |
| Однокомпонентные системы | |||||
| Вода | Жидкость-пар-ледI | 1 и 2 (точка А) | 0,0076 | 6,02 ·10-3 | |
| Жидкость-лед I-ледIII | 1 (точка В) | -22,0 | 2030 | ||
| ЛедI-ледII -ледIII | 1 (точка Е) | -34,7 | 2100 | ||
| Жидкость-ледIII-ледV | 1 (точка С) | -17,0 | 3420 | ||
| ЛедII-ледIII-ледV | 1 (точка F) | -24,3 | 3400 | ||
| Жидкость-лед V-ледVI | 1 (точка D) | 0,.16 | 6180 | ||
| Сера | Sромб - Sмонокл -Sпар | 3 (точка О) | 95,5 | - | |
| Sмонокл - Sжидк -Sпар | 3 (точка В) | 120 | - | ||
| Sромб - Sмонокл -Sжидк | 3 (точка С) | 151 | 1288 | ||
| Sромб - Sжидк -Sпар | 3 (точка b*) | 114 | - | ||
| Углерод | Сграфит-- Сжидк - Сгаз | 4 (точка А) | 3730 | 105 | |

| Тип системы | № рисунка | Вещество | Т плав., 0С | Ткип.,0С |
| Двухкомпонентные системы | ||||
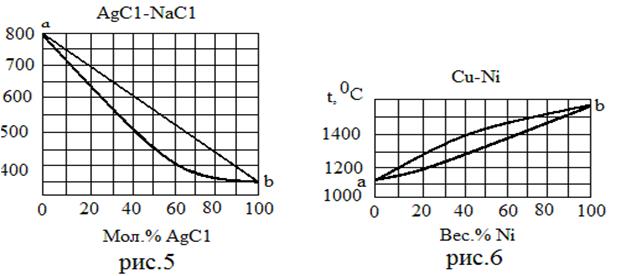
| Вещества, неограниченно растворимые в обеих фазах | 5 | AgC1 NaC1 | 455 800 | - - |
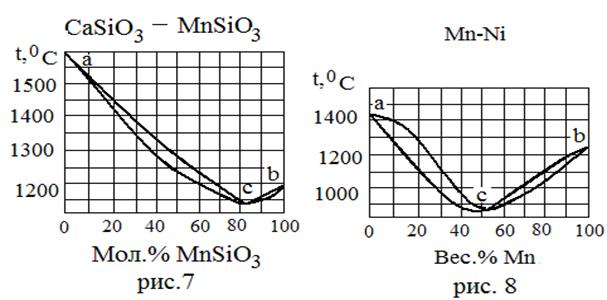
| 6 | Cu Ni | 1083 1452 | - - | |
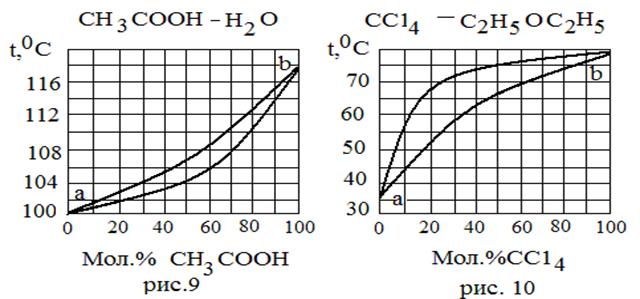
| 7 | CaSiO3 MnSiO3 | 1512 1218 | ||
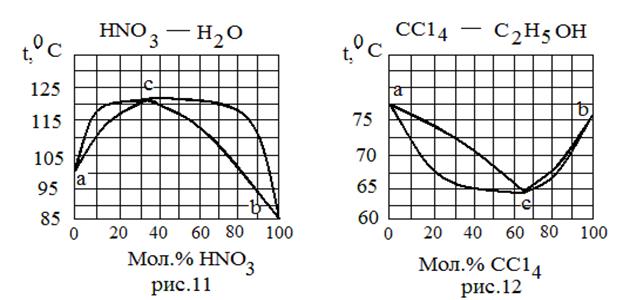
| 8 | Mn Ni | 1260 1452 | - - | |
| 9 | CH3COOH H2O | - - | 118,1 100 | |
| 10 | CC14 C2H5OC2H5 | - - | 77,7 34,75 | |
| 11 | HNO3 H2O | - - | 86 100 | |
| 12 | CC14 C2H5OH | - - | 75,9 77,9 | |
| 13 | C5H4O2 H2O | - - | 161,7 100 | |

| Тип системы | № рисунка | Вещество | Т плав., 0С | Ткип.,0С |
| Двухкомпонентные системы | ||||
| Вещества, неограниченно растворимые в жидкой фазе и взаимно нерастворимые в твердой фазе. Химические соединения не образуются. | 14 | AgC1 KC1 | 455 776 | - - |
| 15 | A1 Si | 660 1412 | - - | |
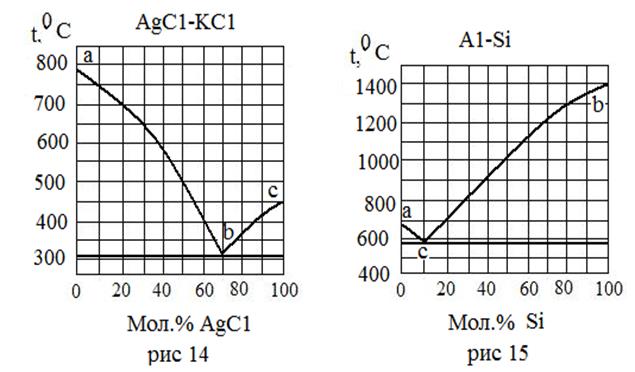
| Тип системы | № рисунка | Вещество | Т плав., 0С | Ткип.,0С |
| Двухкомпонентные системы | ||||
| Вещества, неограниченно растворимые в жидкой фазе и взаимно нерастворимые в твердой фазе. Образуются устойчивые химические соединения. | 16 | HNO3 H2O | -41,2 0 | - - |
| 17 | A1 Mg | 660 651 | - - | |
| 18 | CaC12 CsC1 | 772 642 | - - | |
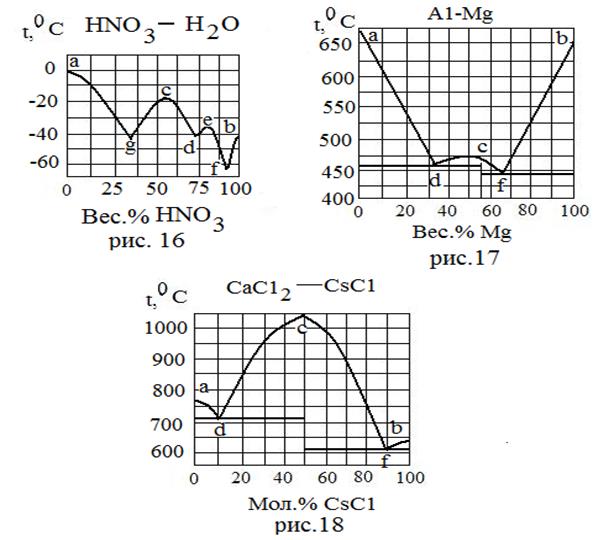
| Тип системы | № рисунка | Вещество | Т плав., 0С | Ткип.,0С |
| Двухкомпонентные системы | ||||
| Вещества, неограниченно растворимые в жидкой фазе и взаимно нерастворимые в твердой фазе. Образуются неустойчивые химические соединения. | 19 | CuC1 KC1 | 422 776 | - - |
| 20 | Au Sb | 1063 631 | - - | |
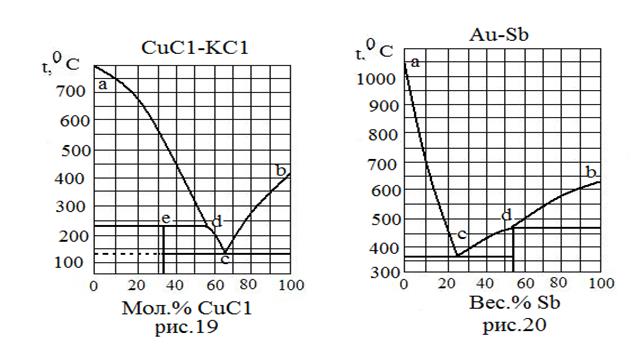
| Тип системы | № рисунка | Вещество | Т плав., 0С | Ткип.,0С |
| Двухкомпонентные системы | ||||
| Вещества, неограниченно растворимые в жидкой фазе и ограниченно растворимые в твердой фазе. Химические соединения не образуются. | 21 | KNO3 NaNO3 | 339 308 | - - |
| 22 | Bi Pb | 268 327 | - - | |
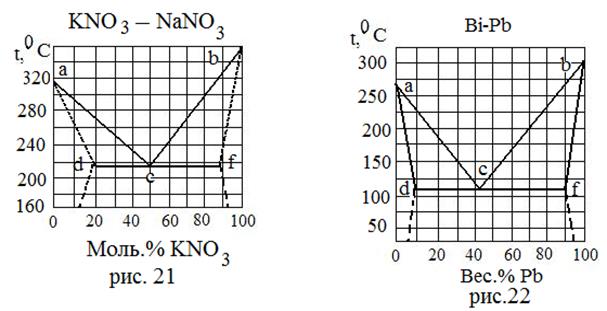
| Тип системы | № рисунка | Вещество | Т плав., 0С | Ткип.,0С |
| Двухкомпонентные системы | ||||
| Вещества ограниченно растворимые в обеих фазах. | 23 | A1 Pb | 600 327 | - - |
| 24 | C6H5NH2 H2O | - - | - - | |
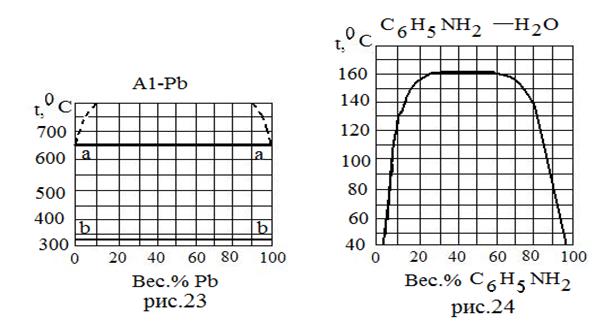
| Тип системы | № рисунка | Вещество | Т пл., 0С | Ткип0С |
| Трехкомпонентные системы | ||||
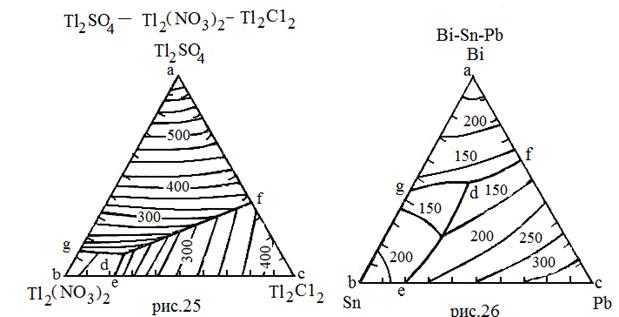
| Вещества, неограниченно растворимые в жидкой фазе и взаимно нерастворимые в твердой фазе. Химические соединения не образуются | 25 | Tl2SO4 Tl2C12 Tl2(NO3)2 | 632 426 206 | - - - |
| 26 | Sn Pb Bi | 232 327 268 | - - - | |
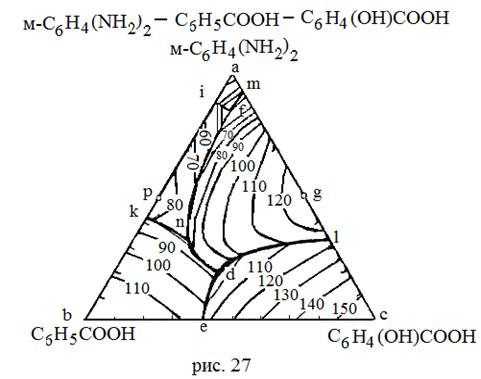
| Вещества, неограниченно растворимые в жидкой фазе и взаимно нерастворимые в твердой фазе. Образуются устойчивые химические соединения | 27 | м-С6Н4(NH2)2 C6H5COOH C6H4(OH)COOH | 63 121,4 159 | - - - |
ИНДИКАТОРЫ
Кислотно-основные индикаторы
В титриметрическом методе анализа для определения конца титрования (точки эквивалентности) применяют индикаторы.
В методе кислотно-основного взаимодействия с этой целью используют такие вещества, окраска которых меняется в кислой и щелочной среде. Их называют кислотно-основные индикаторы или рН-индикаторы.
Кислотно-основные индикаторы представляют собой слабые органические кислоты или основания, протонированные и непротанированные формы которых различаются по структуре и окраске. Существуют одноцветные (например, фенолфталеин) и двуцветные (например, метиловый оранжевый) индикаторы. Окраска каждого из индикаторов изменяется в пределах определенного узкого интервала значений рН, его называют интервале значений рН, его называют интервале перехода окраски индикатора. Для двуцветных индикаторов он рассчитывается по формуле:
∆рН=рКи±1,
где Ки – константа диссоциации индикатора.
В пределах интервала перехода наиболее резко изменение индикатора наблюдается при определенном значении рН, которое называется показателем титрования и обозначается рТ. Величина рТ находится приблизительно в середине интервала перехода и фактически отождествляется м рКи.
Выбирают индикатор для титрования так, чтобы интервал перехода окраски индикатора (или рТ) ближе всего совпадал бы с рН титруемого раствора в точке эквивалентности. Поэтому для правильного выбора индикатора необходимо проследить характер кривой титрования, величину скачка титрования и установить рН, соотвествующее точке эквивалентности.
Для сужения интервала перехода и получения более резкого перехода окраски применяют смешанные индикаторы, которые составляют из индикатора и красителя. При определенном значении рН цвет красителя является дополнительным к цвету индикатора. В результате в этой точке окраска будет серой, а переход от окрашенного раствора к серому – контрастным.
Так как в кислотно-основных титрованиях обычно в качестве титранта применяют либо сильную кислоту, либо сильное основание, при выборе индикатора для титрования кислот и оснований можно пользоваться следующими общими указаниями:
1. При титровании сильных кислот и оснований (~0,1 н.) можно применять любой индикатор с рН интервала перехода в пределах 4,3 – 9,7 (от метилового оранжевого до фенолфталеина). При титровании более концентрированных растворов, чем 0,1 н., можно применять любой индикатор с рН интервала перехода 3,3 – 10,7.
2. При титровании слабой кислоты сильным основанием конец титрования наблюдается в интервалах рН=7,74 – 10. В этих случаях можно использовать, например, индикаторы: феноловый красный, тимоловый голубой, фенолфталеин, тимолфталеин.
3. При титровании слабого основания сильной кислотой конец титрования наблюдается в интервале рН=6,26-4. В этих случаях применяют, например, индикаторы: п-нитрофенол, метиловый красный, метиловый оранжевый.
4. При титровании многоосновных кислот или многокислотных оснований нужно рассчитать значения рН для каждой точки эквивалентности и подобрать соответствующие индикаторы. Например, при титровании фосфорной кислоты первая точка эквивалентности соответствует рН=4,33; вторая – 9,57; третья – 12,72. Следовательно, для титрования до NaH2PO4 нужно применять метиловый оранжевый, до Na2HPO4 – фенолфталеин, до Na3PO4 – тимоловый голубой.
Наиболее широко применяемые в кислотно-основном титровании индикаторы и интервалы их перехода представлены далее.
Дата добавления: 2018-11-24; просмотров: 368; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!