Критерии индивидуальности и нативности полисахарида.
При выборе оптимальных условий для выделения полисахарида необходимо учитывать лабильность макромолекул, содержащих гликозидные связи фураноз, 3,6- андигрогексоз и др., в кислых средах, содержащих сложно – эфирные группировки, гликозиды β- окси-α-аминокислот, восстанавливающие концевые моносахариды с заместителем в положении С3 и др. в щелочных средах. В щелочной среде может также происходить деструкция макроцепи вследствие окисления кислородом воздуха. Расщепление химических связей возможно и при некоторых методах очистки, связанных с превращением полисахаридов в их производные.
Реальную опасность при выделении полисахаридов представляет деструкция под действием ферментов. Ферменты, содержащиеся в источнике, из которого выделяют полисахарид, обычно инактивируют нагреванием, кипячением с метанолом, замораживанием и т.д. Растворы полисахаридов могут служить средой для роста микроорганизмов, попадающих туда из воздуха лаборатории. Для превращения расщепления полисахаридов ферментами микроорганизмов к растворам прибавляют толуол, тимол или хранят их при низкой температуре.
Современные методы установления строения полисахаридов применимы лишь к индивидуальным веществам. Работа с неочищенными полисахаридными препаратоми может привести к выводам о строении, весьма далеким от истины.
Технологическая схема очистки среднемолекулярной фракции декстрана
Описание условий проведения процесса
Химическая очистка СМФ декстрана
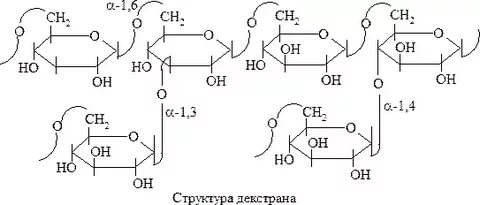
Плазмозаменители из декстранов выпускают под различными названиями: клинический декстран, полиглюкин, синкол, макродекс, плаз-модекс, хемодекс и др. Для получения декстранов используют штаммы Leuconostoc mesenteroides. Ферментацию ведут на среде с 10 — 30 % сахарозы, декстраном-затравкой, дрожжевым экстрактом, минеральными солями. Создают условия, способствующие синтезу той формы декстрана, которая используется в качестве плазмозамеиителя: линейного глюкана, имеющего более 90 % а-1,6-связей, с молекулярной массой 60 — 80 кДа. Для этого ограничивают содержание в среде магния,
Наивысшей биологической активностью отмечаются декстраны, содержащие менее 70 % а -1,6-гликозидных связей, т. е. более разветвленные. Их синтезу способствует кроме магния замена сахарозы мелассой. Оптимальное значение рН для роста продуцента находится в пределах 6,5 — 8,0, а для накопления декстрансахаразы — около 7,0. Для среды оно обычно задается в интервале 7,0 — 8,0.
Бактерии расщепляют сахарозу на глюкозу и фруктозу. Последняя сбраживается по типу гетероферментативного молочно-кислого брожения с образованием молочной и уксусной кислот, маннита и С02. Глюкоза полимеризуется в декстран. Процесс идет быстро, и продукт можно получить уже через 24 ч.
Декстран выделяют из культуральной жидкости, например, метанолом. Можно, используя определенные приемы, осаждать фракции клинического декстрана с молекулярной массой 60 — 80 кДа даже из смеси этих полисахаридов разной молекулярной массы. Возможно осадить весь продукт, растворить его в воде и изолировать требуемый декстран фракционированием. При необходимости его деполимеризуют (ферментативно, термической обработкой или ультразвуком), а для очистки неоднократно растворяют в воде, переосаждают метанолом и фракционируют.
Полиглюкин
Полиглюкин представляет собой 6% раствор декстрана с молекулярной массой 60000 Д. Полиглюкин не проникает через мембраны сосудов (из-за значительной величины молекул углевода), поэтому долго удерживается в сосудистом русле (3-4 суток).
Лечебное действие полиглюкина заключается в способности восстанавливать и поддерживать АД, ОЦК, улучшать сердечную деятельность. Препарат можно вводить внутривенно, внутриартериально, внутрикостно.
Современные препараты декстрана заметно отличаются от инфузионных сред, которые применялись в практике в 60-70-е годы прошлого века. Главное отличие заключается в высокой очистке от иммуногенных ингредиентов микробного происхождения, что позволило снизить общее число побочных реакций на декстран ниже уровня реакций на альбумин.
Повышенная вязкость среды делает невозможным отделение полисахарида от клеток продуцента из нативной культуральной жидкости. Поэтому при крупномасштабном производстве не производят удаления продуцента из культуральной жидкости, а пастеризуют ее нагреванием.
Продукт извлекают из культуральной жидкости относительно мягким и простым способом – осаждением органическим растворителем (спиртом). Таким образом уменьшается вероятность разрушения или модификации полимера.
Однако нативный декстран не пригоден для использования в качестве плазмозамещающего средства, так как имеет очень большую М.м. (достигающую сотен миллионов дальтон), значительную вязкость, обладает токсическим действием и изменяет иммунореактивные свойства организма. Высокомолекулярные декстраны (более 150 тыс.) могут привести к аггрегации крови. В тоже время препараты с М.м. от 40 тыс. и ниже не увеличивают скорость агглюцинации. Поэтому с целью снижения М.м. декстран подвергается частичному гидролизу. Можно при необходимости деполимеризовать выделенный декстран ферментативно, термической обработкой или ультразвуком. Из полученной смеси выделяют среднемолекулярную фракцию, очищают и на ее основе изготавливают лекарственную форму с заданным молекулярно-массовым распределением. По этому критерию плазмозамещающие средства на основе декстрана делят на две основные группы:
– низкомолекулярные декстраны (М.м. 30000-40000);
– среднемолекулярные декстраны (М.м. 50000-70000).
Осаждать фракции клинического декстрана с нужной М.м. из смеси декстранов можно, используя определенные приемы. Так, например, более высокие концентрации спирта позволяют осаждать из раствора декстраны с меньшей М.м., декстраны же с большей степенью полимеризации осаждаются, напротив, при меньших концентрациях спирта.
Для очистки декстран неоднократно растворяют в воде, переосаждают спиртом и фракционируют. Для удаления нежелательных примесей используют также многократную обработку раствора активированным углем. При этом варьируют уровень рН, что способствует изменению растворимости различных присутствующих в растворе веществ.
Химическая очистка декстрана состоит из следующих стадий:
1. стерилизация раствора декстрана с углем;
2. фильтрация и первая деминерализация раствора декстрана на ионообменных смолах КУ-2 и ЭДЭ-10п;
3. вторая стерилизация раствора декстрана с углем и NaCl;
4. фильтрация и вторая деминерализация декстрана на ионообменной смоле КУ-2 в Na – форме;
5. корректировка раствора декстрана и передача его на стерильную фильтрацию.
I стадия
Первую стерилизацию раствора декстрана с углем осуществляют при температуре 120°С в течение 20-ти минут, концентрация декстрана в растворе во время стерилизации 7,5-8,8%; pH раствора 6,8 – 7,3. Уголь загружают в количестве 3-4 г/л. По окончании стерилизации раствор охлаждают до 20-25°С.
II стадия
Фильтрацию раствора после первой стерилизации с углем осуществляют на свечевых фильтрах или фильтрах с пластинами СФ. Избыточное давление в аппаратах поддерживают 1,2-1,7 атм. Раствор после фильтров должен быть прозрачным. Температура раствора должна быть 20-25°С.
Осветленный раствор после фильтров последовательно подают на ионообменную колонку с катионитом КУ-2 в H-форме, где раствор декстрана освобождается от ионов Fe3+, Ca2+ и других катионов, и на ионообменную колонку с анионитом ЭДЭ-10п, где раствор освобождается от фосфатов и других анионов.
pH раствора после колонки со смолой КУ-2 должен быть 2,0-3,5, а после колонки со смолой ЭДЭ-10п 5,0-7,0.
После диминирализации раствор должен иметь следующие параметры:
- рефракция 1,3435-1,3450;
- pH 5,0-7,0;
- ионы Ca2+ , PO43- - отсутствуют;
Ионы Fe3+ - не более 0,00002.
III стадия
Вторую стерилизацию раствора декстрана с углем и хлористым натрием осуществляют при температуре 120°С в течение 20-ти минут при pH в растворе 6,8-7,3
концентрация декстрана в растворе 6,2-7,5%;
NaCl – 0,9-1,1%;
pH 6,8-7,3;
уголь 3-4 г/л.
IV стадия
Фильтрацию раствора после второй стерилизации с углем и NaCl осуществляют на свечевых фильтрах. Избыточное давление на фильтрах 0,7-1,5 атм. Температура раствора 20-25°С. Раствор после фильтрации должен быть прозрачным.
Осветленный раствор после фильтров подают на ионообменную колонку со смолой КУ в Na - форме, где раствор декстрана освобождается от ионов Fe3+, Ca2+.
V стадия
Корректировку pH раствора декстрана производят 0,1 N раствором х.ч. едкого натра или х.ч. соляной кислоты.
В момент передачи на стерильную фильтрацию раствор декстрана должен иметь следующие показатели:
концентрация декстрана 5,7-6,5;
содержание NaCl 0,87-1,0;
pH 6,2-7,0;
ионы PO43- и Ca2+ отсутствуют;
ионы Fe3+ не более 0,0001%;
раствор бесцветный.
Дата добавления: 2018-11-24; просмотров: 545; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
