Карбонильные соединения (альдегиды и кетоны)
Примеры заданий
Базовый уровень сложности
1. Состав предельных альдегидов выражается общей формулой
| 1) | CnH2n+2О | 2) | CnH2nО2 | 3) | CnH2nО | 4) | CnH2n-6О |
2. К карбонильным соединениям не относится
| 1) | этаналь | 2) | ацетон | 3) | бутанол | 4) | бутанон |
3. В молекуле пропаналя атомы углерода находятся в состоянии гибридизации
| 1) | только sp3 | 2) | только sp2 | 3) | sp3 и sp2 | 4) | sp3 и sp |
4. Число π-связей в молекуле пропаналя равно
| 1) | 1 | 2) | 2 | 3) | 3 | 4) | 4 |
5. Альдегиды изомерны
| 1) | предельным одноатомным спиртам |
| 2) | фенолам |
| 3) | предельным одноосновным карбоновым кислотам |
| 4) | кетонам |
6. Этаналь и ацетальдегид являются
| 1) | геометрическими изомерами | 3) | гомологами |
| 2) | межклассовыми изомерами | 4) | одним и тем же веществом |
7. При гидрировании альдегидов образуются
| 1) | первичные спирты | 3) | третичные спирты |
| 2) | вторичные спирты | 4) | карбоновые кислоты |
8. Продуктом восстановления кетонов являются
| 1) | карбоновые кислоты | 3) | вторичные спирты |
| 2) | первичные спирты | 4) | третичные спирты |
9. При восстановлении пропанона образуется
| 1) | пропанол-1 | 3) | пропановая кислота |
| 2) | пропанол-2 | 4) | пропаналь |
10. В реакции, схема которой
HCОН + X→ HCOOH + Cu2O + Н2О,
веществом Х может быть
| 1) | CuSO4 | 2) | CuO | 3) | Cu | 4) | Cu(OH)2 |
11. Реакция «серебряного зеркала» характерна для
| 1) | одноатомных спиртов | 3) | кетонов |
| 2) | многоатомных спиртов | 4) | альдегидов |
12. С аммиачным раствором оксида серебра взаимодействует каждое из двух веществ
| 1) | пропен и пропаналь | 3) | бутин-2 и пропанон |
| 2) | бутин-2 и бутаналь | 4) | бутин-1 и формальдегид |
13. С гидроксидом меди(II) взаимодействует каждое из двух веществ
| 1) | глицерин и бутанон | 3) | этиленгиколь и этаналь |
| 2) | бутанол-1 и бутаналь | 4) | пропин и пропаналь |
14. И бутаналь, и бутанол-1 реагируют с
| 1) | Н2 | 2) | Cu(OH)2 | 3) | КОН | 4) | О2 |
15. И пропаналь, и пропанон реагируют с
| 1) | [Ag(NH3)2]OH | 2) | Н2 | 3) | Cu(OH)2 | 4) | С2Н6 |
16. С каждым из трех веществ:
Н2, [Ag(NH3)2]OH, Cu(OH)2 –
может реагировать
| 1) | изобутан | 2) | бутанол-1 | 3) | бутаналь | 4) | бутин-1 |
17. Для непредельного альдегида акролеина, формула которого
СН2=СН-СОН,
справедливо утверждение
| 1) | атомы углерода в молекуле находятся в sp3- и sp2-гибридном состоянии |
| 2) | вступает в реакцию полимеризации |
| 3) | продуктом гидрирования является пропанол-2 |
| 4) | наиболее характерны реакции замещения |
18. Пропаналь можно отличить от пропанола-1 с помощью
| 1) | HCl | 2) | NaOH | 3) | Cu(OH)2 | 4) | Br2(водн.) |
19. Метанол окисляется до формальдегида под действием
| 1) | водорода | 3) | хлорида железа(II) |
| 2) | оксида меди(II) | 4) | натрия |
20. Пропаналь можно получить в результате реакции
| 1) | гидрирования пропина | 3) | окисления пропанола-1 |
| 2) | гидратации пропина | 4) | окисления пропанона |
21. Ацетон можно получить в результате реакции
| 1) | гидрирования ацетилена | 3) | окисления пропанола-1 |
| 2) | гидратации ацетилена | 4) | гидратации пропина |
22. Какие из приведенных утверждений об альдегидах и кетонах верны?
А. Температуры кипения и плавления альдегидов и кетонов выше, чем у спиртов с тем же числом атомов углерода в молекуле.
Б. При гидрировании альдегидов и кетонов образуются карбоновые кислоты.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
23. Какие из приведенных утверждений об альдегидах и кетонах верны?
А. Атом углерода в карбонильной группе находится в sp2-гибридном состоянии.
Б. При окислении альдегидов и кетонов образуются спирты.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
24. Какие из приведенных утверждений об альдегидах и их свойствах верны?
А. Альдегиды способны вступать в реакции восстановления и окисления.
Б. Формальдегид и ацетальдегид токсичны.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
25. Какие из приведенных утверждений о метанале и его свойствах верны?
А. Метаналь способен вступать в реакцию полимеризации.
Б. 40%-ный водный раствор метаналя называется формалином.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
26. В схеме превращений
C2H2 → X → CH3COOH
веществом Х может быть
| 1) | этен | 2) | хлорэтан | 3) | этанол | 4) | этаналь |
27. В схеме превращений
CH2=CH─CH3 → X → CH3COCH3
веществом Х может быть
| 1) | CH2Сl─CH2─CH3 | 3) | CH2OH─CH2─CH3 |
| 2) | CH3─CHСl─CH3 | 4) | CH3─CHOH─CH3 |
28. В схеме превращений
C2H2 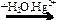 X1
X1 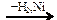 Х2
Х2
веществами Х1 и Х2 соответственно являются
| 1) | C2H5OH и СН3СОН | 3) | СН3СОН и С2Н4 |
| 2) | СН3СООН и СН3СОН | 4) | СН3СОН и C2H5OH |
Повышенный уровень сложности
29. Установите соответствие между тривиальным названием органического вещества и его формулой
| ТРИВИАЛЬНОЕ НАЗВАНИЕ | ФОРМУЛА СПИРТА | ||||
| А) | муравьиный альдегид | 1) | CH3CН2ОН | ||
| Б) | уксусный альдегид | 2) | HCОН | ||
| В) | бензальдегид | 3) | CH3─CО─CH3 | ||
| Г) | ацетон | 4) | C6H5CОН | ||
|
| 5) | CH3CОН | |||
| А | Б | В | Г | ||
|
|
| ||||
30. В реакцию полимеризации способны вступать
| 1) | толуол | 4) | метаналь |
| 2) | стирол | 5) | бензол |
| 3) | фенол | 6) | хлорвинил |
31. С аммиачным раствором оксида серебра взаимодействуют
| 1) | бутин-1 | 4) | глицерин |
| 2) | бутанон | 5) | формальдегид |
| 3) | бутаналь | 6) | бутин-2 |
32. С гидроксидом меди(II) взаимодействуют
| 1) | пропанол-2 | 4) | пропен |
| 2) | бензальдегид | 5) | пропаналь |
| 3) | глицерин | 6) | пропанон |
33. Установите соответствие между схемой реакции и продуктом окисления органического вещества
| СХЕМА РЕАКЦИИ | ПРОДУКТЫ ОКИСЛЕНИЯ | ||||
| А) | CH3CОН + KMnO4 + H2O | 1) | муравьиная кислота | ||
| Б) | CH3CОН + KMnO4 + H2SO4 | 2) | СH2OH-СН2ОН | ||
| В) | CH3CОН + Сu(OН)2 | 3) | СH2OК-СН2ОК | ||
| Г) | CH3CH2ОН + CuО | 4) | CH3CОН | ||
|
| 5) | CH3COОН | |||
|
| 6) | CH3CООК | |||
| А | Б | В | Г | ||
|
|
| ||||
34. Формальдегид взаимодействует с
| 1) | Cu(OH)2 | 4) | С6Н6 |
| 2) | H2 | 5) | NaOH |
| 3) | K | 6) | С6Н5ОН |
35. И муравьиный, и прoпионовый альдегид могут взаимодействовать с
| 1) | гидроксидом кальция |
| 2) | хлоридом натрия |
| 3) | водородом |
| 4) | этаном |
| 5) | кислородом |
| 6) | аммиачным раствором оксида серебра |
36. Для метаналя справедливы утверждения
| 1) | при обычных условиях – жидкость с резким запахом |
| 2) | 40%-ный водный раствор называется формалином |
| 3) | окисляется с большим трудом |
| 4) | продуктом гидрирования является метановая кислота |
| 5) | вступает в реакцию поликонденсации с фенолом |
| 6) | является токсичным веществом |
37. Для ацетальдегида справедливы утверждения
| 1) | при обычных условиях – газ без запаха |
| 2) | между молекулами образуются водородные связи |
| 3) | является изомером ацетона |
| 4) | продуктом гидрирования является этанол |
| 5) | взаимодействует со спиртами |
| 6) | окисляется гидроксидом меди(II) до уксусной кислоты |
38. И для пропаналя, и для пропанона справедливы утверждения
| 1) | относятся к классу карбонильных соединений |
| 2) | состав выражается формулой С3Н6О |
| 3) | при обычных условиях являются жидкостями |
| 4) | могут быть получены по реакции Кучерова |
| 5) | вступают в реакцию «серебряного зеркала» |
| 6) | окисляются гидроксидом меди(II) до пропановой кислоты |
39. По реакции Кучерова с выходом 70% получили 61,6 г ацетальдегида. Объем (н.у.) ацетилена, вступившего в реакцию, равен _________ л. (Запишите число с точностью до десятых.)
40. Для восстановления пропаналя массой 29 г необходим водород, объем (н.у.) которого равен _________ л. (Запишите число с точностью до десятых.)
41. Масса этаналя, которая может полностью сгореть в кислороде объемом 5,6 л (н.у.), равна _________ г. (Запишите число с точностью до десятых.)
42. Объем углекислого газа (н.у.), который выделяется при полном сгорании пропаналя массой 5,8 г, равен _________ л. (Запишите число с точностью до сотых.)
43. Объем кислорода (н.у.), который необходим для полного сгорания пропаналя массой 2,9 г, равен _________ л. (Запишите число с точностью до сотых.)
44. Объем воздуха (н.у.), который необходим для полного сгорания метаналя массой 60 г, равен _________ л. (Запишите число с точностью до целых.)
45. В 150 г воды растворили 17,92 л (н.у.) метаналя. Массовая доля метаналя в полученном растворе равна _________ %. (Запишите число с точностью до десятых.)
46. Для получения формалина – 40%-ного водного раствора формальдегида – в 120 г воды надо растворить формальдегид, масса которого равна _________ л. (Запишите число с точностью до целых.)
Высокий уровень сложности
47. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al4C3 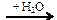 X1 → CH3Br → CH3OH → HCOH
X1 → CH3Br → CH3OH → HCOH  X2
X2
Укажите условия протекания реакций.
48. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C2H5Br 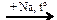 X1
X1 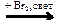 X2
X2 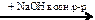 X3
X3 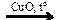 X4
X4  X5
X5
Укажите условия протекания реакций.
49. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
бензол → метилбензол  X1
X1 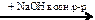 Х2
Х2  X3
X3 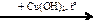 X4
X4
Укажите условия протекания первой реакции.
50. Смесь уксусного и пропионового альдегида массой 1,17 г полностью окислили до соответствующих кислот гидроксидом меди(II), который был получен в результате взаимодействия между 16%-ным раствором сульфата меди(II) массой 50 г и 10%-ным раствором гидроксида натрия массой 80 г. Определите массовые доли альдегидов в исходной смеси.
51. Уксусный альдегид массой 1,32 г обработали 5-%-ным раствором бихромата калия в сернокислотной среде массой 117,6 г. Определите массовую долю бихромата калия в растворе после окончания реакции.
52. Массовая доля углерода в предельном альдегиде равна 62,07%. Установите молекулярную формулу альдегида.
53. Массовая доля кислорода в предельном альдегиде равна 27,59%. Установите молекулярную формулу альдегида.
54. Установите молекулярную формулу предельного альдегида, массовая доля углерода в котором в 3,75 раза больше массовой доли кислорода.
55. Для окисления предельного альдегида массой 2,9 г до соответствующей кислоты потребовалось 9,8 г гидроксида меди(II). Определите молекулярную формулу альдегида.
56. При окислении 2,88 г предельного альдегида избытком аммиачного раствора оксида серебра выделилось 8,64 г серебра. Установите молекулярную формулу альдегида.
57. При полном сгорании 4,3 г предельного альдегида выделилось 4,5 г воды. Установите молекулярную формулу альдегида.
58. При сгорании органического вещества массой 6,6 г получили 6,72 л углекислого газа (н.у.) и 5,4 г воды. Плотность паров вещества по кислороду равна 1,375. Установите молекулярную формулу вещества.
Вариант 1
1. Число σ-связей в молекуле муравьиного альдегида равно
| 1) | 1 | 2) | 2 | 3) | 3 | 4) | 4 |
2. При восстановлении этаналя образуется
| 1) | этановая кислота | 3) | этанол |
| 2) | этиленгликоль | 4) | диэтиловый эфир |
3. Уксусный альдегид взаимодействует с
| 1) | NaOH | 2) | Cu(OH)2 | 3) | C6H6 | 4) | SiO2 |
4. Для обнаружения альдегидов можно использовать каждое из двух веществ
| 1) | CuO и FeCl3 | 3) | Br2(водн.) и Cu(OH)2 |
| 2) | H2SO4 и NaOH | 4) | Cu(OH)2 и [Ag(NH3)2]OH |
5. Фенолформальдегидную смолу получают по реакции
| 1) | полимеризации | 3) | гидролиза |
| 2) | поликонденсации | 4) | гидратации |
6. Какие из приведенных утверждений об альдегидах и их свойствах верны?
А. Между молекулами альдегидов водородные связи практически не образуются.
Б. Низшие альдегиды вступают в реакцию полимеризации.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
7.В схеме превращений
C2H5ОН  X1
X1 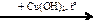 X2
X2
веществами Х1 и Х2 соответственно могут быть
| 1) | СН3СОН и (СН3СОО)2Сu | 3) | СН3СОН и CH3COOH |
| 2) | CH2OH-CH2OH и CH3COOH | 4) | CH3COOH и CH3COOС2Н5 |
8. Только в состоянии sp3-гибридизации атомы углерода находятся в молекулах
| 1) | пропанола-2 | 4) | пропана |
| 2) | пропаналя | 5) | циклогексана |
| 3) | фенола | 6) | пропанона |
9. Пропаналь взаимодействует с
| 1) | O2 | 4) | KMnO4 |
| 2) | [Ag(NH3)2]OH | 5) | CH3OCH3 |
| 3) | КСl | 6) | N2 |
10. При взаимодействии уксусного альдегида с избытком аммиачного раствора оксида серебра выпал осадок массой 2,16 г. Масса уксусного альдегида, вступившего в реакцию, равна _________ г. (Запишите число с точностью до сотых.)
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Х1 → С2Н2 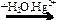 X2
X2 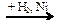 Х3
Х3  X2
X2 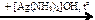 X4
X4
12. Бутаналь массой 28,8 г частично окислили в бутановую кислоту. Для нейтрализации полученной кислоты затратили 46,2 мл 24%-ного раствора гидроксида натрия (плотность 1,263 г/мл). Определите массу бутаналя, не подвергшегося окислению.
13. При окислении предельного альдегида массой 11,6 г гидроксидом меди(II) получили 14,8 г кислоты Установите молекулярную формулу альдегида.
Вариант 2
1. Число π-связей в молекуле муравьиного альдегида равно
| 1) | 1 | 2) | 2 | 3) | 3 | 4) | 4 |
2. При окислении бутаналя образуется
| 1) | масляная кислота | 3) | бутанол-1 |
| 2) | бутанон | 4) | бутанол-2 |
3. Метаналь взаимодействует с
| 1) | Na2SO4 | 2) | KCl | 3) | C6H5ОН | 4) | C3H8 |
4. Какие из приведенных утверждений об альдегидах и кетонах верны?
А. Альдегиды и кетоны – структурные изомеры одного класса.
Б. Качественной реакцией на альдегиды и кетоны является реакция «серебряного зеркала».
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
5. Пропаналь в отличие от пропанона взаимодействует с
| 1) | Н2 | 2) | O2 | 3) | [Ag(NH3)2]OH | 4) | CuSO4 |
6. Какие из приведенных утверждений о формальдегиде и его свойствах верны?
А. Формальдегид – газ с резким запахом.
Б. Формальдегид вступает в реакцию поликонденсации с фенолом.
| 1) | верно только А |
| 2) | верно только Б |
| 3) | верны оба утверждения |
| 4) | оба утверждения неверны |
7. В схеме превращений
СН3СОН 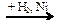 X1
X1  X2
X2
веществами Х1 и Х2 соответственно могут быть
| 1) | СН3СН2OH и C2H4 | 3) | СН3СОOН и CO2 |
| 2) | СН3СН2OH и CH3CH2-O-CH2CH3 | 4) | CH3COOH и CH3COOСН3 |
8. В состоянии sp3- и sp2-гибридизации атомы углерода находятся в молекулах
| 1) | бутаналя | 4) | пропина |
| 2) | толуола | 5) | метаналя |
| 3) | фенола | 6) | бутанона |
9. Ацетальдегид взаимодействует с
| 1) | Cu | 4) | С6Н5CH3 |
| 2) | C2H5OH | 5) | CaO |
| 3) | HCN | 6) | K2Cr2O7 |
10. При взаимодействии уксусного альдегида массой 1,32 г с избытком аммиачного раствора оксида серебра выпал осадок, масса которого равна _________ г. (Запишите число с точностью до сотых.)
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
СН3СН2СН2СООNa → С3Н8 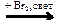 X1
X1 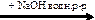 Х2
Х2 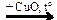 X3 → CO2
X3 → CO2
Укажите условия протекания реакций.
12. К 20 г водного раствора формальдегида добавили избыток аммиачного раствора оксида серебра и смесь слегка нагрели. Серебро, выделившееся в результате реакции, полностью растворили в концентрированной азотной кислоте, при этом выделилось 17,92 л (н.у.) газа. Определите массовую долю формальдегида в исходном растворе.
13. Для восстановления предельного альдегида массой 9,0 г до спирта необходимо затратить 6,72 л (н.у.) водорода. Установите молекулярную формулу альдегида.
Дата добавления: 2018-11-24; просмотров: 11203; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!