ЗАКОН ДЕЙСТВУЮЩИХ МАСС (ЗДМ).
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
nA + mB ®qC
 |
J = [A]n * [B]m *k
 |
[A] и [B] – концентрации веществ;
n и m – стехиометрические коэффициенты;
k – константа скорости химической реакции.
k = J, если [A] = [B] = 1моль/л
ЗДМ справедлив для газообразных веществ и жидких растворов.
 |
2. Температура.
ПРАВИЛО ВАНТ-ГОФФА.
При повышении температуры на каждые 10°С скорость реакции возрастает от 2 до 4 раз
t °2 – t °1
10
J t2 = J t1* g
g (2 – 4) раза на 10 °С.
Химическое равновесие
Таблица 5
 | |||
 |  | ||
ХИМИЧЕСКИЕ РЕАКЦИИ
 |  |
 Необратимые Обратимые
Необратимые Обратимые
до конца (до завершения) ®в двух взаимнопро-
(®), если образуется: тивоположных нап-

 а) осадок; равлениях ( )
а) осадок; равлениях ( )
б) газ;
в) слабый электролит.
Химическое равновесие – такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции (J1 = J2), а концентрации всех веществ в системе становятся постоянными.
|
|
|
|
(1)
 |
 J J1 пр.
J J1 пр.
J1 = J2
 |
J2 обр
 . t
. t
Константа равновесия (К.р.)
Гомогенная реакция Гетерогенная реакция




 2 NO(Г) +O2(Г) « 2NO2(Г) Ca CO3(ТВ) « CaO(ТВ) + CO2(Г)
2 NO(Г) +O2(Г) « 2NO2(Г) Ca CO3(ТВ) « CaO(ТВ) + CO2(Г)
1. J1 = J2 (ЗДМ) 1. J1 = J2 (ЗДМ)
2. J1 = [NO]2 *[O2]*k1 2. J1 = k1
3. J2 = [NO2]2 *k2 3. J2 = [СO2] *k2
4. [NO]2 *[O2] *k1 = [NO2]2 *k2 4. k1 = [СO2] *k2
5. т.к. k1 и k2 – const, то 5. т.к. k1 и k2 – const, то
 6. k1 [NO2]2 6. k1 [СO2]
6. k1 [NO2]2 6. k1 [СO2]


 k2 [NO]2 *[O2] k2 1
k2 [NO]2 *[O2] k2 1


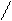
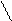

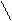
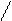
 k1 k1
k1 k1

 k2 Р
k2 Р  k2 р
k2 р



 7. [NO2]2 7. КР = [CO2]
7. [NO2]2 7. КР = [CO2]
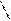 Р [NO]2 *[O2]
Р [NO]2 *[O2]
 |  | ||||
 | |||||


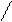 [ C ] q *[ D ] p для химической реакции (1)
[ C ] q *[ D ] p для химической реакции (1)

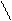 Р [A]n *[B]
Р [A]n *[B]
 | |||
 | |||
|
|
|
Смещение химического равновесия.


 Таблица 6
Таблица 6
Принцип Ле Шателье: если изменить одно из условий (С,р,Т), при которых система находилась в состоянии равновесия, то, равновесие смещается в сторону той реакции, которая противодействует произведённому изменению.
1. Влияние концентрации:
3 H2 + N2 « 2 NH3 3 H2 + N2 « 2 NH3

 [H2] [H2]¯
[H2] [H2]¯

 [N2] [N2] ¯
[N2] [N2] ¯

 [NH3] [NH3] ¯
[NH3] [NH3] ¯
2. Влияние давления:
 3 H2 + N2 « 2 NH3
3 H2 + N2 « 2 NH3
3 +1 = 4 моль 2 моль
р р¯
 р
р
 р¯
р¯
3. Влияние температуры:
3 H2 + N2 « 2 NH3 (- D Н х.р.) Þ экзотермическая реакция
t°¯ t°
 t°
t°
 t°¯
t°¯
C исходная = С равновесная + С израсходованная к моменту равновесия
С равновесная = С исходная – С израсходованная к моменту равновесия
 |
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ:
«ХИМИЧЕСКАЯ КИНЕТИКА»
Задача № 1.
Равновесие гомогенной системы: 2 NO + O2 « 2 NO2, - установилось при следующих концентрациях веществ:
[NO]p. = 0,8 моль/л., [O2]p.= 0,6 моль/л, [NO2]p. = 0,4 моль/л Вычислите исходные концентрации NO и O2.
|
|
|
 Дано: 2 NO + O2 « 2 NO2
Дано: 2 NO + O2 « 2 NO2
[NO]p. = 0,8 моль/л, Решение:
[O2]p.= 0,6 моль/л, 1. Cисх. = С равн. + С израсх к моменту равновесия
[ NO2] p. = 0,4 моль/л 2. Определим сколько моль NO и О2 израсхо-
[NO]исх. = ? довано к моменту равновесия.
[O2]исх = ?
Согласно уравнению реакции:
2 моль NO вступает в химическую реакцию и образуется 2 моль NO2
X моль NO - 0,4 моль NO2
[NO] израсх. = 2 *0,4/2 = 0,4 моль
1 моль O2 вступает в химическую реакцию и образуется 2 моль NO2
Х моль О2 – 0,4 моль NO2
[O2] израсх. = 0,4/2 =0,2 моль
3. [NO] исх. = 0,8 +0,4 =1,2 моль/л
[O2] исх. = 0,6 + 0,2 = 0,8 моль/л
Ответ: [ NO]исх. = 1,2 моль/л, [ O2] исх. = 0,8 моль/л
ТЕМА 6. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Раствор – это гомогенная термодинамически устойчивая во времени система, состоящая минимум из двух компонентов и продуктов их взаимодействия.
Любой раствор состоит из двух веществ – растворителя и растворённого вещества, причём растворителя в растворе всегда содержится в большем количестве, чем растворённого вещества.
1. МАССОВАЯ ДОЛЯ РАСТВОРЁННОГО ВЕЩЕСТВА
Массовая доля растворённого вещества (ωр.в., %) показывает сколько граммов растворённого вещества содержится в 100 граммах раствора.
|
|
|



ω % (р.в.) = m (р.в.) *100 % ,
m (р – ра) (1)
 где m (р – ра) = m (р.в.) + m (р – ля)
где m (р – ра) = m (р.в.) + m (р – ля)
Между массой раствора, объёмом и плотностью существует соотношение, т.к.
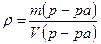 (г/ см3 ) или (г/мл ), то т(р – ра) = ρ* V,
(г/ см3 ) или (г/мл ), то т(р – ра) = ρ* V,
|
а) приготовление растворов с заданной массовой долей растворённого вещества ω3 смешением двух растворов: с большей ω1 и меньшей ω2 массовой долей того же самого вещества.
При этом требуется найти массу более концентрированного (m1) и менее концентрированного (m2) растворов. Используется «правило креста», суть которого отражает схема:
 ω1 m1 = ω3 – ω2
ω1 m1 = ω3 – ω2
ω3

 ω2 m2 = ω1 – ω3
ω2 m2 = ω1 – ω3
Пусть, например, требуется приготовить раствор с массовой долей 10% массой 70 г из 5 % и 40 %.
Подставим эти числа в приведённую ниже схему. Получаем:
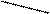
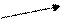 40 m1 = 10 – 5 = 5
40 m1 = 10 – 5 = 5
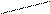
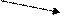 10
10
5 m2 = 40 – 10 = 30
Откуда 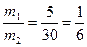
Например, взяв 10 г раствора ω = 40% и 60 г раствора с ω = 5%, получим 70г. раствора с ω = 10%.
б) приготовление растворов путём разбавления концентрированных растворов.
Так как при разбавлении растворов масса (р.в.) неизменна (m*ω) = const, то существует обратно пропорциональная зависимость между отношением масс растворов и их массовыми долями
|
2. МОЛЯРНАЯ КОНЦЕНТРАЦИЯ РАСТВОРА
Молярная концентрация раствора (См, моль/л.) показывает число моль растворённого вещества, содержащегося в 1 л раствора.
СМ = n моль, если V в мл, то СМ = n*1000 ,
V л. V мл
где n = m (р.в.),
М (р.в.)
|
(2)
Молярным называют раствор, в 1 л которого содержится 1 моль растворённого вещества.
Эквивалентом (Э) называется такое количество элемента или вещества (по массе), которое без остатка взаимодействует с 1 моль атомов или ионов водорода, с 1 моль электронов в окислительно-восстановительной реакции или 1 моль любого вещества в любой химической реакции.
Эквивалент – величина переменная для одного и того же вещества и рассчитывается по уравнению реакции или по формуле:
|
f (кислоты) = 1 ,
число ионов (Н+), участвующих в х.р.
f (основания) = 1 ,
число ионов (ОН‾ ), участвующих в х.р.
f (кислоты) = 1 ,
число ионов (Меn+) * n
где n- заряд иона металла.
3. ЗАКОН ЭКВИВАЛЕНТОВ
|
Вид: , где Сн1 и Сн2 – молярная концентрация эквивалентов анализируемого и стандартного (концентрация которого точно известна) растворов, а V1 и V2 – соответственно их объёмы.
4. ПЕРЕВОД ОДНОГО СПОСОБА ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ
РАСТВОРА В ДРУГОЙ
Нужно помнить, что масса растворённого вещества – неизменная и общая для формул любого способа выражения концентрации величина, следовательно, при помощи её и производят перевод.
а) перевод массовой доли растворённого вещества в молярную концентрацию.
|
б) перевод массовой доли растворённого вещества в молярную концентрацию эквивалента.
|
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ: «СПОСОБЫ ВЫРАЖЕНИЙ
КОНЦЕНТРАЦИЙ РАСТВОРОВ»
Задача № 1.
К 120 мл. раствора с массовой долей NaCl 16 % и плотностью 1,16 г/см3 прилили воду объёмом 80 мл. Рассчитайте ω%, См, Сн полученного раствора.
 Дано: Решение:
Дано: Решение:
Vр-ра = 120 мл 1. Находим массу 16 % раствора, зная,
ρ1(р-ра) = 1,16 г/см3 что
 ω1 %(NaCl) = 16 % ρ = m , m = ρ *V,
ω1 %(NaCl) = 16 % ρ = m , m = ρ *V,
V(H2O) = 80 мл V
ρ2 = 1,071 г/см3 m (р-ра) = 120 *1,16 = 139,2 г.
М(NaCl) = 58,5 г/моль 2. Из формулы: ω % (р.в.) = m (р.в.) *100 % ,
 ω2 %= ? m(р – ра)
ω2 %= ? m(р – ра)
Сн = ? определяем m (р.в.) в 16 % растворе:
См = ? m (р.в.) = ω 1 % * m (р-ра) ,
100%
m (р.в.) = 16 *139,2 = 22,27 г
100 %
3. После прибавления воды масса раствора изменилась, т.к. ρ(Н2О) = 1 г/см3, то m (р-ра) = 139,2 + 80 = 219,2 г.
4. Находим массовую долю растворённого вещества в новом растворе:
ω2% = 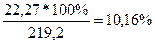
5. Определяем См, зная формулу перерасчета:
См = 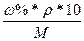
См = 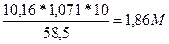
6. Определяем Сн, но т.к. f(NaCl) = 1 и Э = М (NaCl), то
Сн = См = 1,86 н.
Ответ: ω2% = 10,16%, См = 1,86 М, Сн = 1,86 н.
Задача №2
На нейтрализацию 20 мл 0,2 н раствора соляной кислоты израсходовано 15 мл гидроксида калия. Рассчитайте Сн (КОН).
 Дано: Решение:
Дано: Решение:
V(HCl) = 20 мл 1. Зная закон эквивалентов,
C(HCl) = 0,2 н Сн (к-ты) *V(к-ты) = Сн (щ) *V(щ),
 V(KOH) = 15 мл находим С(КОН)
V(KOH) = 15 мл находим С(КОН)
Сн (КОН) = 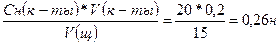
Ответ: Сн (КОН) = 0,26 н.
Дата добавления: 2018-11-24; просмотров: 1251; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
