ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (ВМС)
Различают природные и синтетические высокомолекулярные соединения. Природные ВМС — белки, крахмал, целлюлоза — не только формируют животный и растительный мир, но и входят в состав пищевого сырья и продуктов питания. Ряд важнейших отраслей пищевой промышленности (хлебопекарная, крахмалопаточная, продуктов брожения и др.) основан на использовании природных ВМС. Синтетические ВМС широко используются в промышленности и в быту. На их основе получают в больших количествах материалы, которых нет в природе и с теми качествами, которые недоступны природным материалам.
ВМС и растворы обладают рядом свойств, характерных для дисперсных систем; кроме того, им присущи свои специфические свойства, к которым, в частности, относятся набухание и студнеобразование. Это привело к формированию раздела коллоидной химии, именуемого «коллоидной химией ВМС». Коллоидные и специфические свойства растворов ВМС играют особую роль в пищевой технологии.
Коллоидная химия ВМС
К высокомолекулярным относятся соединения с большой молекулярной массой. ВМС могут быть природными и синтетическими (полимеры). Большинство синтетических ВМС нерастворимы в воде и являются твердыми веществами. Значительная часть природных ВМС способна растворяться в воде.
Многочисленные полимерные материалы — полиэтилен, фторопласты, полиамид, полистирол, фенол-формальдегидные смолы и др. — это синтетические ВМС.
|
|
|
ВМС состоят из макромолекул, что означает «гигантские молекулы»; их молекулярная масса составляет 104—106 (сравним — молекулярная масса воды равна 18). Макромолекулы формируются из большого числа повторяющихся группировок атомов, именуемых звеньями. Для полимеров характерны мономерные звенья. Полимеры образуются из низкомолекулярных молекул. Молекулы способны вступать в реакцию друг с другом или с молекулами других веществ с образованием полимеров. Так, в результате полимеризации этилена образуется полиэтилен по следующей схеме:
m(CH2 = CH2) → (–CH2 – CH2–)n. (19.1)
этилен полиэтилен
Звенья –СН2–СН2 — являются мономерными.
К природным, или биополимерам относятся важнейшие ВМС растительного и животного происхождения: белки, нуклеиновые кислоты, полисахариды (крахмал, целлюлоза), натуральный каучук и др. Белки составляют основу всех живых организмов и участвуют практически во всех процессах жизнедеятельности.
Как уже отмечалось (см. параграф 1.4) своим нaзвaниeм кoллoиднaя химия обязана растворам ВМС, обладающим клеящим действием. «Коллоид» означает клееподобный (от греческого «колла» — клей). Таким образом, в начале зарождения коллоидной химии, т.е. в 60-х годах XIX-ого столетия, никто не сомневался в том, что растворы ВМС являются объектами коллоидной химии. Позже, в 30-х годах XX-го столетия, растворы ВМС исключили из объектов коллоидной химии. Основанием послужила термодинамическая равновесность некоторых растворов ВМС. Действительно, растворы ВМС обладают дисперсностью (определенным размером макромолекул) при отсутствии гетерогенности, т.е. границы раздела фаз — одного из существенных признаков дисперсных систем. В связи с этим растворы ВМС стали рассматриваться в качестве истинных, а не коллоидных.
|
|
|
В конце концов, все встало на свои места. В последние 30 лет определилось новое научное направление — коллоидная химия ВМС (полимеров) как составная часть коллоидной химии.
Нельзя считать, что растворы ВМС принадлежат либо к истинным, либо к коллоидным растворам: они обладают свойствами как истинных, так и коллоидных растворов, а также специфическими свойствами, присущими только им, а именно:
l как коллоидных растворов — способность переходить в золь при замене растворителя; студнеобразование, аналогичное гелеобразованию; броуновское движение, диффузия, рассеяние света; образование ассоциатов молекул, размеры которых соизмеримы с частицами высокодисперсных систем (элементы гетерогенности), эмульсий, суспензий и пен;
|
|
|
l как истинных растворов — лиофильность, самопроизвольное образование, гомогенность в определенных условиях, термодинамическая устойчивость;
l специфические — анизотропия вязкости в зависимости от структуры и свойств растворителя, набухание и студнеобразование.
Растворы ВМС являются типичными лиофильными обратимыми системами. Они образуются самопроизвольно и термодинамически устойчивы. Сухой остаток ВМС в состоянии самопроизвольно переходить в раствор. Перечисленные признаки характерны для истинных растворов.
В то же время растворы ВМС обладают некоторыми свойствами коллоидных растворов. Размеры макромолекул ВМС соответствуют размерам частиц высокодисперсных систем: 1—100 нм, чаще 40—80 нм. В определенной ситуации макромолекулы ВМС можно рассматривать в качестве самостоятельной фазы. Напомним, что фаза — это однородная по агрегатному состоянию, составу и свойствам часть системы. Своеобразная граница раздела возникает между структурами (макромолекулами) и бесструктурным веществом (растворителем). Кроме того, макромолекулы могут взаимодействовать и образовывать ассоциаты. С увеличением концентрации ВМС или с понижением температуры размеры и время существования ассоциатов увеличиваются; при этом их размеры соответствуют размерам частиц высокодисперсных систем.
|
|
|
Растворы ВМС в зависимости от природы растворителя могут быть истинными или коллоидными. Желатин, например, представляет собой белок, в состав которого входят полярные группы, имеющие большое сродство к воде. Поэтому неудивительно, что в воде при нагревании желатин образует истинный раствор. Но стоит только заменить воду на спирт, как истинный раствор желатина переходит в коллоидный, и образуется золь.
Обратный переход из коллоидного раствора в истинный наблюдается для натуральных и синтетических каучуков. Они растворимы в бензоле, бензине и других углеводородных растворителях, но нерастворимы в воде и образуют в водной среде коллоидные растворы, называемые латексами.
Макромолекулы ВМС не проходят через мембраны. Для растворов ВМС, как и для истинных и коллоидных растворов, характерны осмос, обратный осмос и ультрафильтрация (см. рис. 12.7). Макромолекулы ВМС в жидкой среде способствуют образованию суспензий, эмульсий и пен. Для полимеров характерны такие поверхностные явления, как адсорбция и адгезия. Макромолекулы растворов ВМС подобно частицам коллоидных растворов способны к броуновскому движению и диффузии, а также к рассеянию света.
Таким образом, коллоидная химия ВМС на основе общих закономерностей и явлений, присущих дисперсным системам, рассматривает особые, характерные для этого класса веществ, свойства.
Структура макромолекул ВМС
В зависимости от расположения звеньев различают линейные, разветвленные и сетчатые макромолекулы (рис. 19.1).
Линейные макромолекулы характерны для натуральных каучуков, регулярного полиэтилена, целлюлозы, некоторых белков, нуклеиновых кислот и др. Макромолекулы крахмала, полиэтилена высокого давления и других природных и синтетических ВМС могут быть разветвленными. Ветви разветвленных макромолекул Б (см. рис. 19.1. б) могут иметь длину того же порядка, что и основная цепь А. Макромолекулы сетчатых ВМС образуют трехмерную пространственную сетку (см. рис. 19.1, в). Образование таких структур происходит, например, в процессе вулканизации, когда каучук превращается в резину.
Расположение звеньев — важная, но не исчерпывающая характеристика макромолекул, она не отражает последовательность их чередования.

 Положение звеньев характеризуется конформацией макромолекул и определяется не только длиной связи между этими звеньями, но и неравноценностью связей внутри макромолекул.
Положение звеньев характеризуется конформацией макромолекул и определяется не только длиной связи между этими звеньями, но и неравноценностью связей внутри макромолекул.
Различают связи двух типов: первый — между звеньями цепи, второй — между цепями макромолекул или отдельными их фрагментами. Связи первого типа — химические и характеризуются энергией порядка десятков и сотен кДж/моль; связи второго типа обусловлены внутримолекулярными взаимодействиями за счет сил Ван-дер-Ваальса, водородных связей и электростатических сил, энергия которых значительно (в 10—100 раз) ниже энергии химической связи. Подобные связи на рис. 19.2, в показаны пунктиром. Наличие связей двух типов обусловливает вращение мономерных звеньев и гибкость макромолекул, что позволяет им принимать различные конформации.

 Конформацией называют различные пространственные энергетически неравноценные формы макромолекул. Она возникает в результате изменения относительной ориентации звеньев вследствие их вращения вокруг химических связей, изгиба самих связей и других причин (без разрыва этих связей). Схематически конформация звена 1 вокруг связи 2 приведена на рис. 19.2, а. Способность к изменению размеров и формы макромолекул в широких пределах является важнейшим свойством ВМС.
Конформацией называют различные пространственные энергетически неравноценные формы макромолекул. Она возникает в результате изменения относительной ориентации звеньев вследствие их вращения вокруг химических связей, изгиба самих связей и других причин (без разрыва этих связей). Схематически конформация звена 1 вокруг связи 2 приведена на рис. 19.2, а. Способность к изменению размеров и формы макромолекул в широких пределах является важнейшим свойством ВМС.
Энергия единичного внутримолекулярного взаимодействия между звеньями макромолекул незначительна по сравнению с химической связью между звеньями. Однако внутримолекулярных связей много, и поэтому макромолекулы способны сохранять свою форму. В результате конформационных изменений макромолекулы могут принимать различную форму (см. рис. 19.2): линейную (цепи), клубка, даже глобул. Глобула — это частица, образованная из скрученной макромолекулы. В отличие от клубка, размеры которого в результате конформационных флуктуаций могут изменяться, а сама форма образуется за счет преимущественного взаимодействия между звеньями, в глобуле осуществляется связь между соседними звеньями, и макромолекулы как бы сворачиваются на себя. В результате глобула имеет постоянный размер, а ее плотность приближается к плотности соответствующего ВМС.
Конформация и различные состояния макромолекул ВМС объясняются стремлением к самопроизвольному уменьшению энергии Гиббса (см. рис. 2.1). С учетом условий (10.21) и (10.22) уменьшение энергии Гиббса происходит, когда
 (19.2)
(19.2)
Конформация характеризует оптимальную пространственную форму макромолекул, отвечающую максимуму энтропии S, что соответствует условию (19.2). Для одной и той же макромолекулы число конформаций может быть большим, так как множество звеньев могут вращаться независимо друг от друга в различных направлениях и сочетаниях. Незначительные изменения состава макромолекул или действие растворителя могут резко влиять на энергию внутримолекулярных связей и конформацию в целом.
При этом обеспечивается наиболее вероятностное состояние системы, соответствующее переходу от определенного порядка с небольшим числом конформаций к беспорядку с увеличенным числом конформационных состояний. Причем процесс перехода в наиболее вероятное состояние происходит самопроизвольно. Этот переход связан с ростом энтропии.
Конформация играет определенную роль в процессе черствения хлеба. Черствение, в частности, вызвано взаимодействием между крахмалом и белком в мякише хлеба. Гибкие звенья в макромолекуле крахмала сближаются и связываются с макромолекулами белка; одновременно выделяется влага. В результате возникает более прочная структура мякиша, обусловливающая черствение.
Конформационные свойства определяют гибкость и высокую эластичность ВМС. Для количественной характеристики эластичности ВМС используют модуль Юнга Е, который называют еще модулем упругости [его значение определяют при помощи формулы (11.1)], а также эквивалентный ему модуль эластичности. Модуль Юнга для твердых структурированных систем не превышает 104 Па. Модуль эластичности равен 10–2 Па, т.е. на шесть порядков меньше. Это обстоятельство обусловливает различные механизмы упругости и эластичности: упругость имеет энергетический характер, эластичность же определяется гибкостью макромолекул и вызвана небольшим изменением энтальпии и повышением энтропии [см. условие (19.2)], поэтому она носит энтропийный характер.
Свойства растворов ВМС
Для растворов ВМС характерны три группы свойств. Первые две присущи истинным и коллоидным растворам, а третья группа свойств характерна только для растворов ВМС; к ним относятся набухание и студнеобразование.
В отличие от истинных и коллоидных растворов, для которых осмотическое давление определяется формулой (9.11), осмотическое давление растворов ВМС вычисляется по формуле
 (19.3)
(19.3)
где с, М — концентрация и молекулярная масса ВМС; b —второй вириальный коэффициент.
В формуле (19.3), характеризующей изменение осмотического давления как случайной величины, b является вторым вириальным коэффициентом, который отражает флуктуацию конформационных структур макромолекул.
Если разделить правую и левую части уравнения (19.3) на концентрацию, то получим выражение
 (19.4)
(19.4)
Величину π/с называют приведенным осмотическим давлением. Для идеальных растворов и большинства истинных и коллоидных растворов значение π/с остается постоянным и не зависит от концентрации. Для растворов ВМС за счет различия конформационных форм макромолекул ВМС величина π/с изменяется в зависимости от концентрации ВМС, что и отражено в уравнении (19.4).
В координатах «π/с — с» уравнение (19.4) является уравнением прямой, тангенс угла наклона которой численно равен второму вириальному коэффициенту b, а отрезок, отсекаемый этой прямой на оси ординат при с = 0, соответствует величине RT/М, т.е. обратно пропорционален молекулярной массе макромолекул ВМС.
Таким образом, по значению осмотического давления можно определить молекулярную массу макромолекул растворенных ВМС. Наиболее точные результаты получены для ВМС, макромолекулы которых имеют молекулярную массу в пределах l.104–2.105.
Вязкость растворов ВМС, как и любых растворов, в том числе и коллоидных, зависит от концентрации вещества в растворе [см. уравнение (11.7)]. В отличие от других растворов незначительная концентрация ВМС порой приводит к значительному увеличению вязкости раствора. Так, вязкость 1%-го раствора каучука в бензине в 18 раз выше вязкости чистого бензина. Вязкость истинных растворов при данной температуре является постоянной. Например, при 293 К вязкость 50%-го раствора глицерина составляет 6.10–3 Па-с. Растворы ВМС ведут себя иначе. Макромолекулы синтетических ВМС характеризуются неодинаковыми размерами и массой; их вязкость будет определяться не только концентрацией, но размерами макромолекул и их конформационным состоянием.
Вязкость растворов ВМС зависит от условий определения, в частности от давления. Дело в том, что одни и те же макромолекулы могут находиться в различных конформационных состояниях; от линейных до глобул. По этой причине вязкость концентрированных растворов ВМС может быть анизотропной, т.е. неодинаковой в различных направлениях. Вязкость макромолекул с выпрямленными и ориентированными хаотично по отношению к направлению движения звеньями выше, чем вязкость макромолекул, которые имеют форму клубка или глобул.
Если вязкий полимер или его раствор продавливать через капилляр, то макромолекулы будут ориентироваться и вытягиваться, а наблюдаемая вязкость системы снижается.
Вязкость растворов ВМС в значительной степени зависит от свойств и температуры растворителей. Растворители способны влиять на конформационную форму макромолекул и за счет этого изменять вязкость одного и того же раствора ВМС, т.е. вязкость раствора ВМС определяется природой самих ВМС и растворителя.
Таким образом, вязкость растворов ВМС при идентичных условиях (одинаковый состав, равная концентрация и температура) может быть переменной. Поэтому ее сопоставляют с вязкостью чистого растворителя. Для растворов ВМС различают относительную, удельную, приведенную и характеристическую вязкость.
Относительная вязкость — это отношение вязкости раствора τp к вязкости растворителя τ0 (обычно к вязкости воды)
 (19.5)
(19.5)
Относительную вязкость можно определить по времени истечения раствора ВМС τp и растворителя τ0 через калиброванное отверстие вискозиметра.
Удельная вязкость показывает, насколько увеличилась вязкость раствора ВМС по сравнению с вязкостью растворителя:
ηуд. = (ηр – η0)/η0 =(τр – τ0) = ηотн. - 1 (19.6)
Конформация и ориентация макромолекул относительно направления течения раствора зависят от концентрации растворителя. По этой причине удельную вязкость относят к концентрации и получают приведенную вязкость ηпр:
ηпр. = ηуд./с (19.7)
Обычно приведенная вязкость линейно зависит от концентрации ВМС (рис. 19.3). При экстраполяции прямой, приведенной на рис. 19.3, до пересечения с осью ординат получают величину [η], которую называют характеристической вязкостью:
[η] =  ηуд./с (19.8)
ηуд./с (19.8)
Характеристическую вязкость определяют на основании вискозиметрических измерений, используя значения относительной, удельной и приведенной вязкости в качестве вспомогательных величин.
Характеристическая вязкость для данной пары веществ (растворитель — ВМС) является условной, но постоянной величиной. Эта величина не зависит от концентрации растворителя и конформационных состояний макромолекул.
Характеристическая вязкость обладает еще одним замечательным свойством; она непосредственно связана с молекулярной массой макромолекул ВМС. Заметим, что у некоторых природных ВМС, в том числе и белков, молекулярная масса постоянна. Поэтому среднюю молекулярную массу определяют для всех синтетических и части природных ВМС.
Для одного и того же растворителя связь между характеристической вязкостью и молекулярной массой М выглядит следующим образом:
 (19.9)
(19.9)
где 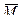 — средняя молекулярная масса для синтетических и части природных ВМС и истинная — для некоторых природных соединений; k — коэффициент, постоянный для раствора ВМС одного гомологического ряда в данном растворителе; α — коэффициент, характеризующий гибкость цепей макромолекул в растворе и их форму в зависимости от конформационного состояния.
— средняя молекулярная масса для синтетических и части природных ВМС и истинная — для некоторых природных соединений; k — коэффициент, постоянный для раствора ВМС одного гомологического ряда в данном растворителе; α — коэффициент, характеризующий гибкость цепей макромолекул в растворе и их форму в зависимости от конформационного состояния.
Уравнение (19.9) по имени авторов называют уравнением Марка-Куна-Хаувинка.
Чем лучше растворитель, тем больше значение коэффициента α, который изменяется в пределах 0 ≤ α ≤ 2.
Для растворов полимеров с короткими и жесткими звеньями и линейной формой макромолекул коэффициент α = 1, и уравнение (19.9) упрощается:
 (19.10)
(19.10)
 После денатурации в 6М растворе гуанидинийгидрохлорида белки ведут себя в основном как статистические клубки, и коэффициент α = 0,66, а макромолекулы ДНК преимущественно имеют линейную форму, для них α = 1,13.
После денатурации в 6М растворе гуанидинийгидрохлорида белки ведут себя в основном как статистические клубки, и коэффициент α = 0,66, а макромолекулы ДНК преимущественно имеют линейную форму, для них α = 1,13.
Значение коэффициентов k и α определяют экспериментально. Для этой цели измеряют вязкость раствора ВМС определенного гомологического ряда с фиксированной молекулярной массой макромолекул.
 По известным значениям коэффициентов k и α и определенной экспериментально характеристической вязкости по уравнению (19.9) можно рассчитать среднюю молекулярную массу макромолекул. Зная молекулярную массу, можно определить средний размер r макромолекулы, если воспользоваться следующей формулой:
По известным значениям коэффициентов k и α и определенной экспериментально характеристической вязкости по уравнению (19.9) можно рассчитать среднюю молекулярную массу макромолекул. Зная молекулярную массу, можно определить средний размер r макромолекулы, если воспользоваться следующей формулой:
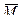 = 4π(r)3ρNA/3, (19.11)
= 4π(r)3ρNA/3, (19.11)
где NА — число Авогадро.
В связи с тем что удельный объем макромолекул ВМС является величиной, обратной их плотности, т.е. v = 1/р, радиус макромолекулы можно выразить как
 (19.12)
(19.12)
При помощи уравнений (19.11) и (19.12) можно определить эффективный радиус макромолекул ВМС (если принять, что их форма близка к сферической) в тех случаях, когда макромолекула имеет линейную структуру и образует глобулу.
Любая реальная макромолекула включает связанный с нею растворитель, масса которого равна mp. С учетом этого эффективный радиус макромолекулы ВМС вместо формулы (19.12) будет определяться следующим образом:
 (19.13)
(19.13)
где vp — удельный объем растворителя, м3/кг.
Молекулярную массу, а также размер и форму макромолекулы ВМС можно определить по интенсивности рассеянного света. Если обозначить через R отношение интенсивности рассеянного света к интенсивности падающего света (R = Jp /J0), а остальные величины правой части уравнения (8.2) остаются постоянными и равными Кp, то влияние молекулярной массы на относительное снижение рэлеевского рассеяния можно выразить следующим образом:
 (19.14)
(19.14)
По значению относительной интенсивности рассеянного света можно определить молекулярную массу макромолекул ВМС.
Амплитуда двух световых волн, рассеянных от двух возбужденных здектронов одной макромолекулы и расположенных на определенном расстоянии, не совпадает по фазе. Если результирующая относительного рэлеевского рассеяния, полученная путем интерференции всех волн, будет равна К’p, то уравнение (19.14) приобретает вид
 (19.15)
(19.15)
где Rи = J ир/Jр; J ир, Jр — интенсивность рассеянного света с учетом и без учета интерференции всех рассеянных волн.
Зная Rи и определив интенсивность рэлеевского рассеяния, можно рассчитать размеры и форму макромолекул ВМС. При этом надо иметь в виду, что рассеяние света зависит от конформационного состояния макромолекул ВМС. Максимальное рассеяние света наблюдается для макромолекул глобулярной формы.
У полимеров, полученных искусственным путем, молекулярная масса макромолекул различается, и довольно существенно. Поэтому для них характерна лишь средняя молекулярная масса. Макромолекулы природных ВМС имеют определенную структуру и постоянную молекулярную массу. В то же время могут существовать смеси природных ВМС различного состава. Например, макромолекулы крахмала состоят из смеси ВМС, которые отличаются друг от друга числом мономерных звеньев — остатков глюкозы.
Различают среднечисленную и среднемассовую молекулярные массы ВМС.
Среднечисленная молекулярная масса определяется по формуле
 (19.16)
(19.16)
где Мi, ni — молекулярная масса и число i-тых макромолекул.
Среднечисленную молекулярную массу используют в тех случаях, когда молекулярные массы макромолекул различаются незначительно. Если эти различия значительны (например, молекулярные массы отдельных макромолекул различаются на два и более порядка), то расчеты по формуле (19.16) дают искаженные результаты. В этом случае среднюю молекулярную массу выражают при помощи массовой доли хi, которая определяется отношением массы макромолекул данной фракции niМi к общей массе всех макромолекул  т.е.
т.е. 
С учетом этого среднемассовая молекулярная масса выразится так:
 (19.17)
(19.17)
Следует еще раз подчеркнуть, что определение среднего значения массы макромолекул по формулам (19.16) и (19.17) справедливо лишь для синтетических и части природных ВМС. Для макромолекул некоторых природных ВМС, в частности белков, когда их состав фиксирован, определение среднего значения массы теряет смысл.
Набухание
Макромолекулы ВМС при взаимодействии с растворителями способны к набуханию. Набухание — это увеличение массы и объема ВМС за счет поглощения низкомолекулярной жидкости или ее пара. Оно характеризуется степенью набухания α, которая показывает относительное увеличение массы ВМС
 (19.18)
(19.18)
где m0, m — масса ВМС до и после набухания; mж — масса поглощенной жидкости.
Часто степень набухания выражают в процентах. Степень набухания может изменяться в широком диапазоне — от десятков до тысячи процентов; для природных ВМС степень набухания обычно не превышает 1600%.
Набухание имеет место в процессе получения и хранения продуктов питания. Прорастанию зерна всегда предшествует его набухание. Процесс приготовления теста заключается в смешивании муки с водой с добавкой веществ, стимулирующих брожение. Образование из муки теста происходит в результате набухания белков и крахмала. Степень набухания белков достигает 200%, для крахмала она значительно меньше. Мякиш хлеба — это набухшая система. Степень набухания свежего хлеба может быть равна 15%, а черствого — 4%: для сухарей она составляет уже 25—35%.
В мукомольной промышленности для облегчения разрушения зерен при помоле их предварительно подвергают гидротермической обработке. При повышении температуры до 323 К зерно набухает. Процесс происходит неравномерно, в результате создаются внутренние напряжения, которые способствуют диспергированию, т.е. разрушению зерен.
При замачивании зерна набухание идет более интенсивно. Замачивание кукурузного зерна перед помолом применяют при производстве крахмала. Замачивание является первой стадией процесса при производстве солода, основного сырья для получения кваса и пива. Замачивание и набухание агара и агароида используются в начале технологических операций при производстве желейных кондитерских изделий (мармелада).
 Степень набухания зависит от времени (рис. 19.4). Набухание может быть ограниченным (кривая 1) и неограниченным (кривая 2). При ограниченном набухании макромолекулы поглощают жидкость, но в ней не растворяются. В результате ограниченного набухания степень набухания достигает максимального значения α∞ и в дальнейшем не увеличивается. Ограниченное набухание приводит к образованию студня. Неограниченное набухание заканчивается растворением. Подобный процесс наблюдается при набухании натурального и синтетического каучука в углеводородах, глобулярных белков в воде, желатина в горячей воде.
Степень набухания зависит от времени (рис. 19.4). Набухание может быть ограниченным (кривая 1) и неограниченным (кривая 2). При ограниченном набухании макромолекулы поглощают жидкость, но в ней не растворяются. В результате ограниченного набухания степень набухания достигает максимального значения α∞ и в дальнейшем не увеличивается. Ограниченное набухание приводит к образованию студня. Неограниченное набухание заканчивается растворением. Подобный процесс наблюдается при набухании натурального и синтетического каучука в углеводородах, глобулярных белков в воде, желатина в горячей воде.
 В результате ограниченного набухания белков муки образуется эластичное и плотное по консистенции тесто. Когда часть белков переходит в растворенное состояние, свойства теста ухудшаются: оно становится жидким и липким. Набухание в этом случае переходит в неограниченное, что соответствует кривой 2 на рис. 19.4. Сплошная линия кривой 2 и максимум на ней характеризуют состояние ВМС в виде студня, а пунктирная — в виде раствора.
В результате ограниченного набухания белков муки образуется эластичное и плотное по консистенции тесто. Когда часть белков переходит в растворенное состояние, свойства теста ухудшаются: оно становится жидким и липким. Набухание в этом случае переходит в неограниченное, что соответствует кривой 2 на рис. 19.4. Сплошная линия кривой 2 и максимум на ней характеризуют состояние ВМС в виде студня, а пунктирная — в виде раствора.
Набухание сопровождает жизнедеятельность всех растительных и животных организмов. Почки человека помимо основной функции (выведение из организма продуктов обмена) осуществляют регулирование воды, а их соединительная ткань служит индикатором водного обмена между кровью и клетками. Вследствие набухания соединительная ткань способна воспринимать излишек воды и отдавать его клеткам или направлять в кровь.
Процесс набухания избирателен в зависимости от природы ВМС и растворителя. Ограниченное набухание имеет место при взаимодействии полярного ВМС с полярным холодным растворителем (например, белка с водой) или неполярного ВМС с неполярной холодной жидкостью (например, каучука с бензолом). Вид набухания, а также его скорость определяются температурой растворителя.
Для одного и того же ВМС и растворителя можно наблюдать одновременно ограниченное и неограниченное (растворение) набухание. Часть крахмала (10—20%) после обработки теплой водой растворяется (неограниченное набухание), а большая часть его нерастворима и способна к ограниченному набуханию. В свежем хлебе содержится до 5,5%, а в черством — до 4,5% водорастворимых ВМС, способных к неограниченному набуханию.
Изменение степени набухания с течением времени определяет скорость набухания vн, которая выражается следующим образом:
 (19.19)
(19.19)
Кинетика набухания, т.е. изменение скорости набухания во времени, идет по механизму реакции первого порядка. В связи с этим скорость набухания можно представить в следующем виде:
 (19.20)
(19.20)
где kн — константа скорости набухания: τ — время набухания; ατ — степень набухания за время τ; α¥ — предельная степень набухания.
Из формулы (19.20) путем ее интегрирования можно определить константу скорости набухания, которая по аналогии с константой скорости реакции первого порядка будет иметь вид
 (19.21)
(19.21)
Константа скорости набухания kн и степень набухания ατ характеризуют кинетику процесса, а степень предельного набухания α¥ — его конечный результат.
Набухание протекает в несколько стадий, которые в случае полярного растворителя представлены на рис. 19.5. Первая стадия (см. рис. 19.5, а) связана с диффузией молекул растворителя в макромолекулы ВМС, сольватацией этих молекул, а также с разрывом слабых связей между макромолекулами. В результате этой стадии полярные молекулы растворителя 1 образуют сольватный 2, а в случае воды — гидратный слой. Вследствие сольватации и отталкивания одноименных зарядов сольватных слоев рвется слабая связь 3 между звеньями макромолекул.

 На второй стадии происходит диффузия самих макромолекул или их звеньев в раствор. В результате разрыва слабых связей макромолекулы приобретают способность диффундировать в раствор. Направление диффузии на рис. 19.5, б показано стрелками.
На второй стадии происходит диффузия самих макромолекул или их звеньев в раствор. В результате разрыва слабых связей макромолекулы приобретают способность диффундировать в раствор. Направление диффузии на рис. 19.5, б показано стрелками.
Набухание — типичное коллоидно-химическое явление. Оно происходит с выделением теплоты. Это непосредственно следует из основных термодинамических представлений об открытых системах, для которых характерно соотношение (10.21). На первой стадии процесса энтропия системы практически не изменяется. По этой причине снижение энергии Гиббса в самопроизвольном процессе, к которому относится набухание, произойдет за счет уменьшения энтальпии. Уменьшение энтальпии для изобарно-изотермического процесса означает выделение теплоты, т.е. набухание является экзотермическим процессом. В результате ослабления связи между макромолекулами на второй стадии набухания беспорядок увеличивается, а это приводит к росту энтропии; в соответствии с условиями (10.21), когда dG < 0.
Тепловой эффект, который сопутствует набуханию, называют теплотой набухания. Выделение теплоты происходит на первой стадии процесса набухания при сольватации молекул растворителя. Диффузия звеньев макромолекул, т.е. вторая стадия набухания, обусловлена энтропийным фактором.
Различают интегральную и дифференциальную теплоту набухания. Интегральная теплота набухания — это количество теплоты, которое выделяется в течение всего процесса набухания при поглощении единицей массы сухого вещества определенной массы жидкости. Ее можно определить при помощи следующей эмпирической формулы
 (19.22)
(19.22)
где А, В — опытные коэффициенты; mж — масса жидкости в набухшем ВМС.
Интегральная теплота набухания может быть значительной. Так, при набухании 1 кг сухого желатина может выделяться 27,9 кДж, а при набухании 1 кг крахмала — 32,3 кДж.
В результате дифференцирования интегральной теплоты набухания Q по mж получают дифференциальную теплоту набухания. Она показывает количество теплоты, которое выделяется на любой стадии процесса набухания при поглощении единицы (1 кг) жидкости:
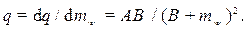 (19.23)
(19.23)
Обычно экспериментально определяют интегральную теплоту набухания. Затем по уравнению (19.23) рассчитывают дифференциальную теплоту набухания.
Набухание сопровождается увеличением объема BMС. Если исходная масса вещества заключена в определенную емкость, то в процессе набухания за счет увеличения объема вещества возникает давление набухания (до 107 Па).
Давление набухания можно вычислить по следующей формуле:

где k — коэффициент, зависящий от природы ВМС, растворителя и температуры; m0 — содержание сухого вещества в набухшем студне; α — коэффициент, значение которого близко к 3.
Студни и студнеобразование
Ограниченное набухание приводит к образованию студней. Они во многом схожи с гелями (см. параграф 14.2): и те, и другие являются структурированными системами, содержат связанную и свободную воду или другую жидкость, обладают признаками жидкости и твердого тела и проявляют специфические свойства, к числу которых относится синерезис. Студни получаются из растворов ВМС, а гели — из золей, т.е. коллоидных растворов. Эти системы включают каркас, который состоит из частиц коллоидных размеров или макромолекул ВМС.
В зарубежной и отечественной научной литературе не делают различий между гелем, полученным из золя, и студнем, сформированным из макромолекул ВМС. Термин «студень» широко применяется в обиходе.
В табл. 19.1 приведена характеристика студней и гелей, полученных из растворов ВМС и золей. Структура гелей формируется из частиц дисперсной фазы (золей), а студней — из макромолекул ВМС различной формы.
Образование гелей и переход золя коллоидного раствора в гель определяются рядом причин. Увеличение температуры и перемешивание препятствуют образованию геля. С увеличением концентрации частиц дисперсной фазы и увеличением дисперсности интенсивность гелеобразования растет. Иными словами, чем больше частиц в единице объема и меньше их размер, тем быстрее золь переходит в гель.
Т а б л и ц а 19.1
Дата добавления: 2018-11-24; просмотров: 821; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
