Поверхностные явления как результат самопроизвольных процессов уменьшения поверхности раздела фаз и поверхностного натяжения
Поверхностными называют такие явления, которые вызваны самопроизвольным уменьшением поверхностной энергии. Эти явления происходят на границе раздела фаз между дисперсной фазой и дисперсионной средой.
Количественно возможность самопроизвольных поверхностных явлений определяется характеристическими функциями. Для изобарно-изотермического процесса можно воспользоваться изменением энергии Гиббса (dG). Дифференцируя равенство (2.9), получим
dG = σdВ + Bdσ, (2.13)
или
ΔG = σΔВ + BΔσ. (2.14)
Когда dG < 0 (ΔG < 0), область I рис. 2.1, то имеет место самопроизвольный процесс.
Снижение поверхностной энергии, энергии Гиббса, может быть достигнуто за счет уменьшения поверхности раздела фаз ΔВ и поверхностного натяжения Δσ. В связи с этим все поверхностные явления в дисперсных системах можно разделить на две группы: первая связана с уменьшением поверхности раздела фаз, вторая обусловлена снижением поверхностного натяжения. Схематически две группы поверхностных явлений показаны на рис 2.4.
Поверхностные явления как результат самопроизвольного уменьшения поверхности раздела фаз. Рассмотрим более подробно первую группу поверхностных явлений. Поверхностное натяжение может быть постоянным, тогда снижение поверхностной энергии ΔG будет обусловлено уменьшением площади раздела фаз ΔВ. Это снижение может быть реализовано за счет образования сферической и идеально гладкой поверхности, укрупнения частиц и механических процессов (см. рис 2.4).
|
|
|
Сферические частицы по сравнению с частицами другой формы обладают минимальной поверхностью. Образование сферических частиц в результате самопроизвольного уменьшения площади раздела фаз наблюдаются для систем с жидкой дисперсной фазой. Капли любой жидкости, в том числе и воды, в отсутствие гравитации (например, в кабине космического корабля) принимают сферическую форму. Такая форма является следствием самопроизвольного процесса. Капельки ртути, которые обладают значительным поверхностным натяжением в земных условиях, свертываются в сферу.
В эмульсиях, т.е. в дисперсных системах типа Ж/Ж, капли дисперсной фазы, особенно небольших размеров, самопроизвольно образуют сферы. Если плотность жидкости дисперсной фазы и дисперсионной среды одинакова, то образовавшиеся сферы из крупных капель будут находиться во взвешенном состоянии. Подобные явления наблюдаются в опытах Плато, когда, например, анилин по каплям вводят в теплую воду. Даже крупные капли анилина принимают сферическую форму, минимизируя тем самым поверхность раздела фаз.
|
|
|
Идеально гладкая поверхность жидкости образуется на границе раздела с газовой средой даже в отсутствие гравитации. Подобный процесс является следствием самопроизвольного снижения поверхностной энергии в результате сокращения до минимальных размеров поверхности раздела фаз.
Стремление к уменьшению поверхности раздела фаз проявляется в самопроизвольном укрупнении частиц дисперсной фазы. Происходит процесс, обратный дроблению частиц. Если частички цемента диаметром 10 мкм укрупняются и образуют агрегаты диаметром 1 мм, то удельная поверхность таких частиц снижается с 500 до 5 м2/кг. Процесс укрупнения идет самопроизвольно, а причиной, вызывающей его, служит избыточная поверхностная энергия, которая стремится к минимальному значению.
Укрупнение частиц твердой дисперсной фазы происходит за счет слипания и образования более крупных агрегатов. Этот процесс называют коагуляцией. Капли эмульсий после коагуляции могут сливаться и образовать более крупные капли. Этот процесс называют коалесценцией. Исчезновение более мелких капель и рост более крупных происходит в результате изотермической перегонки, ее особенности мы рассмотрим позже (см. параграф 12.3).
|
|
|
Избыток поверхностной энергии существует на любой межфазовой поверхности. В дисперсных системах самопроизвольное уменьшение раздела поверхности фаз порождает новые явления, которые обусловлены раздробленностью и очень большой межфазовой поверхностью и характерны лишь для дисперсных систем.
   | |||||
 | |||||
 | |||||
|
     |
|

 |
  |
Поверхностные явления как результат уменьшения поверхностного натяжения. Вторая группа поверхностных явлений обусловлена стремлением системы к самопроизвольному снижению поверхностного натяжения в результате процессов, которые протекают на поверхности раздела фаз. Для пояснения особенностей поверхностных явлений обратимся еще раз к уравнению (2.14). Из этого уравнения следует, что самопроизвольное снижение поверхностной энергии происходит за счет снижения поверхностного натяжения и может быть вызвано следующими процессами (см. рис. 2.4): механическими, тепловыми, физико-химическими и электрическими.
|
|
|
 Таким образом, можно разграничить четыре вероятных преобразования поверхностной энергии и соответственно четыре различных вида поверхностных явлений. Общность этих различных явлений заключается в том, что они происходят самопроизвольно за счет погашения избытка поверхностной энергии.
Таким образом, можно разграничить четыре вероятных преобразования поверхностной энергии и соответственно четыре различных вида поверхностных явлений. Общность этих различных явлений заключается в том, что они происходят самопроизвольно за счет погашения избытка поверхностной энергии.
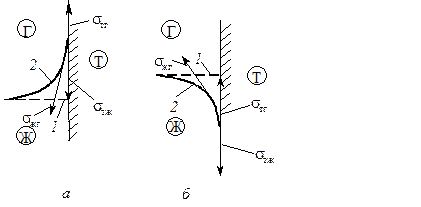
 Самопроизвольное снижение поверхностного натяжения, как и самопроизвольное изменение поверхности раздела фаз, может быть вызвано перемещением жидкости. Типичным перемещением является изменение профиля жидкости у твердой поверхности (рис. 2.5). В отсутствие самопроизвольного уменьшения поверхностного натяжения положение жидкости оставалось бы без изменения и характеризовалось бы линией 1. Фактически профиль жидкости определяется кривой 2. В зависимости от значений поверхностного натяжения на границе трех фаз (σЖГ, σТГ, σТЖ) наблюдается подъем или снижение уровня жидкости, контактирующей с твердой поверхностью.
Самопроизвольное снижение поверхностного натяжения, как и самопроизвольное изменение поверхности раздела фаз, может быть вызвано перемещением жидкости. Типичным перемещением является изменение профиля жидкости у твердой поверхности (рис. 2.5). В отсутствие самопроизвольного уменьшения поверхностного натяжения положение жидкости оставалось бы без изменения и характеризовалось бы линией 1. Фактически профиль жидкости определяется кривой 2. В зависимости от значений поверхностного натяжения на границе трех фаз (σЖГ, σТГ, σТЖ) наблюдается подъем или снижение уровня жидкости, контактирующей с твердой поверхностью.
Тепловые эффекты, которые вызывают изменение поверхностного натяжения (см. рис. 2.4), связаны с образованием новой поверхности раздела фаз или сопутствуют другим поверхностным явлениям.
Рассмотрим тепловые эффекты более подробно. В отсутствие изменения других параметров (dp = 0, dni = 0 и dq = 0) из уравнения (2.1), учитывая выражение (2.13), получим:
σdB + Bdσ ≤ – SdT + dB,
или
Bdσ ≤ – SdT. (2.15)
В условиях равновесия
dσ/dT = – SB, (2.16)
где SB – энтропия поверхностного слоя в расчете на единицу поверхности раздела фаз.
На основе второго начала термодинамики для обратимого процесса энтропию можно связать с теплотой образования единицы поверхности QB, т.е.
SB = QB /Т. (2.17)
Из уравнения (2.16) и (2.17) получим
dσ/dT = –QB /Т, или dσ/dT < 0. (2.18)
Величина dσ/dT показывает изменение поверхностного натяжения в зависимости от температуры и является температурным коэффициентом поверхностного натяжения.
Для индивидуальных веществ теплота образования поверхности QB всегда положительна. Из условия (2.18) следует, что поверхностное натяжение индивидуальных веществ на границе с газом снижается самопроизвольно с повышением температуры. В этом проявляется непосредственная связь между тепловыми процессами и поверхностным натяжением.
Температурный коэффициент поверхностного натяжения для воды составляет — 0,154 мДж/(м2 ∙ К). Это означает, что при повышении температуры на один градус поверхностное натяжение снижается на указанную величину.
Температурный коэффициент поверхностного натяжения можно связать с внутренней энергией, отнесенной к единице поверхностного раздела фаз UВ. Для этой цели воспользуемся уравнением Гиббса-Гельмгольца в следующем виде:
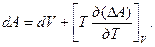 (2.18,а)
(2.18,а)
С учетом соотношения (2.7, а) в расчете на единицу поверхности раздела фаз уравнение (2.18, а) можно представить так:
UB = σ – T(Δσ/ΔT). (2.19)
Внутренняя энергия поверхностного слоя связана с теплотой образования единицы поверхности (например, 1 м2) QВ. Учитывая уравнения (2.16) и (2.17), вместо формулы (2.19) можно написать
UB = σ + QB. (2.20)
Таким образом, внутренняя энергия равна поверхностному натяжению и теплоте образования единицы площади поверхности. Если поверхность раздела фаз образует индивидуальное вещество, то теплота всегда поглощается, т.е. величина QB положительна. Из равенства (2.20) следует, что для индивидуального вещества внутренняя энергия больше поверхностного натяжения на теплоту образования поверхности. В свою очередь поверхностное натяжение в соответствии с уравнением (2.9) равно энергии Гиббса, отнесенной к единице поверхности; в связи с этим внутреннюю энергию называют полной поверхностной энергией.
Самопроизвольное снижение поверхностного натяжения может быть вызвано такими поверхностными явлениями, как адгезия и адсорбция; эти явления подробно будут рассмотрены далее (см. гл. 3—6).
Стремление к снижению поверхностного натяжения может вызвать определенную ориентацию молекул, ионов радикалов и электронов в поверхностном слое. В результате на поверхности раздела фаз образуется электрический заряд. Самопроизвольное снижение поверхностного натяжения приводит к возникновению электрического потенциала φ [см. уравнение (2.1)]. Следствием этого являются образование двойного электрического слоя и возникновение процессов, вызванных наличием электрического заряда (см. гл. 7).
Самопроизвольное снижение поверхностного натяжения происходит на любой поверхности, разделяющей две фазы. Для дисперсных систем этот процесс интенсифициируется за счет значительно удельной поверхности и реализуется в явлениях, которые указаны на рис. 2.4. Они обусловливают особые качества дисперсных систем.
Дата добавления: 2018-11-24; просмотров: 529; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
