Краткие теоретические сведения
Комплексные соединения (иначе соединения высшего порядка) образуются при взаимодействии друг с другом простых соединений, т. е. соединений первого порядка. Например,
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2.
По координационной теории А. Вернера (1893) комплексныминазываются наиболее устойчивые соединения высшего порядка, которые в водном растворе или расплаве способны к самостоятельному существованию.
Основу комплексного соединения (КС) составляют центральный атом (или ион), называемый комплексообразователем, и частицы (ионы или молекулы), располагающиеся вокруг комплексообразователя, которые называются лигандами. Комплексообразователь и лиганды образуют внутреннюю сферу КС. Ионы, нейтрализующие суммарный заряд частиц внутренней сферы и располагающиеся более отдаленно от комплексообразователя, называются внешней сферой. При написании формулы КС внутреннюю сферу отделяют от внешней квадратными скобками. Например:
 |
[Cu(NH3)4]SO4
Общее число связей, возникающих между комплексообразователем и его лигандами, называется координационным числом (КЧ) или координационной дентатностью комплексообразователя. Наиболее характерное значение КЧ можно оценить по формуле
КЧ ≈ 2 · Zк ,
где Zк – степень окисления комплексообразователя (иначе заряд иона).
|
|
|
КЧ не является постоянной величиной данного комплексообразователя, а обусловлено также природой лиганда. Нейтральные лиганды обычно присоединяются в большем количестве, чем заряженные. Например, для комплексов кобальта (II) известно существование ионов [Co(H2O)6]2+ и [CoCl4]2–.
По числу связей, образованных с центральным атомом, различают:
1) монодентатные лиганды – образуют одну связь и занимают одно место в координационной сфере комплексообразователя. В этом случае КЧ совпадает с числом лигандов во внутренней сфере. К таким лигандам относятся Н2О, NH3, CO, Cl–, CN– и др. Например, в ионах [Fe(CN)6]3– и [Cu(NH3)4]2+ КЧ равно 6 и 4 соответственно;
2) бидентатные лиганды. Они связаны с комплексообразователем двумя связями. В этом случае КЧ в два раза больше числа лигандов. К таким лигандам относятся молекулы гидразина, аминоуксусной кислоты, этилендиамина, а также ионы С2О 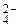 , SO
, SO 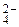 , CO
, CO 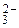 . Например, оксалат-ион – бидентатный, образует с ионом Cu2+ соединение K2[Cu(C2O4)2], в котором КЧ комплексообразователя равно 4. Следует помнить, что лиганды SO
. Например, оксалат-ион – бидентатный, образует с ионом Cu2+ соединение K2[Cu(C2O4)2], в котором КЧ комплексообразователя равно 4. Следует помнить, что лиганды SO 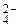 и CO
и CO 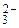 в зависимости от условий могут быть как монодентатными, так и бидентатными;
в зависимости от условий могут быть как монодентатными, так и бидентатными;
3) полидентатные лиганды. Они занимают в координационной сфере более двух мест, т.е. соединены с комплексообразователем тремя или более связями. Например, этилендиаминтетраацетат (ЭДТА) – шестидентатный лиганд.
|
|
|
При определении заряда комплекса необходимо учитывать следующее:
1) если лигандами являются только нейтральные молекулы, то заряд комплекса равен заряду центрального иона;
2) если во внутреннюю сферу входят как ионы, так и молекулы, то заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов с учетом их количества.
Например, для определения заряда иона [Cr3+(H2O) 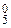 Cl–]x следует решить уравнение x = 1×(+3) + 5×0 + 1×(–1) = +2.
Cl–]x следует решить уравнение x = 1×(+3) + 5×0 + 1×(–1) = +2.
Образование названий КС осуществляется по следующим правилам:
1. Порядок перечисления частиц. Если соединение является комплексной солью, то его название состоит из двух слов: названия аниона в именительном падеже, а затем – катиона в родительном падеже.
Если внутренняя сфера – катион, то для названия комплексообразователя используют русский корень элемента, а если внутренняя сфера – анион, то в названии применяют латинский корень. Степень окисления комплексообразователя указывается в скобках римской или арабской цифрой.
У нейтральных комплексов (без внешней сферы) название состоит из одного слова в именительном падеже с использованием русского корня комплексообразователя, при этом его степень окисления не указывается.
|
|
|
При названии комплексного иона сначала указываются лиганды, затем комплексообразователь. Лиганды перечисляют в следующем порядке: сначала анионы – ОН–, одноатомные, полиатомные; затем нейтральные лиганды (сначала неорганические, затем органические); далее катионы в любом порядке.
Записанная формула читается справа налево. При составлении формулы по её названию в квадратных скобках сначала записывают комплексообразователь, а затем лиганды в обратном порядке их перечисления. Например,
K3[Fe(CN)6] – гексацианоферрат (III) калия;
[Pt(NH3)6]Cl4 – хлорид гексаамминплатины (IV);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина.
2. Названия лигандов. Для нейтральных лигандов используют однословные названия веществ без изменений. Например: N2 – диазот, N2H4 – гидразин, C2H4 - этилен. Для молекул Н2О, NH3, СО, NO применяют особые термины: аква, аммин, карбонил, нитрозил соответственно.
К названиям анионных лигандов прибавляют соединительную гласную «о». Например: Cl– – хлоро, SO 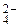 – сульфато, О2– – оксо,
– сульфато, О2– – оксо,
S2– – тио, ОН– – гидроксо, CN– – циано, NСS– – тиоцианато, Н– – гидридо, NO 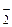 – нитро, NO
– нитро, NO 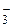 – нитрато и т.д. Исключение составляют анионы углеводородов, например С5Н
– нитрато и т.д. Исключение составляют анионы углеводородов, например С5Н 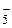 – циклопентадиенил.
– циклопентадиенил.
|
|
|
Громоздкие по написанию формулы органических лигандов заменяют буквенными обозначениями: NH2CH2CH2NH2 (этилендиамин) – Еn; C5H5N (пиридин) – py; (NH2)2CO (карбамид) – ur; NH2CH2COO– (глицинат-ион) – gly.
3. Приставки и окончания. Число простых лигандов указывают с помощью приставок греческих числительных: ди – 2, три – 3, тетра – 4, пента – 5, гекса – 6, гепта – 7, окта – 8, нона – 9, дека – 10, ундека –11, додека – 12.
Для лигандов со сложными названиями, в которых уже имеются приставки (моно-, ди- и т.д.), используют приставки бис – 2, трис – 3, тетракис – 4, а названия таких лигандов заключаются в круглые скобки.
Для названия анионных комплексов применяют окончания: -ат, если КС относится к классу солей; -овая или -ная, если КС является кислотой. Для катионных и нейтральных комплексов типичных окончаний нет. Например: [Fe(Еn)3]Cl3 – хлорид трис(этилендиамин)железа (+3); [Pt(Еn)(NH3)2(NO2)Cl]SO4 – сульфат хлоронитродиамминэтилендиамин-платины (IV); H2[SiF6] – гексафторокремниевая кислота.
КС очень разнообразны по строению и свойствам, поэтому применяющиеся системы классификации основываются на различных принципах:
1. По принадлежности к определённому классу химических соединений различают: комплексные кислоты (например, Н[AuCl4]); комплексные основания ([Cu(NH3)4](OH)2); комплексные соли (K4[Fe(CN)6]).
2. По природе лигандов: аквакомплексы (лиганды – молекулы воды, например [Co(Н2О)4](NO3)2); аммиакаты (лиганды – молекулы аммиака, [Ag(NH3)2]Cl); ацидокомплексы (лиганды – анионы кислот, Na3[AlF6]); гидроксокомплексы (лиганды – гидроксогруппы, K3[Al(OH)6]); смешанного типа (содержатся лиганды нескольких видов, [Co(NH3)4Cl2]).
3. По знаку заряда комплекса: катионные – [Zn(NH3)4]2+Cl 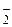 ; анионные – Li+[AlH4]– ; нейтральные (без внешней сферы) – [Pt(NH3)2Cl2]0; бикомплексы – [Co(NH3)6][Fe(CN)6].
; анионные – Li+[AlH4]– ; нейтральные (без внешней сферы) – [Pt(NH3)2Cl2]0; бикомплексы – [Co(NH3)6][Fe(CN)6].
Механизм образования КС, т. е. природа связи между комплексообразователем и лигандами, описывается с помощью различных квантово-механических методов, из которых самыми распространенными являются метод валентных связей (МВС) и теория поля лигандов (ТПЛ).
По МВС взаимодействие между комплексообразователем и лигандами осуществляется согласно следующим положениям:
1. Комплексообразователь и лиганды образуют ковалентные связи по донорно-акцепторному механизму. Лиганды являются донорами, а центральный атом – акцептором электронов. Возникающие таким образом связи относятся к s-типу и называются координационными;
2. АО центрального атома гибридизируются в зависимости от его электронной структуры, а также числа и природы лигандов. Тип гидридизации определяет геометрическое строение комплекса. Наиболее распространенные типы гибридизаций приведены в табл. 1. Собственные электронные пары комплексообразователя изображены сплошными стрелками, а донорные электронные пары лигандов – пунктирными;
3. Магнитные свойства комплекса связаны с наличием (парамагнетизм) или отсутствием (диамагнетизм) неспаренных электронов во внутренней сфере КС;
4. Кроме s-связей между комплексообразователем и лигандами могут возникать p-связи, в которых центральный атом – донор, а лиганды – акцепторы.
Таблица 1
Дата добавления: 2018-11-24; просмотров: 214; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
