ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХСОЕДИНЕНИЙ
Контрольные задания №№ 1-16
Для своего задания в соответствии с таблицей 2 назовите и классифицируйте исходные вещества, составьте уравнения химических реакций.
Таблица 2
| № задания | Исходные вещества | Составить уравнения возможных реакций с | ||||||||
| Водой | Кислотой | щелочью | солью | Основным оксидом | Кислотным оксидом | Амфотерным оксидом | ||||
| 1 | MgO | |||||||||
| H2S04 | ||||||||||
| 2 | CaO | |||||||||
| Н3РО4 | ||||||||||
| 3 | S02 | |||||||||
| NaOH | ||||||||||
| 4 | SO3 | |||||||||
| KOH | ||||||||||
| 5 | ZnO | |||||||||
| CuS04 | ||||||||||
| 6 | A1203 | |||||||||
| FeCl3 | ||||||||||
| 7 | K20 | |||||||||
| HNO3 | ||||||||||
| 8 | BeO | |||||||||
| ZnCl2 | ||||||||||
| 9 | BaO | |||||||||
| HC1 | ||||||||||
| 10 | Cr03 | |||||||||
| Ba(OH)2 | ||||||||||
| 11
| HNO3 | |||||||||
| CaO | ||||||||||
| 12 | H2S04 | |||||||||
| ZnCl2 | ||||||||||
| 13 | K20 | |||||||||
| HC1 | ||||||||||
| 14 | KOH | |||||||||
| FeCl3 | ||||||||||
| 15 | Ba(OH)2 | |||||||||
| ZnCl2 | ||||||||||
| 16 | CaO | |||||||||
| Н3РО4 | ||||||||||
Пример
Для своего задания в соответствии с таблицей 2 назовите и классифицируйте исходные вещества, составьте уравнения химических реакций.
Дано: ZnO и CuSО4
Ответ:
ZnO – оксид цинка (цинковые белила), амфотерный оксид.
CuSО4 – сульфат меди (медный купорос), соль.
1. Отношение к воде:
а) амфотерные оксиды с водой не взаимодействуют;
б) CuSО4 - соль, образованная слабым основанием и сильной кислотой. Такие соли вступают в реакции гидролиза с водой.
Гидролиз сульфата меди (II): CuSO4 → Cu2+ + SO42–
Соль образована катионом слабого основания и анионом сильной кислоты. Гидролиз по катиону. Ионное уравнение гидролиза, определяем среду
|
|
|
Cu2+ + HOH → CuOH+ + H+; образуется катион гидроксомеди (II) и ион водорода, среда кислая.
Составляем молекулярное уравнение. 2CuSO4 + 2H2O → (CuOH)2SO4 + H2SO4
2. Отношение к кислотам:
а) амфотерные оксиды взаимодействуют с кислотами
ZnO + H2SO4 → ZnSO4 + H2O
б) Кислоты не взаимодействуют с кислотами
3. Отношение к щелочам:
а) амфотерные оксиды взаимодействуют со щелочами
при сплавлении: ZnO + 2NaOH → Na2ZnO2 + H2O
в растворе: ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
б) соли взаимодействуют со щелочами, если при этом
образуются малорастворимые вещества или слабые основания
CuSО4 + 2NaOH → Na2SO4 + Cu(OH)2
4. Отношение к солям:
а) для оксидов реакции с солями не характерны;
б) соль может взаимодействовать с другой солью, если в результате образуется малорастворимая соль
CuSО4 + BaCl2 → CuCl2 + BaSO4
5. Отношение к оксидам:
а) амфотерные оксиды взаимодействуют с основными и кислотными оксидами
ZnO + Na2O→ Na2ZnO2 ZnO + SO3→ ZnSO4
б) для солей реакции с оксидами не характерны.
Тема №3
РАСТВОРЫ
Контрольные задания №№ 1-18
|
|
|
Произведите расчеты в соответствии с вашим заданием, приведенным в таблице 3.
Таблица 3
| № задания | Растворенное вещество | Масса растворенного вещества (тв), г | Масса растворителя | Масса раствора (mр-ра), Г | Объем раствора | Плотность раствора (r), г/мл | Массовая доля (w), % | Молярная концентрация (см), моль/л | Моляльная концентрация (См) моль/кг |
| 1 | H2S04 | 200 | 1.090 | 13 | |||||
| 2 | НС1 | 0.1 | 1.095 | 5.5 | |||||
| 3 | Н3РО4 | 400 | 1.204 | 36 | |||||
| 4 | NaOH | 250 | 1.060 | 2.0 | |||||
| 5 | HNO3 | 1000 | 1.093 | 2.5 | |||||
| 6 | СН3СООН | 3.0 | 1.017 | 2.0 | |||||
| 7 | КОН | 400 | 1.310 | 5.4 | |||||
| 8 | ВаС12 | 800 | 1.203 | 20 | |||||
| 9 | Na2C03 | 0.3 | 1.103 | 10 | |||||
| 10 | NaCl | 0.25 | 1.150 | 3.6 | |||||
| 11 | Н3РО4 | 300 | 1.204 | 32 | |||||
| 12 | ВаС12 | 550 | 1.203 | 25 | |||||
| 13 | СН3СООН | 3.0 | 1.017 | 2.0 | |||||
| 14 | КОН | 600 | 1.310 | 5.4 | |||||
| 15 | NaOH | 200 | 1.060 | 2.0 | |||||
| 16 | NaCl | 0.25 | 1.150 | 3.6 | |||||
| 17 | HNO3 | 1100 | 1.093 | 2.5 | |||||
| 18 | НС1 | 0.2 | 1.095 | 5.5 |
Массовая доля w — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
|
|
|
w = m (в-ва)/ m (р-ра) . 100%
Говорит о том, сколько содержится граммов растворенного вещества в 100 граммах раствора.
Молярная концентрация Cм — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Показывает, сколько содержится грамм-молекул в 1 литре раствора вещества.
Формула для ее определения: Cм = (v / V), где v – количество вещества растворенного, моль; V – общий объем раствора, литр или м3.
Моляльная концентрация раствора Cm показывает количество молей v растворенного вещества в 1 кг. растворителя m:
Формула для ее определения такова: Cm = (v/m), где v – количество вещества растворенного, моль; m – масса растворителя, кг.
Пример
Дано: NaОН Произвести расчеты.
Ответ:
1. Мв (NaОН) = 23+16+1 = 40 г/моль ; v = m(в-ва) / Мв = 20г/40 г/моль = 0,5 моль.
2. Масса вещества
Cm = m(в-ва) / Мв х L; m(в-ва) = Cm х Мв х L = 2моль/ кг х 40 г/моль х 0,250 кг = 20г.
3. Масса раствора
m(р-ра) = m(в-ва) + L = 20г + 250г = 270г.
4. Объем раствора V = m(р-ра) /r = 270г/1,060г/мл = 254,72мл
5. Массовая доля растворенного вещества
w = m(в-ва) / m(р-ра) х100% = 20г/270г х100% = 7,41%
6. Молярная концентрация
Cм = v / V = 0,5моль/ 0,255л = 1,96 моль/л.
Тема №4
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Основу электрохимических процессов составляют:
1) реакции, вызывающие электрический ток;
2) реакции, вызванные протеканием электрического тока.
Реакции, способные генерировать электрический ток в системе, широко используются в устройствах, называемых химическими источниками тока. Это гальванические элементы, аккумуляторы и топливные элементы. Подобные реакции являются причиной коррозии металлов в присутствии влаги. Эти реакции протекают самопроизвольно. Некоторые химические реакции протекают только под действием электрического тока. Например, электровосстановление металлов из расплавов и растворов их солей. Такие реакции лежат в основе электролиза.
В любом электрохимическом процессе участвуют как минимум два электрода: катод и анод. Электродом может служить любой электропроводящий материал: различные металлы, их сплавы, графит. Все электрохимические реакции являются окислительно-восстановительными, то есть связаны с переносом электронов от одного вещества к другому. Любая окислительно-восстановительная реакция складывается из двух сопряженных процессов (полуреакций): окисления и восстановления. Окисление связано с потерей веществом электронов, а восстановление - с их присоединением. В любой области электрохимии электроды, на которых протекает процесс окисления, называют анодами, а электроды, на которых идет процесс восстановления - катодами.
Причиной самопроизвольного протекания окислительно-восстановительной реакции в химическом источнике тока является разность потенциалов между катодом и анодом. При погружении металлической пластины в воду наблюдается качественно одинаковая картина: поверхность металла заряжается отрицательно, а приэлектродный слой жидкости - положительно.
Принято считать, что в узлах кристаллической решетки металла находятся положительно заряженные ионы, связанные между собой электронным газом. Под действием полярных молекул воды катионы металла переходят в раствор и заряжают пограничный слой жидкости положительно, а поверхность металла получает такой же по величине отрицательный заряд. Отрицательный заряд поверхности обусловлен электронами (неспособными переходить в раствор), которые компенсировали заряд металлических ионов до перехода их в раствор. Растворение металла в воде - процесс обратимый и продолжается до установления равновесия, когда количество ионов металла, переходящих в единицу времени в раствор, равно количеству ионов, достраивающих кристаллическую решетку
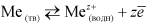
Образовавшийся на границе металл-раствор двойной электрический слой обусловливает величину равновесного электродного потенциала.
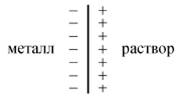
Величина равновесного электродного потенциала зависит от природы металла, температуры электролита, концентрации ионов металла и может быть рассчитана по уравнению Нернста:
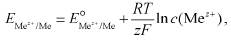
где 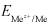 - равновесный электродный потенциал;
- равновесный электродный потенциал; 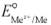 - стандартный электродный потенциал; R - универсальная газовая постоянная; Т- абсолютная температура; F - число Фарадея; z и c(Mez+) - соответственно зарядовое число и концентрация по-тенциалопределяющих ионов металла.
- стандартный электродный потенциал; R - универсальная газовая постоянная; Т- абсолютная температура; F - число Фарадея; z и c(Mez+) - соответственно зарядовое число и концентрация по-тенциалопределяющих ионов металла.
Подставив в уравнение значение всех констант при 25 °С ( R = 8.314 Дж/К моль; Т= 298 К; F = 96500 Кл/моль) и перейдя от натуральных логарифмов к десятичным, получим:
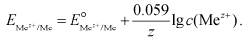
Величина 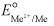 характеризует природу металла и равна величине равновесного потенциала на границе металл-раствор при концентрации собственных ионов металла 1 моль/л. Определить абсолютное значение стандартного электродного потенциала на современном этапе развития науки невозможно, поэтому пользуются величинами (табл. 8), измеренными относительно эталона - стандартного водородного электрода, потенциал которого условно принят равным нулю.
характеризует природу металла и равна величине равновесного потенциала на границе металл-раствор при концентрации собственных ионов металла 1 моль/л. Определить абсолютное значение стандартного электродного потенциала на современном этапе развития науки невозможно, поэтому пользуются величинами (табл. 8), измеренными относительно эталона - стандартного водородного электрода, потенциал которого условно принят равным нулю.
Таблица 8
Стандартные электродные потенциалы EQx / Red при 25°С.
(Ох - окисленная форма, Red - восстановленная форма)
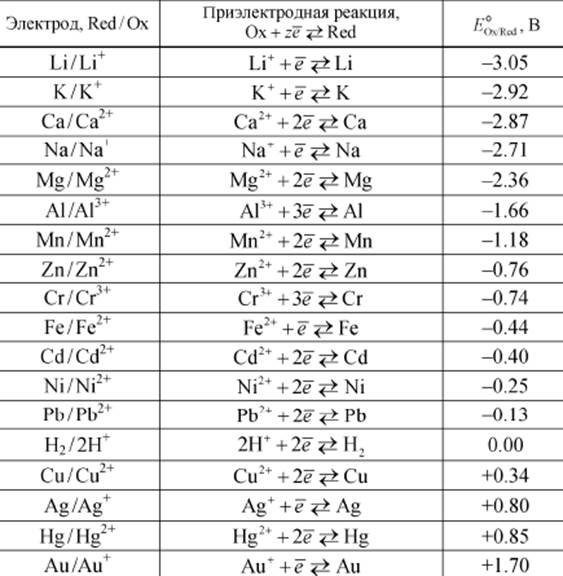
Металлы, расположенные в порядке возрастания алгебраической величины их стандартных электродных потенциалов, образуют электрохимический ряд напряжений металлов. Этот ряд дает наглядную характеристику относительной электрохимической активности металлов в водных растворах. В табл. 8 сверху вниз возрастает окислительная активность ионов металлов (т. е. окисленной формы), а снизу вверх - восстановительная активность атомов металлов (восстановленной формы).
В ряду напряжений равновесие приэлектродной реакции постепенно смещается от крайне левого положения для Li/Li+
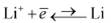
до крайне правого положения для Au/Au+
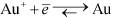
Окислительно-восстановительные реакции протекают в направлении образования новых окислителя и восстановителя, более слабых, чем исходные. Поэтому более активные компактные металлы способны вытеснять менее активные из водных растворов их солей. Например:
Mg + Pb2+ → Mg2+ + Pb
Ni + Cu2+ → Ni2+ + Cu
Обе эти реакции протекают в прямом направлении, так как в правых частях уравнения находятся окислители и восстановители более слабые, чем исходные (проверьте положение металлов, участвующих в реакции, в ряду напряжений). Для металлов, активно реагирующих с водой, реакции замещения других металлов в растворах солей нехарактерны, так как в этом случае возникают побочные процессы. Например, вместо восстановления меди металлическим натрием из раствора СиС12 будут протекать реакции:
2Na + 2Н2О → 2NaOH + H2
2NaOH + CuCl2 → 2NaCl + Cu(OH)2↓
Металлы, расположенные в ряду напряжений до водорода, как правило, вытесняют его из растворов кислот:
Fe + 2HC1 → FeCl2 + H2
Исключение составляют азотная и концентрированная серная кислоты. Кислотные остатки этих кислот являются настолько сильными окислителями, что "перехватывают" электроны, "предназначенные" для ионов водорода:
ЗСu + 8HNО3 → 3Cu(N03)2 + 2NO + 4Н2О
Сu-2е →Сu2+
NО3- + 4H+ + Зе → NО + 2Н2О
Реакции, подобные реакциям вытеснения одних металлов другими, протекают в химических источниках тока. Принципиальное отличие заключается в том, что процессы окисления и восстановления в таких системах разделены пространственно.
Простейший гальванический элемент состоит из двух металлических электродов, погруженных в растворы собственных солей. Эти растворы контактируют друг с другом через пористую перегородку. В схематической записи гальванического элемента граница раздела между металлом и раствором обозначается одной вертикальной чертой, а пористая перегородка между растворами - двумя. Например, схема гальванического элемента, образованного цинковым и серебряным электродами, погруженными в растворы соответствующих нитратов, выглядит так:
(-) Zn | Zn(N03)2 || AgN031 Ag (+)
Еще удобнее эта схема записывается в ионном виде
(-)Zn|Zn2+ || Ag+|Ag(+)
Цинк в ряду напряжений расположен до серебра, следовательно, более активен. Поэтому в основе работы данного гальванического элемента лежит реакция:
Zn + 2Ag+ → Zn2+ + 2Ag
Однако цинк непосредственно не контактирует с ионами серебра. Поэтому реакция пойдет лишь при условии, что внешняя цепь будет замкнута, т.е. цинк и металлическое серебро должны быть соединены проводником. Через этот проводник электроны будут перемещаться от более активного к менее активному металлу. Таким образом, цинковый электрод станет анодом (А), а серебряный - катодом (К):
(-) A Zn - 2 е → Zn2+ - окисление, анодный процесс;
(+)К Ag+ + ~ё → Ag х 2 - восстановление, катодный процесс.
--------------------------------------------------------
Zn + 2Ag+ → Zn2+ + 2Ag - суммарная реакция.
Электрические полюса ("+" или "-") самопроизвольно возникают на электродах. Они могут быть определены по относительному положению металлов в ряду напряжений. Более активный металл (расположенный выше или левее) заряжен отрицательно относительно менее активного (расположенного ниже или правее).
ЭДС гальванического элемента (^Е) равна разности электродных потенциалов катода (Ек) и анода (ЕА): ^ Е = ЕК - ЕА
Контрольные задания №№ 1-15
Что представляет собой ряд напряжений металлов? Как изменяется восстановительная активность металлов и окислительная активность их ионов в ряду напряжений? Дайте определение химического источника тока.
Для вашего номера задания:
а) Укажите стрелкой направление реакции замещения. Ответ обоснуйте (см. ряд напряжений).
б) Составьте схему гальванического элемента, определите
анод и катод, запишите электродные процессы и вычислите
стандартное значение ЭДС, если электродами служат указанные
металлы.
1. a) 3CuCl2 + 2А1 = 2А1С13 + 3Cu
б) цинк и марганец, погруженные в раствор своих солей
2. a) Zn(N03)2 + 2Ag = 2AgN03 + Zn
б) кадмий и хром, погруженные в растворы своих солей
3. a) FeCl2 + Сu = СuС12 + Fe
б) железо и никель, погруженные в растворы своих солей
4. a) FeCl2 + Sn = SnCl2 + Fe
б) кобальт и медь, погруженные в растворы своих солей
5. а) Н2 + ZnCl2 = 2HC1 + Zn
б) олово и медь, погруженные в растворы своих солей
6. а) Сu (N03)2 + 2Ag = 2AgN03 + Сu
б) медь и ртуть, погруженные в растворы своих солей
7. a) 2AgN03 + Pb = Pb(N03)2 + 2Ag
б) железо и олово, погруженные в растворы своих солей
8. a) CuS04 + Ni = NiS04 + Сu
б) свинец и серебро, погруженные в растворы своих солей
9. a) Mg(N03)2 + Zn = Zn(N03)2 + Mg
б) серебро и цинк, погруженные в растворы своих солей
10. a) Hg (N03)2 + 2Ag = 2AgN03 + Hg
б) железо и марганец, погруженные в растворы своих солей.
11. a) FeCl2 + Sn = SnCl2 + Fe
б) кобальт и медь, погруженные в растворы своих солей
12. а) Н2 + ZnCl2 = 2HC1 + Zn
б) олово и медь, погруженные в растворы своих солей
13. а) Сu (N03)2 + 2Ag = 2AgN03 + Си
б) медь и ртуть, погруженные в растворы своих солей
14. a) Mg(N03)2 + Zn = Zn(N03)2 + Mg
б) серебро и цинк, погруженные в растворы своих солей
15. a) Zn(N03)2 + 2Ag = 2AgN03 + Zn
б) кадмий и хром, погруженные в растворы своих солей
Пример
Дано:
a) FeCl2 + Sn = SnCl2 + Fe
б) кобальт и медь, погруженные в растворы своих солей
Ответ :
a) FeCl2 + Sn = SnCl2 + Fe
Из таблицы Стандартных электродных потенциалов видно, что железо расположено выше олова в ряду напряжений - следовательно, более активен как восстановитель. Поэтому данная реакция должна самопроизвольно протекать в направлении образования металлического олова:
FeCl2 + Sn 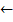 SnCl2 + Fe
SnCl2 + Fe
б) кобальт и медь, погруженные в растворы своих солей
Схема гальванического элемента, образованного кобальтовым и медным электродами, погруженными в растворы соответствующих нитратов, выглядит так:
(-) Co | CoSO4 || Cu(NO3)| Cu (+)
Эта схема записывается в ионном виде
(-) Сo | Co2+ || Cu2+ | Cu(+)
Кобальт в ряду напряжений расположен до меди, следовательно, более активен. Поэтому в основе работы данного гальванического элемента лежит реакция:
Co + Cu2+ → Co2+ + Cu
Реакция пойдет лишь при условии, что внешняя цепь будет замкнута, т.е. кобальт и медь должны быть соединены проводником. Через этот проводник электроны будут перемещаться от более активного к менее активному металлу. Таким образом, кобальтовый электрод станет анодом (А), а медный - катодом (К):
(-) A Co - 2 е → Co2+ - окисление, анодный процесс;
(+) К Cu2+ + 2ё → Cu - восстановление, катодный процесс.
Co + Cu2+ → Co2+ + Cu - суммарная реакция.
Электрические полюса ("+" или "-") самопроизвольно возникают на электродах. Они могут быть определены по относительному положению металлов в ряду напряжений. Более активный металл (расположенный выше или левее) заряжен отрицательно относительно менее активного (расположенного ниже или правее).
ЭДС гальванического элемента ( ^ Е) равна разности электродных потенциалов катода (Ек) и анода (ЕА): ^ Е = ЕК - ЕА ; ^ Е = ^ Е0 = Е0к - Е0А
Стандартные значения Ек и ЕА находим по таблице Стандартных электродных потенциалов
Е0к = +0,34
Е0А = -0,28
Следовательно, стандартная ЭДС данного элемента равна
^ Е = ^ Е0 = Е0к - Е0А = +0,34 - (-0,28) =0,62В.
Тема №5
Дата добавления: 2018-11-24; просмотров: 324; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
