Глава 7. Основы молекулярно-кинетической теории
Контрольные вопросы
1. Сформулируйте основные положения молекулярно-кинетической теории. Какими опытными данными они подтверждаются?
2. Что такое процесс? Перечислите изопроцессы и запишите законы, которыми они описываются.
3. Сформулируйте и поясните закон Авогадро. Что означает число Авогадро и чему оно равно?
4. Какой газ называется идеальным? Запишите уравнение состояния идеального газа.
5. Запишите и поясните основное уравнение МКТ. Какие следствия из него вытекают?
6. Что дает распределение Максвелла и какой физический смысл функции этого распределения?
7. Проанализируйте график функции распределения Максвелла.
8. Что дает барометрическая формула? Запишите ее.
9. Запишите распределение Больцмана и поясните его физический смысл.
10. Что такое длина свободного пробега молекулы? Чему она равна?
11. Назовите явления переноса в газах и запишите их экспериментальные законы.
Основные формулы
Экспериментальные газовые законы:
а) Бойля - Мариотта (изотермический процесс, Т = const)
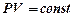 ;
;
б) Гей-Люссака (изобарический процесс, P = const)
 ;
;
в) Шарля (изохорический процесс, V = const)
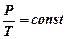 ;
;
г) Дальтона
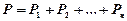 ;
;
давление смеси газов равно сумме парциальных давлений.
д) Авогадро: моли различных газов при одинаковых температуре и давлении занимают один и тот же объем.
е) Объединенный газовый закон:

Уравнение Менделеева - Клапейрона (уравнение состояния идеального газа)
|
|
|
 ,
,
где m - масса газа; m - молярная масса газа; R = 8,31 Дж/K×моль - универсальная газовая постоянная.
Основное уравнение молекулярно-кинетической теории
 ,
,
где Ек - кинетическая энергия поступательного движения частиц,
или 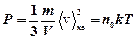 ,
,
где 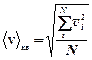 - средняя квадратичная скорость; k =1,38×10-23 Дж/К; n 0 - число молекул в единице объема.
- средняя квадратичная скорость; k =1,38×10-23 Дж/К; n 0 - число молекул в единице объема.
Среднее число столкновений каждой молекулы за единицу времени
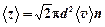 ,
,
где d - эффективный диаметр молекул газа (табличная величина).
Среднее число столкновений молекул в единице объема за единицу времени
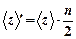 .
.
Среднее число столкновение всех молекул за единицу времени
 ,
,
где N – общее число молекул.
Средняя длина свободного пробега молекул газа

Методические указания
1. Уравнение состояния идеального газа применимо к реальным газам при условиях, близким к нормальным (t 0 = 0оC, P 0 = 1,01×105 Па), а также к разряженным газам. При больших давлениях (P > 107 Па) или при слишком низких температурах реальные газы уравнению Менделеева - Клапейрона не подчиняются.
2. Следует помнить, что молярная масса. выраженная в граммах, численно равна атомной (молекулярной) массе в а.е.м. , взятой из таблицы Менделеева.
|
|
|
3. Быстрота движения частиц газа характеризуется средней скоростью - 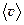 , средней квадратичной скоростью -
, средней квадратичной скоростью -  , и наиболее вероятной скоростью – vв. Причем
, и наиболее вероятной скоростью – vв. Причем 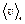 :
: 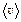 :
: 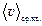 = 1,41 : 1,60 : 1,73. Средней квадратичной скоростью пользуются, когда находится физическая величина, пропорциональная квадрату скорости (например, Ек, Р). Средняя скорость используется при вычислении среднего числа столкновений, среднего времени пробега, длины свободного пробега. Наиболее вероятная скорость используется в задачах на закон распределения молекул по скоростям. Закон распределения молекул по скоростям и основное уравнение МКТ справедливы только для идеального газа.
= 1,41 : 1,60 : 1,73. Средней квадратичной скоростью пользуются, когда находится физическая величина, пропорциональная квадрату скорости (например, Ек, Р). Средняя скорость используется при вычислении среднего числа столкновений, среднего времени пробега, длины свободного пробега. Наиболее вероятная скорость используется в задачах на закон распределения молекул по скоростям. Закон распределения молекул по скоростям и основное уравнение МКТ справедливы только для идеального газа.
ЗАДАЧИ
134. Какой объем занимают 10 г кислорода при давлении 100 кПа и температуре 20оС?
[7,6·10-3 м3]
135. Баллон объемом 12 л наполнен азотом при давлении 8,1 МПа и температуре 17оС. Какая масса азота находится в баллоне?
[1,13 кг]
136. Каким должен быть наименьший объем баллона, вмещающего 6,4 кг кислорода, если его стенки при 20оС выдерживают давление 15,7 МПа?
[31·10-3 м3]
137. В баллоне находилось 10 кг газа при давлении 10 МПа. Какую массу газа взяли из баллона, если давление стало равным 2,5 МПа? Температуру газа считать постоянной.
[7,5 кг]
138. Найти массу воздуха, заполняющего аудиторию высотой 5 м и площадью пола 200 м2, при давлении воздуха 100 кПа и температуре в помещении 17оС. Молярная масса воздуха равна
0,029 кг/моль.
|
|
|
[1,2 т]
139. 5 г азота, находящиеся в закрытом сосуде объемом 4 л при температуре 20оC, нагревают до температуры 40оС. Найти давления газа до и после нагревания.
[108 кПа; 116 кПа]
140. Найти плотность водорода при 15оС и давлении 97,3 кПа.
[0,081 кг/м3]
141. Некоторый газ при 10оС и давлении 200 кПа имеет плотность 0,34 кг/м3. Найти молярную массу газа.
[0,004 кг/моль]
142. 12 г газа занимают объем 4 л при 7оС. После нагревания газа при постоянном давлении его плотность стала равной 0,6 кг/м3. До какой температуры нагрели газ?
[1400 К]
143. В запаянном сосуде находится вода, занимающая объем, равный половине сосуда. Найти давление и плотность водяного пара при 400оС, зная, что при этой температуре вся вода обращается в пар.
[155 МПа; 0,5·103 кг/м3]
144. В первом сосуде объемом 3 л находится газ под давлением 0,2 МПа. Во втором сосуде объемом 4 л находится тот же газ под давлением 0,1 МПа. Температуры газа в обоих сосудах одинаковы. Под каким давлением будет находиться газ, если соединить сосуды?
[143 кПа]
145. В сосуде объемом 2 л находиться 6 г углекислого газа и 10 г закиси азота (N2O) при температуре 127оС. Найти давление смеси в сосуде.
|
|
|
[604 кПа]
146. В воздухе содержится 23.6 % кислорода и 76.4 % азота (по массе) при давлении 100 кПа и температуре 13оС. Найти плотность воздуха и парциальные давления кислорода и азота.
[1,2 кг/м3; 21 кПа; 79 кПа]
147. В сосуде находиться 10 г углекислого газа и 15 г азота. Найти плотность смеси при 27оС и давлении 150 кПа.
[1,98 кг/м3]
148. В сосуде объемом 4 л находится 1г водорода. Какое число молекул содержит единица объема сосуда?
[7,5·1025 м-3]
149. Какое число молекул находится в комнате объемом 80 м3 при 17оС и давлении 100 кПа?
[2·1027]
150. В сосуде находится количество 10-7 молей кислорода и
10-6 г азота. Температура смеси 100оС, давление в сосуде 133 мПа. Найти объем сосуда, парциальные давления кислорода и азота и число молекул в единице объема.
[3,2 л; 98 мПа; 35 мПа; 2,6×1019 м-3]
151. Найти число молекул водорода в единице объема сосуда при давлении 266,6 Па, если средняя квадратичная скорость его молекул составляет 2,4 км/с.
[4,2·1022 м-3]
152. Плотность некоторого газа равна 0,06 кг/м3, средняя квадратичная скорость его молекул 500 м/с. Найти давление, которое газ оказывает на стенки сосуда.
[5 кПа]
153. Средняя квадратичная скорость молекул некоторого газа
450 м/с. Давление газа 50 кПа. Найти плотность газа при этих условиях.
[0,74 кг/м3]
154. Найти среднюю длину свободного пробега молекул воздуха при нормальных условиях. Диаметр молекул воздуха равен 0,3 нм.
[93 нм]
155. В сосуде объемом 0,5 л находится кислород при нормальных условиях. Найти общее число столкновений между молекулами кислорода в этом объеме за единицу времени.
[3·1031 с-1]
156. В сосуде объемом 100 см3 находится 0,5 г азота. Найти среднюю длину свободного пробега молекул азота.
[23 нм]
157. Найти среднее время между двумя последовательными столкновениями молекул азота при давлении 133 Па и температуре 10оС.
[1,6·10-7 с]
158. Какое давление надо создать внутри сферического сосуда, чтобы молекулы не сталкивались друг с другом?, если диаметр сосуда: а) D = 1 см; б) D = 10 см; в) D = 100 см? Диаметр молекул газа равен 0,3 нм.
[931 мПа; 93,1 мПа; 9,31 мПа]
159. Найти среднее число столкновений в единицу времени молекул некоторого газа, если средняя длина свободного пробега 5 мкм, а средняя квадратичная скорость его молекул 500 м/с.
[9,2·107 с-1]
Дата добавления: 2018-11-24; просмотров: 185; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
