Измерение электродных потенциалов
Потенциал стандартного водородного электрода при всех температурах принят равным нулю, тогда электродный потенциал любого другого электрода можно определить как ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного. В схеме цепи слева записывают водородный электрод. Так, для определения электродного потенциала медного электрода составляют элемент:
Pt, H2│H+ ║Cu2+│Cu
Из опыта известно, что в такой системе медный электрод является положительным (на нем самопроизвольно протекает реакция восстановления меди Cu+2 +2e- = Cu), а водородный электрод – отрицательным. ЭДС этого элемента, представленная в виде алгебраической суммы электродных потенциалов, равна:
 2.5
2.5
При 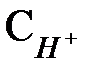 = 1 моль× л-1 и
= 1 моль× л-1 и 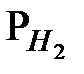 = 1 атм (т.е. при использовании стандартного водородного электрода)
= 1 атм (т.е. при использовании стандартного водородного электрода) 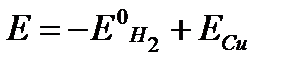 . Принимая во внимание, что
. Принимая во внимание, что 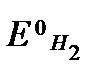 = 0, получаем E = ECu. Таким образом ЭДС этого гальванического элемента (а значит и электродный потенциал меди) положительны (E = ECu > 0) .
= 0, получаем E = ECu. Таким образом ЭДС этого гальванического элемента (а значит и электродный потенциал меди) положительны (E = ECu > 0) .
Для нахождения знака электродного потенциала цинкового электрода составляют элемент:
Pt, H2│H+ ║ Zn2+│Zn.
Из опыта известно, что цинковый электрод является отрицательным (на нем протекает реакция окисления цинка , ЕZn < 0), тогда водородный электрод будет положительным относительно цинкового(протекает реакция восстановления). ЭДС элемента E, представленная в виде алгебраической суммы электродных потенциалов, равна:
.
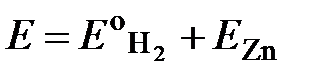 , учитывая, что
, учитывая, что  получаем E = - ЕZn.
получаем E = - ЕZn.
Значит, ЭДС этого элемента (т.е. электродный потенциал цинка) отрицательна. Таким образом, электродный потенциал металла численно равен ЭДС (со знаком ²+² или ²-²) гальванического элемента, составленного из стандартного водородного электрода (слева) и исследуемого электрода (справа).
Электрохимический (гальванический) элемент
Реальный гальванический элемент представляет собой цепь из нескольких последовательно соединенных проводников, включающую проводники второго рода – растворы электролитов. Если на концах разомкнутой цепи находятся одинаковые проводники, цепь называют правильно разомкнутой, в противном случае она разомкнута неправильно.
В простейшем случае электрохимический элемент состоит из двух металлических электродов различной природы, погруженных в растворы их солей. Химические реакции, при которых происходит межфазный обмен электронами, называются электрохимическими, или электродными реакциями. В гальваническом элементе окислительно-восстановительная реакция протекает по электрохимическому механизму благодаря тому, что электродные процессы пространственно разделены, а каждый из электродов контактирует с электролитом, что обеспечивает замкнутость общей цепи.
Рассмотрим процессы, протекающие в медно-цинковом гальваническом элементе (элементе Даниэля - Якоби, рис. II.5), составленном из двух электродов: цинковый электрод помещен в раствор ZnSO4, медный - в раствор CuSO4. При разомкнутой внешней цепи на электродах устанавливаются равновесные электродные потенциалы. Если соединить электроды проводником I рода (например, медным проводом), а растворы солей соединить проводником II рода (стеклянной трубкой, заполненной раствором электролита KCI), то электродные потенциалы изменятся по сравнению с их равновесными значениями. Цинк обладает большей способностью окисляться, чем медь.
За счет переноса электронов по внешней цепи от отрицательного цинкового электрода к положительному медному происходит смещение электродных равновесий.
При схематической записи гальванического элемента слева располагают отрицательный электрод(анод),на котором идет реакция окисления.

Рис. 2.5. Гальванический элемент Даниэля-Якоби
Запишем схему медно-цинкового электро электрохимического элемента:
(-)Cu│Zn│ZnSO4 ¦ KCl¦ СuSO4│Cu(+) 2.6
анод катод
Вертикальной сплошной чертой обозначены границы раздела фаз, на которых возникают скачки потенциалов, границы между электролитами обычно обозначают пунктирной вертикальной чертой. После замыкания цепи на поверхности медного электрода протекает восстановление ионов меди
Cu2+ + 2e- ® Cu,
а на поверхности цинкового - окисление металлического цинка и переход его в виде ионов в раствор:
Zn - 2e- ® Zn2+.
Складывая, получим суммарное химическое превращение:
Zn + Cu2+ ® Zn2+ + Cu.
Разность потенциалов можно измерить, если цепь проводников правильно разомкнута. Разность потенциалов на концах равновесной гальванической цепи называется ее электродвижущей силой (ЭДС), обозначаемой Е. Если на некоторых межфазных границах (хотя бы на одной) равновесие не устанавливается, то разность потенциалов на концах цепи не равна ЭДС.
Гальванический элемент производит работу за счет самопроизвольных окислительно-восстановительной реакции и поэтому его ЭДС однозначно связана с изменеием свободной энергии Гиббса в ходе соответствующей химической реакции. Величина nFE характеризует максимальную электрическую работу, которую можно получить при помощи электрохимической цепи. Знак ЭДС устанавливается по значению потенциала правого электрода относительно левого. Положительному значению ЭДС соответствует самопроизвольно протекающая реакция.
Таким образом, для определения ЭДС из численного значения электродного потенциала правого электрода (положительного) следует вычитать численное значение потенциала левого электрода (правило ²правого полюса²).
ЭДС элемента Даниэля - Якоби равна:
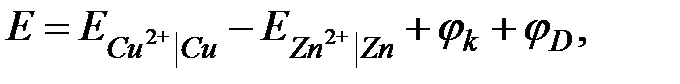
где jk - скачок потенциала на границе контакта двух металлических проводников (если цепь составлена по схеме 2.4, то этот потенциал равен нулю); jD - скачок потенциала на границе раздела проводников второго рода: раствор ZnSO4 │ раствор KCl │ раствор CuSO4. На этих границах раздела возникают двойные электрические слои. Однако подвижности ионов К+ и Cl- близки, поэтому эти скачки потенциала пренебрежимо малы. Практически ЭДС гальванического элемента равна:
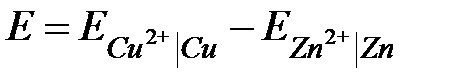 .
.
Подставив в последнее выражение электродные потенциалы, вычисленные по уравнению Нернста (формула II.3), получим:
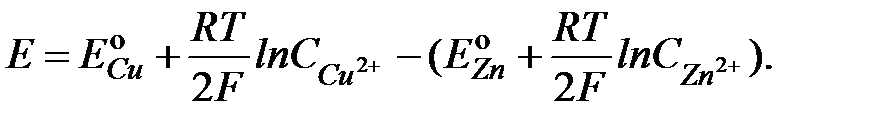 2.7
2.7
Обозначив 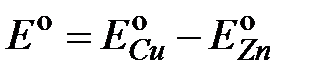 и подставив
и подставив 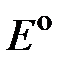 в 2.6, получим уравнение для расчета ЭДС медно-цинкового гальванического элемента:
в 2.6, получим уравнение для расчета ЭДС медно-цинкового гальванического элемента:
 , 2.8
, 2.8
где Е° - стандартное значение ЭДС., равное ЭДС такого гальванического элемента, в котором электроды помещены в растворы электролитов с концентрациями 1 моль×л-1. Стандартный электродный потенциал медного электрода при 298 К равен 0.337 В, а стандартный электродный потенциал цинкового электрода при этих же условиях равен -0.763 В Тогда стандартное значение ЭДС медно-цинкового элемента (2.4), с учетом знаков стандартных электродных потенциалов меди и цинка, равно:
Е° = 0.337-(-0.763) = 1.1 В.
Дата добавления: 2018-04-15; просмотров: 655; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
