Окислительно-восстановительные электроды и их потенциалы
Существуют такие электроды, реакции на которых не связаны с выделением из электролита или растворением в нем простых веществ. При этом обязательные для электрохимических реакций получение или отдача электродами электронов происходит за счет изменения степени окисления ионов в растворе.
Если электрод из инертного металла (например, платиновый) помещен в раствор, содержащий одновременно окисленную и восстановленную форму одного или нескольких веществ, на платиновом электроде возникает потенциал, который называют окислительно-восстановительным (ОВ) или редокс-потенциалом. Этот потенциал возникает за счет того, что в результате ОВ-реакции, протекающей в приэлектродном пространстве, электроны от восстановленной формы адсорбированных катионов частично переходят к металлу, и на электроде со временем устанавливается равновесие
Охn+ + ne- == Red.
Величина электродного ОВ-потенциала Er определяется соотношением концентраций окисленной СОх и восстановленной СRed форм вещества:
 ,
,
где Er° - стандартный редокс-потенциал; n - число электронов, передаваемых с донора (Red) на акцептор (Ох) в элементарном акте; CОх и CRed - концентрации окисленной и восстановленной форм, соответственно.
Механизм возникновения редокс-потенциала удобно рассмотреть на примере системы, состоящей из платинового электрода и растворов, содержащих ионы железа в различных степенях окисления (Fe2+ и Fe3+). При погружении платины в раствор, содержащий избыток окисленной формы, когда C(Fe3+) >> C(Fe2+), поверхность электрода заряжается положительно. При избытке восстановленной формы, когда C(Fe3+) << C(Fe2+), поверхность платины заряжается отрицательно, т.к. на ионы Fe3+ с определенной скоростью переходят электроны от платины, на которую, в свою очередь, переносятся электроны от ионов Fe2+. Скорость перехода электронов из платины в раствор к ионам Fe3+ постепенно уменьшается по мере роста положительного заряда поверхности платины, а скорость перехода электронов в обратном направлении возрастает. И наоборот, скорость переноса электронов из раствора от ионов Fe2+ к металлу постепенно уменьшается по мере роста отрицательного заряда поверхности платины, а скорость перехода электронов в обратном направлении возрастает. В результате со временем устанавливается равновесие, которое характеризуется равенством скоростей прямого и обратного процессов.
|
|
|
Передача электронов с одного иона на другой через инертный металл приводит к появлению электрического заряда на поверхности электрода и образованию двойного электрического слоя. Принципиально возможен и прямой межионный обмен электронами в растворе. Но ионы Fe2+ и Fe3+ сольватированы различным образом, и для переноса электрона необходимо преодолеть значительный энергетический барьер, а для перехода электрона от Fe2+ на инертный металл и с поверхности металла к иону Fe3+ требуется существенно меньшая энергия активации.
|
|
|
Стандартным редокс-потенциалом называют потенциал, возникающий на границе раздела инертный электрод - раствор при равенстве концентраций в этом растворе окисленной и восстановленной форм вещества.
Стандартный редокс-потенциал характеризует относительную окислительную способность ОВ-системы. Система, редокс-потенциал которой больше, является окислителем по отношению к системе с меньшим потенциалом.
Мембранные равновесия. Стеклянный электрод
Особый вид электрохимического равновесия между двумя жидкими фазами (электролитами), разделенными мембраной, может возникать в тех случаях, когда мембрана непроницаема для некоторых из ионов, на которые диссоциируют растворенные вещества.
Равновесия этого типа называются мембранными и они могут характеризоваться разностью электрических потенциалов. Примером использования мембранных равновесий может служить стеклянный электрод.
|
|
|
Стеклянный электрод (рис. II.8) представляет собой тонкостенный стеклянный шарик, заполненный буферным раствором с определенным значением рН, в который помещен электрод (обычно хлорсеребряный). Для измерения рН стеклянный электрод погружают в исследуемый раствор в паре с электродом сравнения, например, хлорсеребряным. Таким образом получают гальванический элемент:
| Ag,AgCl | Cl-, раствор с определенным pH | Стекло | Раствор с неизвестным рН | Cl- | Ag,AgCl |
ЭДС этого элемента включает в себя скачки потенциала на границах стекло - раствор. Шарик стеклянного электрода предварительно обрабатывается в течение длительного времени раствором кислоты. При этом ионы водорода внедряются в стенки стеклянного шарика, замещая катионы щелочного металла. После такой обработки шарик можно рассматривать как "насыщенный" ионами водорода. Стеклянный электрод отличается от уже рассмотренных электродов тем, что в электродной реакции не участвуют электроны. Электродный процесс в этом электроде сводится к обмену ионами между двумя фазами - исследуемым раствором и стеклом:
H+р-р == H+cтекло.
Заряд водородного иона соответствует элементарному положительному количеству электричества, и переход иона водорода из одной фазы в другую эквивалентен перемещению единичного заряда, т.е. в уравнении Нернста при расчете величины скачка потенциала на границе стекло - раствор n=1.
|
|
|
 .
.
В кислых, нейтральных и слабощелочных растворах (до рН = 10-12) концентрация ионов водорода в стекле велика и практически постоянна, поэтому
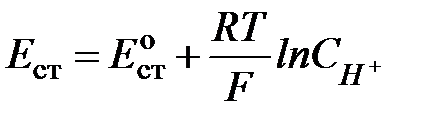 , или
, или 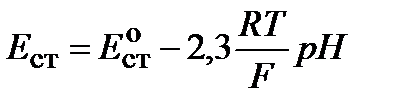 ,
,
т.е. потенциал электрода зависит только от концентрации ионов водорода, поэтому стеклянный электрод может быть использован для определения рН.
Потенциалы на каждой из поверхностей стеклянного шарика определяются соответствующими реакциями обмена, зависящими от состава стекла и рН раствора. Потенциал на внутренней стороне стеклянного шарика постоянен, поэтому потенциал стеклянного электрода зависит только от рН внешнего раствора.
В связи с тем, что концентрации ионов водорода на разных поверхностях стеклянного шарика при одинаковых рН растворов неодинаковы, возникает дополнительная разность потенциалов, называемая потенциалом асимметрии стеклянного электрода. При работе с этим электродом необходимо вводить поправку - производить корректировку шкалы потенциометра с помощью раствора с известным рН.
|
|
Стеклянный электрод прост в обращении, он не загрязняет исследуемый раствор и позволяет определять рН в сильно окислительных средах, отравляющих другие электроды. Недостатками стеклянного электрода являются его хрупкость и непригодность использования для определения рН сильнощелочных растворов.
 Мы поможем в написании ваших работ! |

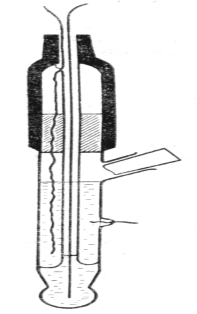 Рис. 2.8. Стеклянный электрод
Рис. 2.8. Стеклянный электрод