Кислотно-основные буферные системы
В 0.001 М растворе HCl концентрация ионов водорода СН+ =10–3 моль× л-1, рН = 3. При разбавлении этого раствора в 10 раз концентрация Н+ также уменьшится в 10 раз и станет равной 10–4 моль× л-1, тогда рН = 4. При добавлении к исходному раствору HCl более концентрированного раствора этой кислоты, например, равного объема 0.2 М раствора HCl, концентрация Н+ во вновь полученном растворе увеличится:
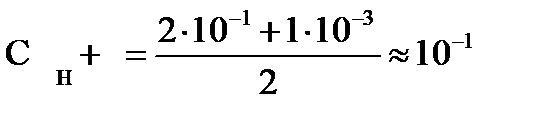 , рН » 1.
, рН » 1.
При добавлении к 0.001 М раствору HCl эквивалентного количества NaOH полученная смесь станет нейтральной, а значение С(Н +) изменится до 10–7 моль× л-1 (рН = 7).
Следовательно, если к разбавленным растворам сильных кислот или оснований добавлять воду, кислоту или щелочь, то происходит изменение концентраций (активностей) ионов Н + и ОН –, а значит, и значений рН и рОН. Однако, в смесях водных растворов слабых кислот и их солей, а также в смесях слабых оснований и их солей концентрации ионов водорода и гидроксила зависят не от абсолютных количеств, а от соотношения концентраций кислоты или основания и их солей. Это означает, что С(Н+) в таких смесях не зависит от их разбавления. В самом деле, если подобную смесь разбавить в 10 раз, то в 10 раз уменьшатся концентрации компонентов смеси, а соотношение концентраций кислоты или основания и их солей не изменится, и значение С(Н+) а значит, и рН смеси останется постоянным. Свойство некоторых систем (жидких смесей) сохранять неизменной концентрацию ионов водорода при разбавлении, а также при добавлении к ним небольших количеств сильных кислот или щелочей, называется буферным действием, а системы, оказывающие буферное действие, называются буферными.
|
|
|
Буферные системы можно рассматривать как смеси электролитов, имеющих одноименные ионы, при этом присутствие в системе слабой кислоты или слабого основания и их солей уменьшает влияние разбавления или действие других кислот и оснований на рН раствора.
Все существующие буферные системы можно разделить на 4 типа:
Слабая кислота и ее анион (ацетатная буферная система CH3COOH+ CH3COONa).
Слабое основание и его катион (аммиачная буферная система NH3 /NH4+ в водном растворе NH3 и NH4Cl). Растворение аммиака в воде можно представить схемой:
NH3 + H2O ® NH3 × H2O  ↔ NH4OH ↔ NH4+ + OH -,
↔ NH4OH ↔ NH4+ + OH -,
поэтому водный раствор аммиака обладает свойствами слабого основания и одновременно содержит молекулярные частицы NH3 и NH4OH, ионы NH4+ и OH -.↔
Анионы кислой и средней соли или двух кислых солей (карбонатная Na2CO3 + NaHCO3 или фосфатная Na2HPO4 + NaH2PO4 буферные системы).
Ионы и молекулы амфолитов (аминокислотные и белковые буферные системы).
Механизм буферного действия
Действие буферных систем основано на том, что компоненты буферных смесей связывают ионы водорода или гидроксила вводимых в них кислот или оснований с образованием слабых электролитов. Например, если добавить сильное основание к буферной системе, содержащей слабую кислоту HАn и соль этой кислоты KtAn, то образуется слабый электролит – вода.
|
|
|
Убыль ионов водорода сдвигает равновесие реакции диссоциации слабой кислоты в сторону образования ионов, дополнительная диссоциация слабой кислоты HАn скомпенсирует убыль ионов водорода, и в результате концентрация ионов СН + в буферной системе сохранится на прежнем уровне или незначительно изменится.
Если к буферной смеси (HАn + KtAn) добавить сильную кислоту, произойдет реакция образования молекулы слабой кислоты:
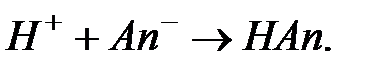
Относительное уменьшение концентрации ионов водорода будет при этом невелико, поскольку и первоначальная концентрация этих ионов мала из-за малой степени диссоциации слабой кислоты. Подобным образом можно объяснить и действие других буферных систем.
Если компонентами буферной системы являются слабая кислота и хорошо диссоциирующая соль этой кислоты, значение рН такой буферной системы можно рассчитать по уравнениям:
СН +=К А *(Скисл /Ссоли )
pH= -lgKA - lg(Cкислоты /Cсоли) , или
|
|
|
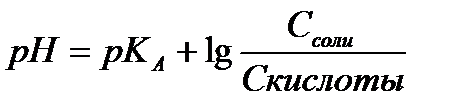 , 2.18
, 2.18
где 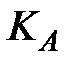 – константа диссоциации слабой кислоты. Если в буферной системе
– константа диссоциации слабой кислоты. Если в буферной системе 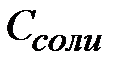 =
= 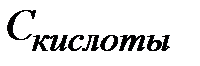 , то численно
, то численно 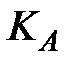 = СН+. Например, при 25оС для уксусной кислоты KA= 1.8 ×10-5, тогда при равных концентрациях кислоты и соли СН+=1.8 ×10-5, и рН = - lg СН + » - (0.26 - 5) = 4.74.
= СН+. Например, при 25оС для уксусной кислоты KA= 1.8 ×10-5, тогда при равных концентрациях кислоты и соли СН+=1.8 ×10-5, и рН = - lg СН + » - (0.26 - 5) = 4.74.
Если буферная смесь состоит из 18 мл 0.1 М раствора уксусной кислоты и 2 мл 0.1 М раствора ацетата натрия, согласно (II.18)
СН+= 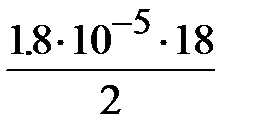 =1.62 ×10-4, и рН » - (0.21 - 4) = 3.79.
=1.62 ×10-4, и рН » - (0.21 - 4) = 3.79.
Основные буферные растворы содержат слабое основание (акцептор протонов) и соль этого основания (донор протонов). Для аммиачной буферной системы (водный раствор аммиака NH3*H2O + NH4Cl ).
pH = 14 + lg KB + lg (Cоснов./Cсоли ) 2.19
где рКВ – величина, численно равная отрицательному логарифму константы диссоциации КВ слабого основания. Из уравнений (2.18) и (2.19) следует, что рН буферной системы не зависит от разбавления водой, а определяется константой диссоциации слабой кислоты или слабого основания и отношением концентраций соль/кислота или соль/основание.
Буферная емкость
Способность буферных систем поддерживать постоянное значение рН небезгранична, она зависит от качественного состава системы и концентрации компонентов. При добавлении к буферной системе значительных количеств сильной кислоты или сильного основания наблюдается заметное изменение рН. Буферное действие отличающихся по составу буферных смесей неодинаково. Важной величиной, которая характеризует способность буферной системы противодействовать изменению реакции среды (т.е. изменению ее рН) при добавлении кислот или щелочей, вляется буферная емкостью системы.
|
|
|
Буферная емкость измеряется количеством кислоты или щелочи (моль), добавление которого к 1 литру буферной системы изменяет ее рН на единицу.
Величину буферной емкости системы по кислоте или по щелочи рассчитывают по формуле:
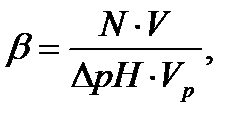 2.20
2.20
где N – концентрация (моль× л-1) добавленной кислоты (щелочи); V – объем (л) кислоты (щелочи); DрН – абсолютная величина изменения рН буферной системы в результате добавления кислоты (щелочи); Vр – объем буферной смеси (л).
Буферная емкость зависит от соотношения концентраций компонентов буферной системы, а следовательно, и от рН буфера.
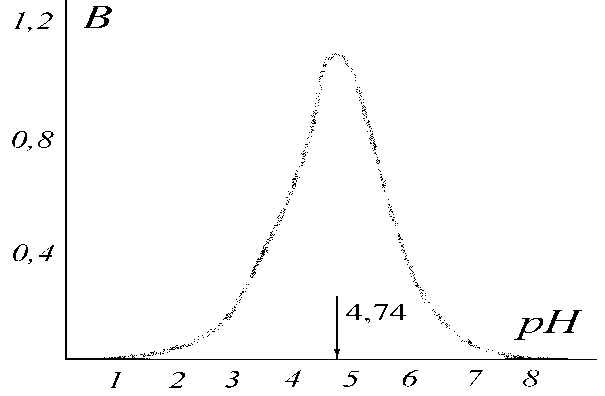
Типичный график зависимости буферной емкости от рН на примере ацетатной системы СН3СОО - / СН3СООН приведен на рис. II.9. Максимальная буферная емкость соответствует значению рН = рКА = 4,74, что следует из уравнения (II.18). При рН = рКА отношение Ссоль /Скислота = 1, т.е. в системе содержатся одинаковые количества соли и кислоты. При таком соотношении концентраций компонентов системы ее рН изменяется в меньшей степени, чем при других отношениях, следовательно, буферная емкость максимальна при равных концентрациях компонентов буферной системы и уменьшается с отклонением от этого соотношения. Из рис. II.9 следует и другой важный вывод: рабочий участок буферной системы, т.е. способность противодействовать изменению рН при добавлении кислот и щелочей, имеет протяженность приблизительно в одну единицу рН с каждой стороны от точки рН = рКА. Вне этого интервала буферная емкость быстро снижается. Интервал рКА ± 1 называется зоной буферного действия.
|
| Рис.2.9. Зависимость буферной емкости β ацетатной системы от рН
|
Работа 2.1. ИЗМЕРЕНИЕ ЭДС МЕДНО-ЦИНКОВОГО ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
ЦЕЛЬ РАБОТЫ: Измерить ЭДС медно-цинкового гальванического элемента, полученные значения ЭДС сопоставить с величинами, рассчитанными по формуле Нернста.
Оборудование: Электрохимическая (гальваническая) ячейка, медный и цинковый электроды, потенциометр (иономер).
Реактивы: растворы CuSO4 концентраций 0,01, 0,1 и 0,5 М, растворы ZnSO4 концентраций 0,01, 0,1 и 0,5 М, насыщенный раствор KCl, дистиллированная вода.
Порядок выполнения работы:
1. Подготовить для работы медно-цинковый гальванический элемент, налив в сосуд с медным электродом раствор CuSO4 нужной концентрации (по указанию преподавателя), а в сосуд с цинковым электродом – раствор ZnSO4.Стеклянный соединительный мостик заполнить насыщенным раствором KCl, избегая появления пузырьков воздуха.
2. Трижды измерить э.д.с. элемента иономером (потенциометром), пользуясь инструкцией к прибору и строго соблюдая полярность подключения электродов. Результаты измерений записать в таблицу 2.1.
3. Рассчитать стандартное значение ЭДС медно-цинкового элемента по данным справочника и Eрасч по уравнению Нернста..
Таблица 2.1.
Результаты определения ЭДС Cu- Zn элемента
| CuSO4 | ZnSO4 | Eизм. (в) | Eрасч. (в) | ||||
| C (моль*л-1) | γ± | a | C (моль*л-1) | γ± | a | ||
Работа 2.2. ИЗМЕРЕНИЕ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ МЕДНОГО И ЦИНКОВОГО ЭЛЕКТРОДОВ
ЦЕЛЬ РАБОТЫ: Измерить электродные потенциалы медного и цинкового электродов, полученные значения сопоставить с величинами, рассчитанными по формуле Нернста.
Оборудование: Электрохимическая (гальваническая) ячейка, медный, цинковый и хлорсеребряный электроды, потенциометр (иономер).
Реактивы: растворы CuSO4 концентраций 0,1 и 0,5 М, растворы ZnSO4 концентраций 0,1 и 0,5 М, насыщенный раствор KCl, дистиллированная вода.
Порядок выполнения работы:
Собрать гальванический элемент из цинкового и хлорсеребряного электродов
Ag │ AgCl │KCl нас.││ ZnSO4 │ Zn
и с помощью иономера (потенциометра) трижды измерить его ЭДС, результаты занести в табл.2.
Рассчитать величину электродного потенциала Zn электрода из полученного экспериментального значения ЭДС и значения потенциала хлорсеребряного электрода, вычисленного по формуле (II.17), результат записать в табл.2.
Определить потенциал Cu электрода, трижды измерив ЭДС гальванического элемента
Ag │ AgCl │KCl нас.││ CuSO4 │Cu
и рассчитать электродный потенциал Cu электрода, учитывая, что в данном гальваническом элементе медь является положительным электродом.
Записать электродные реакции, протекающие в гальванических элементах.
Таблица 2.2.
Результаты определения электродных потенциалов медного и цинкового электродов.
T0C = ______ , E Cl- │Ag+│ Ag = _______,B EAgCl = _______, B
| Электрод | MeSO4 | E г.э.(В) | ЕМе(изм.),В | ЕМе(выч..),В | ||
| C | γ± | a | ||||
| Zn+2/Zn | 0.1 | |||||
| 0.5 | ||||||
| Cu+2/Cu | 0.1 | |||||
| 0.5 | ||||||
Работа 2.3. ИЗМЕРЕНИЕ ЭДС КОНЦЕНТРАЦИОННЫХ ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
ЦЕЛЬ РАБОТЫ: Измерить ЭДС медно и цинкового концентрационных элементов, полученные значения ЭДС сопоставить с величинами, рассчитанными по формуле Нернста.
Оборудование: Электрохимическая (гальваническая) ячейка, медный и цинковый электроды, потенциометр (иономер).
Реактивы: растворы CuSO4 концентраций 0,01, 0,1 и 0,5 М, растворы ZnSO4 концентраций 0,01, 0,1 и 0,5 М, насыщенный раствор KCl, дистиллированная вода.
Порядок выполнения работы:
1. Подготовить одну из указанных концентрационных цепей:
(-) Zn | ZnSO4 || ZnSO4| Zn (+)
С1 С2
или
(-) Cu | CuSO4|| CuSO4 | Cu (+)
С1 С2
Концентрации электролитов: С1 = 0,1 моль× л-1, С2 = 1,0 моль× л-1.
2. Подключить концентрационный элемент к потенциометру (иономеру) и измерить его ЭДС.
3. Сравнить полученное значение ЭДС с ЭДС концентрационного элемента, рассчитанной по формуле:
Е = 2.303 (RT / nF) lg (а2 / а1) для комнатной температуры.
4. Результаты записать в табл.3
Таблица 2.3. Результаты
определения ЭДС концентрационных элементов.
| Элемент | МеSO4 | E г.э.(выч.), В | E г.э(изм), В | ||||||
| C1 | γ± | a± | C2 | γ± | a± | ||||
| Сu | |||||||||
| Zn | |||||||||
Работа 2.4. ИЗМЕРЕНИЕ
Дата добавления: 2018-04-15; просмотров: 562; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!