При твердении протекает реакция 12 страница
351. Какую массу Na3PO4, надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 мэкв/л? Ответ: 136,6 г.
352. Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния? Ответ: 2 мэкв/л.
353. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08 н раствора HCl. Ответ: 6 мэкв/л. ,
354. В 1 л воды содержится ионов магния 36,47 мг и ионов кальция 50,1 мг. Чему равна жесткость этой воды? Ответ: 5,5 мэкв/л.
355. Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 мэкв/л. Ответ: 63,6 г.
356. Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв. Какая масса сульфата магния содержится в 300 л этой воды? Ответ: 126,3 г.
357. Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбонате магния и 61,2 сульфата кальция. Ответ: 3,2 мэкв/л.
358. В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды? Ответ: 0,83 мэкв/л.
359.Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 мэкв. Какой объем 0,1 н раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды? Ответ: 3 см3.
|
|
|
360. В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. Ответ: 2,33 мэкв/л.
ТЕМА : р- Элементы (… ns 2 np 1-6 )
Контрольные вопросы
361. В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения: а) при взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
362. Почему фосфористая кислота способна к реакциям самоокисления — самовосстановления (диспропорционирования)? На основании электронных уравнений составьте уравнение процесса разложения H3PO3, учитывая, что при этом фосфор приобретает низшую и высшую степени окисления.
363. В каком газообразном соединении фосфор проявляет свою низшую степень окисления? Напишите уравнения реакций: а) получения этого соединения при взаимодействии фосфида кальция с хлороводородной (соляной) кислотой; б) горения его в кислороде.
364. Какую степень окисления проявляют мышьяк, сурьма и висмут? Какая степень окисления является более характерной для каждого из них? Составьте электронные и молекулярные уравнения реакций: а) мышьяка с концентрированной азотной кислотой; б) висмута с концентрированной серной кислотой.
|
|
|
365. Как изменяются окислительные свойства галогенов при переходе от фтора к йоду и восстановительные свойства их отрицательно заряженных ионов? Почему? Составьте электронные и молекулярные уравнения реакций:
а) С12 + I2 + H2O =; б) KI + Вr2 =. Укажите окислитель и восстановитель.
366. Составьте электронные и молекулярное уравнения реакции, происходящей при пропускании хлора через горячий раствор гидроксида калия. К какому типу окислительно-восстановительных процессов относится данная реакция?
367. Какие реакции нужно провести для осуществления следующих превращений:
NaCl → HCl → Cl2 → KСlO3
Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
368. К раствору, содержащему SbCl3 и BiCl3, добавили избыток раствора гидроксида калия. Напишите молекулярные и ионно-молекулярные уравнения происходящих реакций. Какое вещество находится в осадке?
369. Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия хлороводородной (соляной) и разбавленной серной кислот? Что является окислителем в первом случае, что — в двух других? Приведите примеры.
370. Напишите формулы и назовите кислородные кислоты хлора, укажите степень окисления хлора в каждой из них. Какая из кислот более сильный окислитель? На основании электронных уравнений закончите уравнение реакции:
|
|
|
KI + NaOCl + H2SO4 → I2 + ...
Хлор приобретает низшую степень окисления.
371. Какие реакции нужно провести, имея азот и воду, чтобы получить нитрат аммония? Составьте уравнения соответствующих реакций.
372. Какую степень окисления может проявлять кремний в своих соединениях? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Mg2Si → SiH4 → SiO2 → K2SiO3 → H2SiO3
При каком превращении происходит окислительно-восстановительная реакция?
373. Какое применение находит кремний? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
SiO2 → Si → K2SiO3 → H2SiO3
Окислительно-восстановительные реакции напишите на основании электронных уравнений.
374. Как получают диоксид углерода в промышленности и в лаборатории? Напишите уравнения соответствующих реакций и реакций, с помощью которых можно осуществить следующие превращения:
NaHCO3 → CO2 → CaCO3 → Ca(HCO3)2
375. Какие из солей угольной кислоты имеют наибольшее промышленное применение? Как получить соду, исходя из металлического натрия, хлороводородной (соляной) кислоты, мрамора и воды? Почему в растворе соды лакмус приобретает синий цвет? Ответ подтвердите составлением уравнений соответствующих реакций.
|
|
|
376. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al → Al2(SO4)3 → Na[Al(OH)4] → Al(NO3)3
377. Составьте электронные и молекулярные уравнения реакций: а) алюминия с раствором щелочи; б) бора с концентрированной азотной кислотой.
378. Какой процесс называется алюминотермией? Составьте электронные и молекулярные уравнения реакции, на которой основано применение термита (смесь Аl и Fe3O4).
379. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
B → H3BO3 → Na2B4O7 → H3BO3
Уравнение окислительно-восстановительной реакции составьте на основании электронных уравнений.
380. Какая степень окисления наиболее характерна для олова и какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с концентрированной азотной кислотой.
381. Чем можно объяснить восстановительные свойства соединений олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций: a) SnCl2 с HgCl2; б) РЬО2 с НС1 конц.
382. Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидрoксида натрия: а) с оловом; б) с гидроксидом свинца (II).
383. Какие соединения называются карбидами и силицидами? Напишите уравнения реакций: а) карбида алюминия с водой; б) силицида магния с хлороводородной (соляной) кислотой. Являются ли эти реакции окислительно-восстановительными? Почему?
384. На основании электронных уравнений составьте уравнение реакции фосфора с азотной кислотой, учитывая, что фосфор приобретает высшую, а aзот - степень окисления + 4.
385. Почему атомы большинства р-элементов способны к реакциям диспропорционироваиия (самоокисления — самовосстановления)? На основании электронных уравнений напишите уравнение реакции растворения серы в концентрированном растворе щелочи. Один из продуктов содержит серу в степени окисления +4.
386. Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций H2SO3: а) с сероводородом; б) с хлором.
387. Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
388. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций НNO2: а) с бромной водой; б) с HI.
389. Почему диоксид азота способен к реакциям самоокисления — самовосстановления (диспропорционирования)? На основании электронных уравнений напишете уравнение реакции растворения N02 в гидроксиде натрия.
390. Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной — с медью. Укажите окислитель и восстановитель.
ТЕМА : Минеральные вяжущие
Вяжущими материалами называются порошкообразные вещества, которые при затворении водой приобретают пластичные свойства, образуя постепенно твердеющее тесто, способное связывать отдельные куски или массу твердых пород в монолит.
Вяжущие материалы подразделяются на воздушные (при смешении с водой они затвердевают и длительное время сохраняют прочность только на воздухе) и гидравлические (могут затвердевать на воздухе и в воде). Поэтому воздушные вяжущие применяются в надземных сооружениях, а гидравлические – как в надземных, так и в подземных гидротехнических сооружениях.
Сырьем для производства вяжущих материалов служат природные горные породы: известково-глинистые (мергели), магнезиальные, карбонаты, кремнеземистые, гипс и другие, а также отходы некоторых производств: доменные шлаки, золы, фосфогипс и др.
Гипсовые вяжущие материалы
сырьем для производства является природный двуводный гипс СаSO4∙2Н2О, природный ангидрит СаSO4 и отход производства фосфорной кислоты – фосфогипс.
Получение строительного гипса основано на химической реакции
170-180°
СаSО4∙2Н2О → СаSО4∙0,5Н2О + 1,5 Н2О
При твердении протекает реакция
СаSО4∙0,5Н2О + 1,5 Н2О → СаSО4∙2Н2О
При t = 600-700°С образуется обожженный гипс, ангидритовый цемент.
При 800-1000°С получают высокообожженный гипс – эстрихгипс, который твердеет при затворении водой без катализатора, так как в нем присутствует примесь СаО, образовавшаяся в результате частичного разложения СаSО4.
В строительной технике гипсовые вяжущие широко применяются для изготовления блоков, панелей, перегородок, гипсобетона, сухой штукатурки, легковесных теплоизоляционных изделий. Заполнителями служат известь, шлак, пемза, мел, опилки и т.д. Все строительные изделия из гипса неводостойки и поэтому их применяют во внутренних элементах сооружений. Водостойкость повышают органические и минеральные добавки, а также водоотталкивающие обмазки.
Воздушная известь.
Воздушную известь получают путем обжига известняков, мела, доломитовых известняков, содержащих не более 8% примесей
900-1000°С
СаСО3 → СаО + СО2
Негашеную известь (СаО) – кипелку измельчают. При действии воды образуется известь гашеная СаО + Н2О → Са(ОН)2. Реакция сопровождается выделением тепла.
Известковое тесто, смешанное с песком, измельченным шлаком и т.п. применяют в виде строительных растворов при кладке стен и для штукатурки.
Известковый раствор на воздухе постепенно отвердевает под влиянием двух одновременно действующих факторов: удаления свободной воды и действия СО2. Удаление воды приводит к выделению и кристаллизации Са(ОН)2. В результате действия СО2 образуется карбонат кальция Са(ОН)2 + СО2 → СаСО3 + Н2О. Кристаллы срастаются между собой и с зернами наполнителя, образуя искусственный камень. Твердение воздушных известковых растворов протекает медленно и связано с протеканием реакции Са(ОН)2 + SіО2 → СаО∙SіО2∙Н2О, компоненты которой находятся в твердой фазе. Для ускорения этого процесса к извести добавляют цемент, гидравлические добавки или гипс.
Гидравлическая известь.
Гидравлическая известь, в отличие от воздушной, начав твердеть на воздухе, может продолжать твердение в воде. Способность гидравлической извести сохранять и увеличивать прочность в воде объясняется наличием в ее составе, кроме свободной СаО, силикатов, алюминатов и ферритов кальция, которые образуются при обжиге за счет реакций между глиной и известняком. Эти реакции, если глинистых примесей 6-20%, приводят к получению извести с гидравлическими свойствами. Гидравлическая известь оценивается по основному (гидравлическому) модулю m = 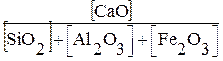 .
.
Для слабогидравлической извести он равен 4,5 – 9,0, сильногидравлической – 1,7 – 4,5, романцемента – 1,7.
Портландский цемент.
Наибольшее значение как вяжущий материал в строительстве имеет портландцемент – продукт помола клинкера, полученного обжигом до спекания смесей из известняков и глин, встречающихся в природе (мергели) или искусственно составленных. При помоле к клинкеру добавляется гипс (до 2%) для замедления схватывания и гидравлические добавки (до 15%), увеличивающие стойкость портландцемента к разрушающему действию природных вод. Химический состав портландцемента следующий: СаО – 62-67%, SiО2 – 20-24%, Al2О3 – 4-7%, Fe2О3 – 2,5%, MgO, SO3 и прочих 1,5-3%. Состав портландцемента выражают при помощи модулей основного, или гидравлического – Г, силикатного – n и глиноземистого – Р, соответственно определяемых:
Г = 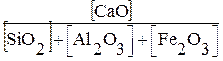 = 1,9
= 1,9 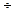 2,4;
2,4;
n = 
Р = 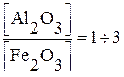 .
.
Оксиды связаны в клинкере в следующие минералы
3СаО∙SiO2 (C3S) – алит, 37 - 60%
2СаО∙SiO2 (C2S) – белит, 15 - 37%
3CaO∙Al2О3 (С3А) – трехкальциевый алюминат, 7 - 15%
4CaO∙Al2О3∙Fe2О3 (C4AF) – четырехкальциевый алюмоферрит, 10 - 18%
эти соединения реагируют при затворении цемента водой и дают различные гидраты, выделяющиеся в виде студней-гелей; они образуют пластичное тесто, которое затем схватывается и упрочняется в цементый камень
3СаО∙SiO2 + (n+1)H2O → 2 СаО∙SiO2· nH2O + Ca(OH)2
2СаО∙SiO2 + n H2O → 2 СаО∙SiO2 ·nH2O
3CaO∙Al2О3 + 6 H2O → 3CaO∙Al2О3∙6 H2O
4CaO∙Al2О3∙Fe2О3 + (m + 6)H2O → 3CaO∙Al2О3∙6 H2O + CaO∙Fe2О3∙mH2O
Ca(OH)2
→ 3(4)CaO∙Fe2О3∙xH2O
Глиноземистый цемент.
Глиноземистый цемент представляет собой продукт тонкого помола обожженной до плавления или до спекания сырьевой смеси, состоящей из боксита и известняка. Химический состав глиноземистого цемента следующий: около 40% СаО, около 40% Al2О3, остальное – примеси Fe2О3 (нежелательные) и др. оксиды СаО и Al2О3 находятся в глиноземистом цементе главным образом в виде минерала – однокальциевого алюмината СаО∙Al2О3. глиноземистый цемент быстро твердеет
2(СаО∙Al2О3) + 11Н2О → 2 Al(ОН)3 + 2СаО∙Al2О3∙8Н2О.
Уже на третий день твердения прочность его приближается к максимальной. Сооружения из глиноземистого цемента стойки к сульфатной коррозии, но не стойки в щелочных средах, в которых идет разрушение камня в результате взаимодействия Al2О3 и Al(ОН)3 со щелочами.
Магнезиальные цементы.
Активным началом магнезиальных цементов является оксид магния. Сырьем служат природный магнезит MgСО3 и доломит СаСО3∙MgСО3. В соответствии с этим различают два вида магнезиальных цементов – каустический магнезит, получаемый обжигом до полного удаления СО2 при 800-1000° С, и каустический доломит. В отличие от других вяжущих магнезиальные цементы затворяются не водой, а растворами солей MgCl2 или MgSO4, в некоторых случаях – серной или соляной кислотой. При твердении магнезиальных цементов происходит образование Mg(ОН)2 сначала в коллоидном, а затем в кристаллическом состоянии; частично образуется оксихлорид магния
mMgO + MgCl2 + pH2O → (MgO)m∙(MgCl2)∙(H2O)p.
Магнезиальное вяжущее находит применение в производстве ксилолита, фибролита (термоизоляционного, конструктивного и фибролитовой фанеры), пено- и газомагнезита, оснований под чистые полы и других строительных деталей.
Коррозия бетонов.
Камневидное тело портландцемента подвержено коррозии в водах, богатых углекислотой, солями постоянной жесткости СаSО4, MgSО4 и др.
 Са(ОН)2 + СО2 → СаСО3 + Н2О углекислотная
Са(ОН)2 + СО2 → СаСО3 + Н2О углекислотная
 коррозия
коррозия
сульфатная коррозия сопровождается образованием сульфоалюминатов, вызывающих местные напряжения за счет увеличения в объеме изделий, в объеме структуры последних.
Дата добавления: 2018-11-24; просмотров: 148; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
