При твердении протекает реакция 9 страница
P + HClO3 + H2O → H3PO4 + HCl
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O
232. См. условие задачи 222
NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O
FeS + HNO3 →Fe(NO3)2 + S + NO + H2O
233. Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
As3- → As5+; N3+ → N3-; S2-→ So
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
234. Исходя из степени окисления фосфора в соединениях РН3, H3РO4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
PbS + HNO3 → S + Pb(NO3)2 + NO + H2O
235. См. условие задачи 222.
P + HNO3 + H2O → H3PO4 + NO
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
236. Составьте электронные уравнения и укажите, какой процесс — окисление или восстановление — происходит при следующих превращениях:
Mn6+ → Mn2+; Cl5+ → Cl-; N3- → N5+
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Cu2O + HNO3 → Cu(NO3)2 + NO + H2O
237. См. условие задачи 222.
HNO3 + Ca → NH4NO3 + Ca(NO3)2 + H2O
K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 + H2O
238. Исходя из степени окисления хрома, йода и серы в соединениях K2Cr2O7, КI и Н2SО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте, коэффициенты в уравнении реакции, идущей по схеме
|
|
|
NaCrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O
239. См. условие задачи 222.
H2S + Cl2 + H2O → H2SO4 + HCl
K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
240. См. условие задачи 222.
KClO3 + Na2SO3 → KCl + Na2SO4
KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O
ТЕМА: Электронные потенциалы и электродвижущие силы
При решении задач этого раздела см. табл. 7.
Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Ме + mH2O ↔ Me(H2O)m n + + n ē
в растворе на металле
где n — число электронов, принимающих участие в процессе. На границе металл — жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала — электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях — так называемые стандартные электродные потенциалы (Е°).
|
|
|
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е° = 0; ∆G° = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е°), получаем так называемый ряд напряжений.
Положение того или иного металла в ряду напряжений характеризует его, восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е°, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньшие окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае ∆ G ° < 0, так как ∆ G ° = — nFE°.
|
|
|
Пример 1. Стандартный электродный потенциал никеля больше, чем кобальта (табл. 8). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциал кобальта — в растворе с концентрацией 0,1 моль/л?
Решение. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е = Е° + 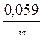 lg C
lg C
где Е° — стандартный электродный потенциал; n — число электронов, принимающих участие в процессе; С — концентрация (при точных вычислениях — активность) гидратированных ионов металла в растворе, моль/л; Е° для никеля и кобальта соответственно равны —0,25 и —0,277 В. Определим электродные потенциалы этих металлов при данных в условии концентрациях:
ENi2+/ Ni = 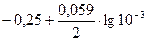 =-0,339 В,
=-0,339 В,
ECo2+/ Co = 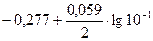 =-0,307 В,
=-0,307 В,
Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
|
|
|
Таблица 7.Стандартные электродные потенциалы (Eo), некоторых металлов (ряд напряжений)
| Электрод | Eo, В | Электрод | Eo, В | |
| Li+/Li | -3,045 | Cd2+/Cd | -0,403 | |
| Rb+/Rb | -2,925 | Co2+/Co | -0,277 | |
| K+/K | -2,924 | Ni2+/Ni | -0,25 | |
| Cs+/Cs | -2,923 | Sn2+/Sn | -0,136 | |
| Ba2+/Ba | -2,90 | Pb2+/Pb | -0,127 | |
| Ca2+/Ca | -2,87 | Fe3+/Fe | -0,037 | |
| Na+/Na | -2,714 | 2H+/H2 | -0,000 | |
| Mg2+/Mg | -2,37 | Sb3+/Sb | +0,20 | |
| Al3+/Al | -1,70 | Bi3+/Bi | +0,215 | |
| Ti2+/Ti | -1,603 | Cu2+/Cu | +0,34 | |
| Zr4+/Zr | -1,58 | Cu+/Cu | +0,52 | |
| Mn2+/Mn | -1,18 | Hg22+/2Hg | +0,79 | |
| V2+/V | -1,18 | Ag+/Ag | +0,80 | |
| Cr2+/Cr | -0,913 | Hg2+/Hg | +0,85 | |
| Zn2+/Zn | -0,763 | Pt2+/Pt | +1,19 | |
| Cr+3/Cr | -0,74 | Au3+/Au | +1,50 | |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
Пример 2. Магниевую пластинку опустили в раствор её соли. При этом электродный потенциал магния оказался равен —2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Решение. Подобные задачи также решаются на основании уравнения Нернста (см. пример 1):
-2,41=-2,37+ 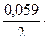 lgC,
lgC,
-0,04=0,0295lgC,
lgC= 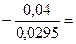 -1,3559 = - 2,6441
-1,3559 = - 2,6441
СMg2+= 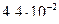 моль/л
моль/л
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
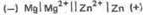
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки - границу раздела двух жидких фаз - пористую перегородку -(или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
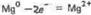 (1)
(1)
Цинк, потенциал которого -0,763 В - катод, т. е. электрод, на котором протекает восстановительный процесс:
 (2)
(2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
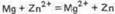
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:

Контрольные вопросы
241. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод — в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
242. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [ Рb2+ ] = [Мg2+ ] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
243. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
244. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
245. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опушенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1.967 В.
246. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3·10-15 моль/л.
247. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элементе, если [Ni2+ ] = 0,01 моль/л, [Pb2+] = 0,0001 моль/л. Ответ: 0,064 В.
248. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
249. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора?
250. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
251. В два сосуда с голубым раствором медного купороса, поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
252. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSО4; б) MgSО4; в) РЬ(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
253. При какой концентрации ионов Zn2+ (в моль/л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала? Ответ: 0,30 моль/л
254. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
255. Марганцевый электрод в растворе его соли имеет потенциал —1,23 В. Вычислите концентрацию ионов Мn2+ (в моль/л). Ответ: 2,02 · 10-2 моль/л.
256. Потенциал серебряного электрода в растворе АgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Аg+ (в моль/л)? Ответ: 0,20 моль/л.
257. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Cd2+] = 0,8 моль/л, а [Сu2+] = 0,01 моль/л. Ответ: 0,68 В.
258. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
259. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 1,89 · 10-12 моль/л.
260. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В.
ТЕМА: Электролиз
Пример 1. Какая масса меди выделится на катоде при электролизе раствора CuSО4 в течение 1 ч при силе тока 4 А?
Решение. Согласно законам Фарадея
 (1)
(1)
где m - масса вещества, окисленного или восстановленного на электроде, г; Э - эквивалентная масса вещества, г/моль; I - сила тока, A; t - продолжительность электролиза, с. Эквивалентная масса меди в CuSО4 равна 63,54:2 = 31,77 г/моль. Подставив в формулу (1) значения Э = 31,77; I =4 A, t = 60 · 60 =3600 с, получим
Дата добавления: 2018-11-24; просмотров: 157; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
