При твердении протекает реакция 10 страница
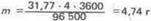
Пример 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Из формулы (1)
Э = 11,742 · 96500/3880 = 29,35 г/моль,
Где m =11,742 г; It = Q =3880 Кл.
Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение. Из формулы (1)

Так как дан объем водорода, то отношение m /Э заменяем отношением Vн2 /Vэ(н2), где Vн2 - объем водорода, л; Vэ(н2) - эквивалентный объем водорода, л. Тогда

Эквивалентный объем водорода при н.у. равен половине молярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения Vн2 = 1,4 л, Vэ(н2) = 11,2 л, t = 6025 (1ч 40 мин 25 с = 6025 с), находим
I = 1,4 · 96500/11,2 · 6025 = 2 А.
Пример 4. Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SО4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение. Эквивалентный объем кислорода (н.у.) 22,4/4 = 5,6 л. Следовательно, 11,2 л содержат две эквивалентные массы кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11 · 2 = 112,22 г (56,11 г/моль - мольная и эквивалентная масса КОН).
Контрольные вопросы
261. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора АgNO3. Если электролиз проводить с серебряным анодом, тo его масса уменьшается на 5,4 г. Определите расход электричества при этом. Ответ: 4830 Кл.
|
|
|
262. Электролиз раствора CuSО4 проводили в течение 15 мин при силе тока 2,5 А. Выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Ответ: 97,3 %
263. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплавов и водных растворов NaCI и КОН. Сколько литров (н.у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30 мин при силе тока 0,5 А? Ответ: 0,052 л.
264. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КВr. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А? Ответ: 0,886 г; 70,79 г.
265. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора CuCI2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г.
266. При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Ответ; 114,82.
|
|
|
267. При электролизе растворов MgSО4 и ZnCI2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде; на анодах? Ответ: 8,17 г; 2,0 г; 8,86 г.
268. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na2SО4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н.у.). Какая масса H2SO4 образуется при этом возле анода? Ответ: 0,2 г; 9,8 г.
269. При электролизе раствора соли кадмия израсходовано 3434 Кл электричества. Выделилось 2 г кадмия. Чему равна эквивалентная масса кадмия? Ответ: 56,26 г/моль.
270. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у.) выделилось при этом на катоде? Ответ: 17,08 А; 8,96 л.
271. Электролиз раствора K2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 5,03 г; 6,266 л; 3,133 л
|
|
|
272. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. Ответ: 17,37 г/моль.
273. При электролизе раствора CuSО4 на аноде выделилось 168 см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде.
Ответ: 0,953 г.
274 Электролиз раствора Nа2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде? Ответ: 11,75 г; 14,62л; 7,31л.
275. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде? Ответ: 32,20 г; 1,67 л.
276 Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла. Ответ: 32,7 г/моль.
277. Насколько уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 38 мин 20 с? Составьте электронные уравнения процессов, происходящих на графитовых электродах. Ответ: 4,47 г.
|
|
|
278. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока. Ответ: 5,74 А.
279. Электролиз раствора CuSО4 проводили с медным анодом в течение 4 ч при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Ответ: 94,48 %.
280. Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде? Ответ: 0,56 г; 71,0 г.
ТЕМА: Коррозия металлов
При решении задач этого раздела см. табл. 7.
Коррозия — это самопроизвольно протекающий процесс разрушения металлов, в результате химического или электрохимического взаимодействия их с окружающей средой.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный - окисление металла

и катодный — восстановление ионов водорода

или молекул кислорода, растворенного в воде,
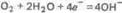
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе при комнатной температуре — деполяризатором является кислород.
Пример 1. Как происходит коррозии цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (—0,763 В), чем кадмий (—0,403 В), поэтому он является анодом, а кадмий катодом.
Анодный процесс:
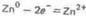
катодный процесс:
в кислой среде
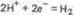
в нейтральной среде
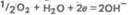
Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Контрольные вопросы
281. Железное изделие покрыли кадмием. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
282. Железное изделие покрыли свинцом. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
283. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
284. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии?
285. Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если цинковой палочной прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
286. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
287. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
288. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
289. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий — железо. Какие продукты коррозии образуются в первом и во втором случаях?
290. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
291. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
292. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
293. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
294. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
295. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
296. Железное изделие покрыли никелем. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
297. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний — никель. Какие продукты коррозии образуются в первом и во втором случаях?
298. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
299. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
300. Какое покрытие металла называется анодным, и какое — катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
ТЕМА: Коллоидные растворы
Коллоиды относятся к микрогетерогенным системам. В зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы и дисперсной среды различают свободнодисперсные коллоиды - золи и связнодисперсные – гели.
В золях дисперсная фаза образована частицами, называемыми мицеллами, которые практически нерастворимы в дисперсной среде.
Строение мицеллы можно рассмотреть на примере обменной реакции, которая наблюдается в разбавленных растворах при небольшом избытке одного из реагентов:
Пример 1. Как представить условной химической формулой строение мицеллы золя, полученного в результате взаимодействия КI с избытком AgNO3?
Решение. Запишем уравнение взаимодействия указанных веществ в молекулярном и ионно-молекулярном виде:
AgNO3 + KI ® AgI¯ + KNO3
избыток
Ag+ + NO3- + K+ + I- ® AgI¯ + K+ + NO3-
Мицелла состоит из ядра, имеющего кристаллическую или аморфную структуру:
m[AgI]
Образовавшееся ядро коллоидной степени дисперсности является носителем свободной поверхностной энергии, поэтому на его поверхности идет адсорбционный процесс. Обычно адсорбируется ион, входящий в состав ядра и находящийся в избытке. В данном примере ионы серебра – Ag+ достраивают структуру ядра, образуя адсорбционный слой, и придают ядру соответственно положительный заряд m[AgI]×nAg+, поэтому их называют потенциалопределяющими ионами.
В растворе остаются ионы, заряд которых противоположный заряду потенциалопределяющих ионов – противоионы. В данном примере противоионами являются анионы NO3-, которые электростатически притягиваются потенциалопределяющими ионами адсорбционного слоя. Часть противоионов (n – x)NO3- прочно связывается электрическими и адсорбционными силами и входит в адсорбционный слой. Ядро с адсорбционным слоем называется гранулой:
{m[AgI]×nAg+× (n-x)NO3- }x+
Гранула имеет заряд потенциалопределяющих ионов, величина которого зависит от числа ионов, вошедших в адсорбционный слой. Оставшаяся часть противоионов образует диффузионный слой. Ядро с адсорбционным и диффузионным слоями называется мицеллой:
{m[AgI]×nAg+ ×(n-x)NO3- }x+ × xNO3-
Если получать золь йодистого серебра при избытке йодида калия, т.е. при избытке I-, то коллоидная частица, благодаря адсорбции ионов nI- на поверхности ядра, получит отрицательный заряд: m[AgI]×nI-
гранула

{m[AgI]×nI-×(n-x)K+ }х-×xK+

мицелла
Числа m, n, x в зависимости от условий приготовления золей могут изменяться в широких пределах, т.е. мицелла не имеет строго определенного состава.
Наличие одноименного заряда у всех гранул является важным фактором его устойчивости. Заряд препятствует слипанию и укрупнению коллоидных частиц. Если такой процесс наблюдается, то это происходит, в основном, вследствие уменьшения свободной поверхностной энергии, и называется он коагуляцией. Достигнув определенных размеров за счет укрупнения, частицы под действием силы тяжести оседают, наблюдается явление седиментации.
Реагент, который находится в избытке, выполняет функции стабилизатора коллоидной системы, а ядро – дисперсной фазы.
Установлено, что коагуляцию можно вызвать повышением температуры, механическим воздействием, высокочастотными колебаниями и т.д., а также введением специальных растворов электролитов. В последнем случае введенные ионы десольватируют ионы диффузионного слоя, способствуют переходу их в адсорбционный слой, при этом достигается полная электрическая нейтрализация гранул – изоэлектрическое состояние системы, и происходит сжатие диффузионного слоя и уменьшение сил электрического отталкивания, а силы межмолекулярного сцепления растут, что способствует слипанию и укрупнению частиц.
Кроме перечисленного выше, коагуляцию можно вызвать добавлением к одному золю другого с противоположным зарядом гранулы: происходит взаимная коагуляция и выпадают в осадок оба золя.
Начальная стадия коагуляции протекает незаметно и называется скрытой коагуляцией. Наименьшее количество электролита, которое вызывает начало явной (заметной) коагуляции, определяет порог коагуляции золя.
Коагулирующая способность электролитов (ионов) неодинакова и может быть определена как величина, обратная порогу коагуляции:
| КС = 1/ ПК, | (5.1) |
где КС – коагулирующая способность электролитов;
Дата добавления: 2018-11-24; просмотров: 144; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
