При твердении протекает реакция 8 страница
CO32- + Н2О ↔ НСО3- + ОН-
или в молекулярной форме
Na2CO3 + Н2О ↔ NaНСО3 + NaОН
В растворе появляется избыток ионов ОН-, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSО4 — соль слабого многокислотного основания Zn(OH)2
и сильной кислоты H2SО4. В этом случае катионы Zn+2 связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 нe происходит, так как ионы ZnOH+ диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn+2 + Н2О ↔ ZnOH+ + Н+
или в молекулярной форме
2ZnSО4 + 2Н2О ↔ (ZnOH)2SО4 + Н2SО4
В растворе появляется избыток ионов водорода, поэтому раствор ZnSО4 имеет кислую реакцию (рН < 7).
Пример 2. Какие продукты образуются при смешивании растворов А1(NО3)3 и К2СОз? Составьте ионно-молекулярное и молекулярное уравнения реакции.
Решение. Соль А1(NО3)3 гидролизуется по катиону, а К2СО3 — по аниону:
А1+3 + Н2О ↔ А1OH+2 + Н+
CO32- + Н2О ↔ НСО3- + ОН-
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН- образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
2А1+3 + 3CO32- + 3Н2О ↔ 2А1(OH)3 + 3CO2
молекулярное уравнение:
|
|
|
2А1(NО3)3 + К2СОз + 3Н2О ↔ 2А1(OH)3 + 3CO2 + 6КNО3
Контрольные вопросы
201. Какие из солей RbCI, Сr2(SO4)3, Ni(NО3)2, Nа2SО3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН ( > 7<) имеют растворы этих солей?
202. К раствору А12(SO4)3 добавили следующие вещества: а) Н2SО4; б) КОН, в) Na2SОз; г) ZnSО4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
203. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2СО3 или Na2SО3; FеС13 или FеС12? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
204. При смешивании растворов А12(SO4)3 и Na2СО3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнение происходящего совместного гидролиза.
205. Какие из солей NaBr, Na2S, К2СО3, CoС12 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 <) имеют растворы этих солей?
206. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaCIO; MgС12 или ZnCI2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. (Пр (Mg(OH)2) = 5,5 · 10-12; Пр (Zn(OH)2) = 1,3 · 10-17).
|
|
|
207. Составьте ионно-молекулярные и молекулярные уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию.
208. Какое значение рН (> 7 <) имеют растворы следующих солей: К3РО4, РЬ(NО3)2, Na2S? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
209. Какие из солей К2СОз, FеС1з, К2SО4, ZnCI2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 <) имеют растворы этих солей?
210. При смешивании растворов AI2(SО4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующего основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
211. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и СгС1з. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты.
212. К раствору FеС13 добавили следующие вещества: а) НС1; б) КОН;
|
|
|
в) ZnС12; г) Nа2СО3. В каких случаях гидролиз хлорида железа (Ш) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
213. Какие из солей А12(SO4)3, К2S, РЬ(NО3)2, КС1 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7<) имеют растворы этих солей?
214. При смешивании растворов FеС13 и Na2СО3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями.
215. К раствору Na2СО3 добавили следующие вещества: а) НС1; б) NaOH;
в) Сu(NО3)2; г) K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
216. Какое значение рН (> 7 <) имеют растворы солей Na2S, А1С13, NiS04? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
217. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Рb(NО3)2, Na2CO3, Fe2(SO4)3. Какое значение рН (> 7 <) имеют растворы этих солей.
218. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СН3СООК, ZnSО4, А1(NО3)3. Какое значение рН (> 7 <) имеют растворы этих солей?
|
|
|
219. Какое значение рН (> 7 <) имеют растворы солей Na3PO4, K2S, CuSО4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
220. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей СuС12, Cs2СО3, Сг(NО3)3. Какое значение рН (> 7 <) имеют растворы этих солей?
КОНТРОЛЬНАЯ РАБОТА №2
ТЕМА: Окислительно-восстановительные реакции
• Окислительно-восстановительными называются реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления понимают тот условный заряд атома, который вычисляется исходя из предположения, что молекула состоит только из ионов. Иными словами: степень окисления — это тот условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов.
Окисление—восстановление — это единый, взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя, а восстановление — к ее понижению у окислителя.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях; окислитель принимает электроны, а восстановитель их отдает. При этом не имеет значения, переходят ли электроны от одного атома к другому полностью и образуются ионные связи или электроны только оттягиваются к более электроотрицательному атому и возникает полярная связь. О способности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов окислителя и восстановителя.
Атом того или иного элемента в своей высшей степени окисления не может ее повысить (отдать электроны) и проявляет только окислительные свойства, а в своей низшей степени окисления не может ее понизить (принять электроны} и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства.
Например:
N5+ (HNO3) S6+ (H2SO4) проявляют только окислительные свойства;
 N4+ (NO2) S4+ (SO2)
N4+ (NO2) S4+ (SO2)
N3+ (HNO2)
N2+ (NO) S2+ (SO) проявляют окислительные и
N1+ (N2O) восстановительные свойства
N0 (N2) S0 (S2, S8)
N1- (NH2OH) S-1 (H2S2)
N2- (N2H4)
N3- (NH3) S2- (H2S) проявляют только восстановительные свойства
При окислительно-восстановительных реакциях валентность атомов может и не меняться. Например, в окислительно-восстановительной реакции Н20 + Cl20 = 2H+ CI- валентность атомов водорода и хлора до и после реакции равна единице. Изменилась их степень окисления. Валентность определяет число связей, образованных данным атомом, и поэтому знака не имеет. Степень же окисления имеет знак плюс или минус.
Пример 1. Исходя из степени окисления (n) азота, серы и марганца в соединениях NН3, НNO2, НNО3, Н2S, Н2SО3, H2SO4, МnО2, КMnO4, определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисления n (N) в указанных соединениях соответственно равна: —3 (низшая), + 3 (промежуточная), +5 (высшая); n (S) соответственно равна: —2 (низшая), +4 (промежуточная), +6 (высшая); n (Мn) соответственно равна: +4 (промежуточная), +7 (высшая). Отсюда: NН3, Н2S — только восстановители; НNО3, H2SO4, КMnO4 — только окислители; НNO2, Н2SО3, МnО2 — окислители и восстановители.
Пример 2. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: a) Н2S и HI; б) Н2S и Н2SО3; в) Н2SО3 и HCIO4?
Решение. а) Степень окисления в Н2S n (S) = —2; в HI n (I) =—1. Так как и сера, и йод находятся в своей низшей степени окисления, то оба взятые вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут; б) в Н2S n (S) = —2 (низшая); в Н2SО3 n (S) = +4 (промежуточная). Следовательно, взаимодействие этих веществ возможно, причем Н2SО3 является окислителем; в) в Н2SО3 n (S) = +4 (промежуточная); в HCIO4 n (Cl) = +7 (высшая). Взятые вещества могут взаимодействовать. Н2SО3 в этом случае будет проявлять восстановительные свойства.
Пример 3. Составьте уравнения окислительно-восстановительной реакции, идущей по схеме .
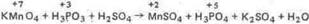
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
 восстановитель 5 Р3+ - 2 ē = Р5+ процесс окисления
восстановитель 5 Р3+ - 2 ē = Р5+ процесс окисления
окислитель 2 Mn7+ +5 ē = Mn2+ процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь вид
2KMnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O
Пример 4. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р-элемента VIA rpyппы равна —2. Цинк как металл II В группы имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
 восстановитель 4 Zn0 – 2 ē = Zn2+ процесс окисления
восстановитель 4 Zn0 – 2 ē = Zn2+ процесс окисления
окислитель 1 S6+ + 8 ē = S2- процесс восстановления
Составляем уравнение реакции:
4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекулы H2SO4 идут на связывание четырех ионов Zn2+.
I
Контрольные вопросы
221. Исходя из степени окисления хлора в соединениях НС1, НСlO3, HСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
KBr + KBrO3 + H2SO4 → Br2 + K2SO4 + H2O
222. Реакции выражаются схемами:
P + HIO3 + H2O → H3PO4 + HI
H2S + Cl2 + H2O → H2SO4 + HCl
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое — восстановителем; какое вещество окисляется, какое — восстанавливается.
223. См. условие задачи 222.
HNO3 + Zn → N2O + Zn(NO3)2 + H2O
FeSO4 + KСlO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O
224. См. условие задачи 222.
K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl + H2O
Au + HNO3 + HCl → AuCl3 + NO + H2O
225. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и КМnO4; б) НNO2 и HI; в) НС1 и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O
226. См. условие задачи 222.
HCl + CrO3 → Cl2 + CrCl3 + H2O
Cd + KMnO4 + H2SO4 → CdSO4 + MnSO4 + K2SO4 + H2O
227. См. условие задачи 222.
Cr2O3 + KСlO3 + KOH → K2CrO4 + KCl + H2O
MnSO4 + PbO2 +HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O
228. См. условие задачи 222.
H2SO3 + HClO3 → H2SO4 + HCl
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
229. См. условие задачи 222.
I2 + Cl2 + H2O → HIO3 + HCl
K2Cr2O7 + H3PO3 + H2SO4 → Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
230. Могут ли происходить окислительно-восстановительные реакции между веществами: а) РН3 и НВг; б) K2Cr2O7 и Н3РО3; в) НNО3 и H2S? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
AsH3 + HNO3 → H3AsO4 + NO2 + H2O
231. См. условие задачи 222.
Дата добавления: 2018-11-24; просмотров: 150; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
