Глава 2 Первое начало термодинамики
2.1 Первое начало термодинамики как закон сохранения энергии
Первое начало термодинамики отражает связь между внутренней энергией системы, теплотой и работой. Первое начало термодинамики является законом сохранения энергии, выраженным математически. Его открытию способствовали исследования М.В. Ломоносова (1711 - 1765), Р. Майера (1814 - 1878), С. Карно (1792 - 1832), Д.Джоуля (1818 - 1889). Этот закон имеет несколько формулировок.
а. Первое начало - закон сохранения энергии
Энергия не исчезает бесследно и не возникает из ничего, а переходит из одного вида энергии в другой в эквивалентных (равноценных) количествах.
Интересно, что механическую энергию в тепловую люди научились превращать ещё в доисторические времена (например, добывание огня трением), а вот наоборот – тепловую в механическую совсем недавно: в XIXв. с открытием тепловых двигателей. Наука термодинамика потому и возникла, чтобы понять, почему это превращение идёт с таким низким коэффициентом полезного действия (КПД). Во что превращается остальное тепло?
б. I начало термодинамики для изолированной системы
 Энергия изолированной системы постоянна, не изменяется, т.к. изолированная система не обменивается с окружающей средой ни энергией, ни веществом
Энергия изолированной системы постоянна, не изменяется, т.к. изолированная система не обменивается с окружающей средой ни энергией, ни веществом
ΔU = 0 (1)
Постоянство энергии изолированной системы не исключает возможности перехода одного вида энергии в другой, но при таких переходах энергия не теряется и не создается вновь. Отсюда третья формулировка.
|
|
|
в. Вечный двигатель первого рода невозможен, т.е. нельзя производить работу без затрат энергии.
Удивительно, что несмотря на то, что формулировка I начала была опубликована в 1842 году, до сих пор в патентные бюро всех стран мира подаётся масса заявок на изобретение вечного двигателя. Так в 90-е годы ХХ века в наших газетах был описан случай о намерении российского правительства купить самолёт, не требующий заправки топливом. Продемонстрировали комиссии пустые баки и полёт этого «чуда техники». Уже собирались подписывать контракт, составляющий внушительную сумму денег. Однако при последующем контроле обман был раскрыт. Оказалось, что под обшивкой самолёта сплошным слоем были установлены аккумуляторы.
г. I начало термодинамики для закрытых и открытых систем,
Количество теплоты, полученное системой, расходуется на изменение внутренней энергии системы и на совершение системой работы.
 |
Q = ΔU + A (2)
Если преобразовать формулу (2) в такой вид: A = Q – ΔU, то мы придем к поразительному выводу: нельзя всю теплоту превратить в работу, часть её всегда расходуется на увеличение внутренней энергии.
|
|
|
 В химии под работой понимают затраты энергии на расширение системы, например, при движении поршня в цилиндре двигателя. Поэтому уравнение (2) примет вид Q = ΔU – pΔV (2а)
В химии под работой понимают затраты энергии на расширение системы, например, при движении поршня в цилиндре двигателя. Поэтому уравнение (2) примет вид Q = ΔU – pΔV (2а)
2.2 Первое начало термодинамики для химических реакций
Поскольку химические реакции протекают в изобарных условиях и запас энергии системы для этих условий оценивается энтальпией системы, то закон сохранения энергии для изобарных условий выглядит так:
д. I начало термодинамики для изобарного процесса, Р = const .
 Если в изобарных условиях система получает (или отдаёт) какое-то количество теплоты, то согласно закону сохранения энергии, её энергия (её энтальпия) увеличивается (или уменьшается) на такую же величину. Qр = ΔН (3)
Если в изобарных условиях система получает (или отдаёт) какое-то количество теплоты, то согласно закону сохранения энергии, её энергия (её энтальпия) увеличивается (или уменьшается) на такую же величину. Qр = ΔН (3)
Предположим, в системе при постоянном давлении происходит экзотермическая реакция, тепловой эффект которой равен Q. Эта теплота выделяется из системы. На такую же величину уменьшается энтальпия системы: Q = ΔН
|
|


Изменение энтальпии системы, которое произошло в результате протекания химической реакции в системе и равное её тепловому эффекту, называют для краткости энтальпией реакции.
|
|
|
Термодинамика изучает изменение энергии в системе, а не в окружающей среде. Поэтому в термохимическом уравнении тепловой эффект указывается в виде энтальпии реакции.
 2С2Н2 (Г) + 5О2 (Г) 4СО2 (Г) + 2Н2О (Г) ΔН° = -1605,6 кДж /моль
2С2Н2 (Г) + 5О2 (Г) 4СО2 (Г) + 2Н2О (Г) ΔН° = -1605,6 кДж /моль
|
|


|

Если знать энергетическую ценность каждого вещества (т.е. запас его энергии при P = const - его энтальпию), то энтальпию реакции можно рассчитать по формуле
 ΔН°р-ии = Нкон. – Ннач. = Σ i ΔН°продуктов – Σ i ΔН°исх. в-в (4)
ΔН°р-ии = Нкон. – Ннач. = Σ i ΔН°продуктов – Σ i ΔН°исх. в-в (4)
Запас энергии каждого вещества называют стандартной энтальпией образования вещества: ΔН°298 (АВ) , кДж/моль. Её измеряют при постоянных, стан  дартных условиях: Р = 101325 Па (1атм., 760 мм.рт.ст), Т = 298К, v = 1 моль.
дартных условиях: Р = 101325 Па (1атм., 760 мм.рт.ст), Т = 298К, v = 1 моль.
|
|
|
Стандартная энтальпия образования вещества, ΔН° 298 (АВ) – это энтальпия реакции образования 1 моль этого вещества из простых веществ в стандартных условиях.
Значения ΔН°298 приводятся в таблицах. Для простых веществ (Н2, О2, С и т.д.) значения ΔН°298 приняты равными нулю.
 Например, ΔН°298 (Н2О) = -286 кДж/моль означает, что при образовании 1 моль воды в стандартных условиях по реакции Н2 (Г) + ½ О2 (Г) Н2О(Ж) выделяется 286 кДж тепла.
Например, ΔН°298 (Н2О) = -286 кДж/моль означает, что при образовании 1 моль воды в стандартных условиях по реакции Н2 (Г) + ½ О2 (Г) Н2О(Ж) выделяется 286 кДж тепла.
Таким образом, для химии практическая ценность первого начала термодинамики заключается в том, что она позволяет рассчитывать тепловые эффекты реакций.
2.3 Закон Гесса и следствия из него
Исторически сложилось так, что энтальпию реакции научились рассчитывать ещё до того, как было сформулировано первое начало термодинамики. Для этого использовали закон Гесса (1840) и его следствия (уравнение 4 и 5), которые являются, фактически, математическими выражениями первого начала.
Закон Гесса
|

 Энтальпия реакции зависит только от начального и конечного состояния системы и не зависит от пути перехода, т.е. не зависит от числа промежуточных стадий.
Энтальпия реакции зависит только от начального и конечного состояния системы и не зависит от пути перехода, т.е. не зависит от числа промежуточных стадий.
|

|
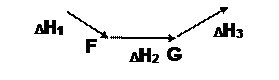 |
 ΔН= ΔН1+ ΔН2+ … ΔНi (5)
ΔН= ΔН1+ ΔН2+ … ΔНi (5)
Если вещества А и В превращаются в продукты С и Д. в одну или несколько стадий, то энтальпия этого перехода всегда одна и та же и равна ΔН, которая для многостадийных реакций складывается из энтальпий отдельных стадий. Закон Гесса позволяет рассчитывать энтальпии таких процессов, которые невозможно осуществить.
Пример 1. Рассчитать тепловой эффект реакции получения угарного газа окислением углерода, если известны энтальпии реакций
 С(Т) + О2 (Г) СО2 (Г) ΔН1 = -393 кДж
С(Т) + О2 (Г) СО2 (Г) ΔН1 = -393 кДж
 2СО (Г) + О2 (Г) 2СО2 (Г) ΔН2 = -282 кДж
2СО (Г) + О2 (Г) 2СО2 (Г) ΔН2 = -282 кДж
|


 С(Т) + О2 (Г) СО2 (Г)
С(Т) + О2 (Г) СО2 (Г)
| ||||
| ||||
СО (Г)
ΔН1= ΔН + ΔН2
ΔН = ΔН1 – ΔН2 = - 393 – (-282) = -111 кДж/моль
Таким образом, с помощью закона Гесса можно рассчитать энтальпию реакции образования угарного газа (СО), которую нельзя экспериментально определить из-за быстрого одновременного образования углекислого газа.
1-е следствие из закона Гесса


 Энтальпия прямой реакции равна энтальпии обратной реакции с противоположным знаком.
Энтальпия прямой реакции равна энтальпии обратной реакции с противоположным знаком.
ΔН = - ΔН (6)
Первое следствие можно использовать для сравнения устойчивости веществ, например, лекарственных препаратов при хранении. Так, если для препаратов АВ и СД стандартные энтальпии их образования имеют следующие значения
 А + В АВ ΔН°298 (АВ) = -100 кДж/моль
А + В АВ ΔН°298 (АВ) = -100 кДж/моль
 С + Д СД ΔН°298 (СД) = -300 кДж/моль,
С + Д СД ΔН°298 (СД) = -300 кДж/моль,
то обратная реакция их разложения идёт с поглощением тепла. Для препарата СД требуется больше затрат энергии, следовательно, оно более устойчиво.
2-е следствие из закона Гесса (приведено ранее, уравнение 4)
Энтальпия реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
 ΔН °р-ии = Σ i ΔН°298 продуктов – Σ i ΔН°298 исх. в-в
ΔН °р-ии = Σ i ΔН°298 продуктов – Σ i ΔН°298 исх. в-в
Пример 2 Рассчитать энтальпию реакции
 С2Н6 (Г) + Н2 (Г) 2СН4 (Г)
С2Н6 (Г) + Н2 (Г) 2СН4 (Г)
Решение Выпишем из таблицы значения стандартных энтальпий образования всех веществ (ΔН°298) и запишем их под формулой каждого вещества в уравнении реакции
 С2Н6 (Г) + Н2 (Г) 2СН4 (Г)
С2Н6 (Г) + Н2 (Г) 2СН4 (Г)
ΔН°298, кДж/моль -84,7 0 -74,8
Используя уравнение (4), рассчитаем тепловой эффект данной реакции
ΔН°р-ии = 2ΔН° (СН4) – [ΔН° (С2Н6) + ΔН° (Н2)]
ΔН°р-ии = 2∙(-74,8) – ( -84,7 + 0) = - 64,9 кДж /моль
Ответ: ΔН°р-ии < 0, реакция экзотермическая.
2.4. Медико-биологическое значение первого начала термодинамики
Закон сохранения энергии для живых организмов можно сформулировать так:
Дата добавления: 2018-10-27; просмотров: 361; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
