Тема: Обмен и функции аминокислот.
Учебные и воспитательные цели:
-Общая цель занятия: научить использовать знания о различных процессах, в ходе которых может
образовываться аммиак, о механизмах его обезвреживания, знать биосинтез и роль креатина, креатин-
фосфата в синтезе АТФ, а также уметь использовать эти знания в практической деятельности врача.
- Частные цели:
уметь определять количество мочевины в сыворотке крови, креатинина в моче и выделять
креатин из мышечной ткани.
1. Входной контроль знаний:
1.1. Тесты.
1.2. Устный опрос.
1.3. Реферативные сообщения.
2. Основные вопросы темы:
2.1. Образование аммиака в организме и пути его обезвреживания. Гипераммониемия.
2.2. Биосинтез мочевины как основной механизм предотвращения накопления аммиака. Клиническое
значение определения мочевины.
2.3. Синтез креатина, креатин-фосфата, значение этого синтеза для организма. Клиническое
значение определения креатинина.
2.4. Особенности обмена отдельных аминокислот (глицин, метионин, глутаминовая и аспарагиновая
кислоты, триптофан, фенилаланин).
2.5. Нарушения в обмене отдельных аминокислот.
2.6. Патология азотистого обмена.
Лабораторно-практические работы:
3.1. Определить количество мочевины в сыворотке крови.
3.2. Определить количество креатинина в моче.
3.3. Выделить креатинин из мышечной ткани.
|
|
|
Выходной контроль
4.1. Ситуационные задачи.
5. Литература:
5.1. Материал лекций.
5.2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: «Медицина», 1990г., с. 350-354, 364-368.
5.3. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: «Медицина», 2004г., с. 447-464.
Основные вопросы темы
2.1. Образование аммиака в организме и пути его обезвреживания. Гипераммониемия.
Аммиак в организме образуется в результате дезаминирования аминокислот, биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение). Концентрация аммиака в крови в норме – 0,4-0,7мг/л. Это токсичное соединение, поэтому аммиак не накапливается, а вступает в реакцию с глутаминовой или аспарагиновой кислотами с образованием индифферентной транспортной формы – глутамина или аспарагина.
+NН3
 НООС-(СН2)2-СН-СООН Н 2NОС-(СН2)2-СН-СООН
НООС-(СН2)2-СН-СООН Н 2NОС-(СН2)2-СН-СООН


NН2 АТФ NН2
-Н 2О
|
|
|
глутаминовая кислота глутамин
+NН3
 НООС-СН2-СН-СООН Н2NОС-СН2-СН-СООН
НООС-СН2-СН-СООН Н2NОС-СН2-СН-СООН

 АТФ
АТФ
NН2 -Н 2О
NН2
аспарагиновая кислота аспарагин
В почках глутамин под влиянием глутаминазы расщепляется с образованием аммиака, идущего на нейтрализацию кислых соединений с образованием аммонийных солей. Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов (Na+, K+) для поддержания осмотического давления. Глутамин – основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров, белков, глюкозы. Также источниками образования аммиака служат процессы:
- дезаминирования биогенных аминов;
- распад пиримидиновых оснований (урацил, тимин, цитозин);
- дезаминирования аминокислот;
|
|
|
- дезаминирования пуриновых оснований (гуанина и аденина).
Пути использования аммиака в организме:
1. Синтез аминокислот из соответствующих кетокислот:
АТФ
 СН3-С-СООН + NН3 СН3-СН-СООН
СН3-С-СООН + NН3 СН3-СН-СООН



О NН2
ПВК аланин
2. Синтез аммонийных солей в почках.
3. Синтез пуриновых и пиримидиновых нуклеотидов.
4. Синтез мочевины – основной путь обезвреживания аммиака.
ГИПЕРАММОНИЕМИЯ.
Повышение содержания аммиака в крови до 6000мкмоль/л (норма-60мкмоль/л) оказывает токсическое действие на организм.
Причины:
1. генетический дефект ферментов орнитинового цикла в печени;
2. вторичное поражение печени в результате цирроза, гепатита и др.
Симптомы: тошнота, повторяющаяся рвота, потеря сознания, отек мозга, отставание умственного развития. Все симптомы гипераммониемии – проявление действия аммиака на ЦНС.
Для диагностики производят определение содержания аммиака в крови, метаболитов орнитинового цикла в крови и моче, активность ферментов печени.
2.2. . Биосинтез мочевины как основной механизм предотвращения накопления аммиака. Клиническое
|
|
|
значение определения мочевины.
Еще в прошлом веке русские ученые М.В. Ненцкий и С.С. Салазкин показали, что в печени происходит образование мочевины из углекислого газа и аммиака.
Кребс и Гензеляйт установили, что синтез мочевины представляет собой циклический процесс, в котором ключевым соединением, замыкающим цикл, является орнитин. Кохен и Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоилфосфата.
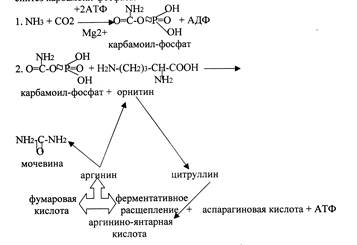
В печени аммиак связывается с СО2 с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы. Затем под действием орнитин-карбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на орнитин и образуется цитруллин. В следующей реакции аргининосукцинатсинтетаза связывает его с аспартатом и образуется аргининоянтарная кислота. Аспартат – источник второго атома азота мочевины. Далее происходит расщепление аргининоянтарной кислоты на аргинин и фумарат (идет в ЦТК). Аргинин гидролизуется под действием аргиназы на орнитин и мочевину. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции происходят в митохондриях гепатоцитов. Затем цитруллин транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Орнитиновый цикл в печени выполняет 2 функции:
1. превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных
продуктов - аммиака;
2. синтез аргинина и пополнение его в организме.
Отмечается, что у детей первых месяцев жизни функция печени развита недостаточно, что проявляется в том, что у ребенка количество аммиака по сравнению с взрослым человеком увеличено в 2-2,5 раза. У новорожденных – 20-30% общего азота падает на азот мочевины.
Мочевина – безвредное для организма соединение. Главным местом ее образования в организме является печень, где есть ферменты мочевинообразования. В головном мозге имеются все ферменты синтеза мочевины, кроме карбамоилфосфатазы, поэтому в нем мочевина не образуется. Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. В норме экскрекция мочевины – 25-30 г/сут. При повышении количества потребляемых с пищей белков увеличивается выделение мочевины.
2.3. Синтез креатина, креатин-фосфата, значение этого синтеза для организма. Клиническое
значение определения креатинина.
Конечным продуктом распада аминокислот в организме, наряду с мочевиной, является креатинин, который образуется в мышечной ткани из креатинфосфата. Креатин и креатинфосфат – важнейшие азотистые вещества мышц, участвующие в химических процессах, связанных с ресинтезом АТФ, являющегося участником мышечного сокращения. Это небелковые азотистые вещества мышц. Креатин синтезируется в почках и печени из трех аминокислот, затем поступает в мышечную ткань.
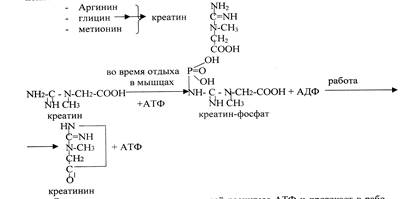
Эта реакция является одним из путей ресинтеза АТФ и протекает в работающей мышце. Креатинин удаляется в составе мочи. Содержание креатинина в моче зависит от развития мышечной массы. Т.о. следует подчеркнуть, что мочевина, креатинин, соли аммония являются конечными продуктами обмена аминокислот, а определение их в моче является диагностическим показателем. В норме мочевины за сутки у взрослого выделяется около 25- 30г, креатинина – 1,5-2,4 г., солей аммония – 0,5-1,2 г.
Количество креатинина в моче повышается при распаде белков, усиленной мышечной работе, акромегалии, гипотиреозе.
Креатин в норме у взрослого в моче не обнаруживается, а у детей в связи с повышенным обменом веществ может наблюдаться креатинурия.
Креатин в моче появляется при авитаминозе витаминов ''С'' и ''Е'', сахарном диабете, голодании, а также при всех заболеваниях, связанных с распадом мышечной ткани.
2.4. Особенности обмена отдельных аминокислот (глицин, метионин, глутаминовая и аспарагиновая
кислоты, триптофан, фенилаланин).
Важную роль в обменных процессах играют некоторые аминокислоты.
Глицин – участвует в реакциях обмена. Ее основной источник - серин
1. В синтезе порфиринов, входящих в состав гемоглобина.
2. В синтезе пуринов.
3. В синтезе глутатиона.
4. В синтезе креатина, холина, парных желчных кислот.
5. В обезвреживании токсических соединений, путем связывания с бензойной и фенилуксусной кислотами, образуя гиппуровую кислоту, которая выводится с мочой.
Метионин – является донором метильных групп (-СН3) для образования: адреналина, холина, креатина, карнитина и участвует в синтезе цистеина. Участвует в обезвреживании токсичных метаболитов и лекарственных веществ.
Аспарагиновая кислота участвует в синтезе мочевины, обезвреживании аммиака с образованием аспарагина, в образовании пуринов и пиримидинов, в синтезе АМФ, УМФ.
Глутаминовая кислота принимает участие в синтезе глютатиона, в образовании α-кетоглутаровой кислоты, в обезвреживании аммиака с образованием глутамина, при ее декарбоксилировании образуется γ-аминомасляная кислота.
Триптофан – в организме превращается в биохимически активные соединения: никотиновую кислоту (витамин РР), серотонин.
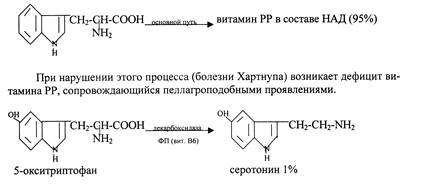
Серотонин является биогенным амином, служит для образования мелатонина. При избыточном накоплении серотонина наблюдается карциноидный синдром (карциномы – злокачественные опухоли в ЖКТ).
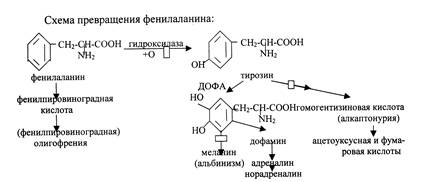
Значению обмена фенилаланина в детском организме придается большое значение. Это связано с тем, что выпадение активности определенных ферментов (мутация гена, ответственного за синтез ферментов, принимающих участие в превращении этой аминокислоты) приводит к накоплению необычных продуктов реакции, например, фенилпировиноградной, гомогентизиновой кислот, являющихся токсическими веществами, влияющими на функции головного мозга ребенка. Кроме того, избыток фенилаланина и дефицит тирозина сказывается на процессах биосинтеза специфических белков головного мозга.
Основное количество фенилаланина расходуется по 2 путям:
1. включается в белки;
2. превращается в тирозин.
Превращение фенилаланина в тирозин необходимо для удаления его избытка, т.к. высокие концентрации фенилаланина токсичны для клеток.
2.5. Нарушения в обмене отдельных аминокислот.
Причиной нарушений в обмене отдельных аминокислот служит полное или частичное выключение определенной ферментативной активности. При этом врожденном дефекте идет накопление большого количества промежуточных или побочных продуктов, оказывающих токсическое действие на организм, особенно на ЦНС. Вот почему, прежде всего, поражаются дети раннего возраста с последующим нарушением психической деятельности.
Фенилкетонурия – это наследственное заболевание, связанное с отсутствием фермента фенилаланингидроксилазы, в связи с чем фенилаланин превращает не в тирозин, а в фенилпировиноградную кислоту (ФПВК). При этом концентрация фенилаланина повышается в крови в 20-30 раз (в норме-1,0-2,0мг/дл), в моче – в 100-300 раз (норма – 30 мг/дл). Наиболее тяжелые проявления – нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. Эти проявления связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина. При отсутствии лечения больные не доживают до 30 лет. Заболевание наследуется по аутосомно-рецессивному типу.


 Фенилаланин фен-ала тирозин
Фенилаланин фен-ала тирозин
гидроксилаза
ФПВК
Из аминокислоты тирозина образуются: тироксин, норадреналин, адреналин, меланин и др. При отсутствии ферментов, расщепляющих тирозин, наблюдается следующая патология:
Альбинизм – наследственное заболевание, связанное с отсутствием фермента тирозиназы. Тирозин не превращается в дезоксифенилаланин (ДОФА), следовательно, не образуется пигмент меланин. Клиническое проявление – отсутствие пигментации кожи и волос. У больных часто снижена острота зрения, возникает светобоязнь.
тирозин
 |  | ||
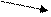 ДОФА
ДОФА
 дофамин гомогентизиновая кислота
дофамин гомогентизиновая кислота
 |  |  | |||
меланин норадреналин ацетоуксусная фумаровая
 кислота кислота
кислота кислота
адреналин
Алкаптонурия («черная моча») – заболевание, связанное с отсутствием фермента диоксигеназы, расщепляющего гомогентизиновую кислоту. Она выводится с мочой и при соприкосновении с воздухом моча приобретает темную окраску. Клиническими проявлениями болезни также являются пигментация соединительной ткани (охроноз) и артрит.
2.6. Патология азотистого обмена.
Одним из характерных нарушений азотистого обмена является белковая недостаточность, которая является следствием не только дефицита белка, но и ряда тяжелых заболеваний даже при достаточном поступлении белка с пищей. Причины белковой недостаточности: малобелковое питание или плохое усвоение белков пищи, непроходимость пищевода, патология пищеварительной канала системы.
Результатом этих состояний являются: отрицательный азотистый баланс, гипопротеинемии (снижение концентрации белков в сыворотке крови до 30-50 г/л, в норме – 65-85 г/л) и нарушения коллоидно-осмотического и водно-солевого обменов (развитие отеков).
При тяжелых формах пищевых дистрофий, например, при «квашиоркоре» (в переводе «золотой или красный мальчик») – заболевании, которое распространено среди детей развивающихся стран, наблюдаются тяжелые поражения печени, остановка роста, отечность, атония мышц, анемия, резкое снижение сопротивляемости организма инфекциям. У лиц негроидной расы волосы приобретают красно-коричневый оттенок. Болезнь часто заканчивается летальным исходом.
При белковой недостаточности наблюдается резкое снижение интенсивности процессов дезаминирования, трансаминирования, биосинтеза аминокислот и синтеза мочевины в печени. Эти нарушения обусловлены нарушением ферментативных функций печени и других органов. Следствием их являются накопление аминокислот в крови, экскреция с мочой свободных аминокислот (до 10-20 г/сут, в норме – 1г/сут) и резкое снижение образования и выделения мочевины с мочой.
Аминоацидурия – дефект белков одной из транспортных систем аминокислот в почках, где происходит их реабсорбция, сопровождающийся потерей их с мочой в 3-5 раз больше нормы.
Цистинурия – дефект белка, транспортирующего цистин, приводит к повышенному выделению с мочой преимущественно цистина и образованию цистиновых камней в почках.
Кетонурия – болезнь, сопровождающаяся появлением мочи с запахом ''кленового сиропа'', является следствием недостаточности декарбоксилазы кетопроизводных аминокислот, т.е. валина, лейцина и изолейцина. В результате нарушения окислительного декарбоксилирования происходит повышение содержания в крови этих аминокислот и их кетопроизводных, а также выделение их с мочой. Моча таких больных имеет характерный запах ''кленового сиропа''. Клинически у таких детей наблюдается рвота, периодические судороги, мышечная ригидность.
3. Лабораторно-практические работы:
3.1. Определить количество мочевины в сыворотке крови.
Принцип метода: мочевина образует с диацетилмонооксимом в сильнокислой среде в присутствии тиосемикарбазида и ионов железа красный комплекс, который фотометрируют.
Ход работы:
| Отмерить (мл) | Проба | Эталон |
| Сыворотка Калибровочный растворр мочевины 8,33 ммоль/л Рабочий раствор | 0,1 - 2,0 | - 0,1 2,0 |
| Перемешивают и нагревают точно 10 мин на кипящей водяной бане. Быстро охлаждают в токе воды и в пределах 15 мин измеряют оптическую плотность пробы (А1) и эталона (А2) | ||
А1
Расчет: мочевина (ммоль/л) = ------- х 16,65 А2 = 0,41
А2
Нормальные величины: мочевина 3,3-8,3 ммоль/л.
3.2. Определить количество креатинина в моче.
Берут 2 пробирки. В опытную пробирку отмеривают 0,1 мл мочи (2 капли), прибавляют 0,1 мл 10% раствора NаОН (2 капли) и 0,15 мл насыщенного раствора пикриновой кислоты (3 капли). Одновременно во вторую контрольную пробирку отмеривают 0,1 мл стандартного раствора креатинина (2 капли), 0,1 мл 10% раствора NаОН (2 капли) и 0,15 мл пикриновой кислоты (3 капли). Взбалтывают, оставляют на 5 мин, доводят дистиллированной водой до объема 10 мл, тщательно перемешивают стеклянной палочкой. Фотометрируют на ФЭК с зеленым светофильтром.
Определяют оптическую плотность опытного и контрольного растворов. По формуле определяем количество креатинина в моче:
0,1хЕ2
Х = ----------- , где
Е1
Х – количество мг креатинина в 0,1 мл мочи;
0,1 – количество мг креатинина в 0,1 мл стандартного раствора;
Е1 – оптическая плотность контрольного раствора;
Е2 – оптическая плотность опытного раствора.
В норме в сутки выводится с мочой креатинина у мужчин – 1,0-2,0 г, у женщин – 0,8-1,8 г. Коэффициент
пересчета в единицы СИ (ммоль/сут) равен 8,84.
Норма у мужчин – 8,8-17,7 ммоль/сут, у женщин – 7,1-15,9 ммоль/сут.
3.3. Выделить креатинина из мышечной ткани.
1. Поместить в пробирку 0,5 г измельченной мышечной ткани, добавить 2 мл дистиллированной
воды и хорошо перемешать стеклянной палочкой.
2. Продолжая помешивать, осадить белки добавлением 2 мл 20% раствора сульфосалициловой кислоты.
3. Осадок белка отфильтровать.
4. Отмерить в пробирку 1 мл фильтрата, добавить к нему 1 мл 10% раствора НСl и поставить в кипящую
водяную баню на 30 мин. При этом креатин переходит в креатинин.
5. Достать пробирку из водяной бани, добавить в нее 1 мл раствора пикриновой кислоты и 2 мл 15%
раствора NаОН.
6. Наблюдают характерное оранжевое окрашивание.
Практическое занятие №12.
Задание к занятию №12.
Дата добавления: 2018-10-26; просмотров: 155; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
