Идеальный газ во внешнем поле. Барометрическая формула. Распределение Больцмана.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести. Для идеального газа, имеющего постоянную температуру T и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая формула имеет следующий вид:
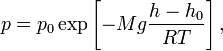 где p — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне (h = h0), M — молярная масса газа, R — газовая постоянная, T — абсолютная температура.
где p — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне (h = h0), M — молярная масса газа, R — газовая постоянная, T — абсолютная температура.
Распределение Больцмана — распределение вероятностей различных энергетических состояний идеальной термодинамической системы (идеальный газ атомов или молекул) в условиях термодинамического равновесия. Согласно распределению Больцмана среднее число частиц с полной энергией  равно
равно 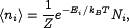
Теплоемкость идеального газа. Отношение Ср/С v .
Теплоемкость идеального газа — это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло.

Сv- изохорический процесс, протекающий при постоянном обьеме системы, V=const.
Cv=(DQ/vdT)по v= 1/v* dU/dT= i/2*R
Cp – изобарический процесс, протекающий при постоянном давлении системы, p=const.
Сp=dQ/vdT=dU/vdT+dA/vdT=Cv+dA/vdT
Используя уравнение состояния идеального газа:
pv=vRT, можно показать, что для одного моля газа dA/vdT=R. Поэтому уравнение Cp=… можно переписать в виде формулы Майера: Cp=Cv+R, тогда разделив Cp на Сv, получим:
γ=Сp/Cv=i+2/i.
Адиабатический процесс. Уравнение адиабаты. Работа при адиабатическом процессе.
|
|
|
Адиабатический процесс - это процесс, протекающий без теплообмена системы с окружающей средой, dQ = 0. На практике адиабатическими процессами являются те процессы, которые протекают очень быстро, и теплообмен с окружающей средой не успевает произойти, или же процессы, протекающие в системах, находящихся в термостате.
Уравнение адиабаты:  , γ=Сp/Cv – показатель адиабаты.
, γ=Сp/Cv – показатель адиабаты.
Реальные газы. Изотерма Ван-дер-Ваальса. Критическое состояние газа.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объем.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
 где
где
p — давление,
V — молярный объём,
T — абсолютная температура,
R — универсальная газовая постоянная.
|
|
|
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
 , где V — объём.
, где V — объём.
Первое начало термодинамики.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии.
Формулировка: Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, и не зависит от способа, которым осуществляется этот переход.
Для элементарного количества теплоты δQ, элементарной работы δA и малого приращения dU внутренней энергии первый закон термодинамики имеет вид:
dU = δQ − δA + μdN + δA'.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что dU и dN являются полными дифференциалами, а δA и δQ — нет.
Дата добавления: 2018-10-26; просмотров: 354; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
