Таблицы для вычисления коли-титра в продуктах
Таблица 4.4.3.3.
| Объемы: 10,0; 1,0; 0,1 и 0,01 мл
| |||||
| 10,0 | 1,0 | 0,1 | 0,01 | Коли-индекс | Коли-титр |
| - | - | - | - | менее 90 | более 11,1 |
| - | - | - | + | 90 | 11,1 |
| - | - | + | - | 90 | 11,1 |
| - | + | - | - | 95 | 10,5 |
| - | - | + | + | 180 | 5,6 |
| - | + | - | + | 190 | 5,3 |
| - | + | + | + | 220 | 4,6 |
| + | - | - | - | 230 | 4,3 |
| - | + | + | + | 280 | 3,6 |
| + | - | - | + | 920 | 1,1 |
| + | - | + | - | 940 | 1,0 |
| + | - | + | + | 1800 | 0,6 |
| + | + | - | - | 2300 | 0,4 |
| + | + | - | + | 9600 | 0,1 |
| + | + | + | - | 23800 | 0,04 |
| + | + | + | + | более 23800 | менее 0,04 |
Таблица 4.4.3.4.
| Объемы: 1,0; 0,1; 0,01 и 0,001 мл
| |||||
| 1,0 | 0,1 | 0,01 | 0,001 | Коли-индекс | Коли-титр |
| - | - | - | - | менее 900 | более 1,11 |
| - | - | - | + | 900 | 1,11 |
| - | - | + | - | 900 | 1,11 |
| - | + | - | - | 950 | 1,05 |
| - | - | + | + | 1800 | 0,56 |
| - | + | - | + | 1900 | 0,53 |
| - | + | + | - | 2200 | 0,46 |
| + | - | - | - | 2300 | 0,43 |
| - | + | + | + | 2800 | 0,36 |
| + | - | - | + | 9200 | 0,11 |
| + | - | + | - | 9400 | 0,10 |
| + | - | + | + | 18000 | 0,06 |
| + | + | - | - | 23000 | 0,04 |
| + | + | - | + | 96000 | 0,01 |
| + | + | + | - | 238000 | 0,004 |
| + | + | + | + | более 238000 | менее 0,004 |
|
|
|
Таблица 4.4.3.5.
| Объемы: 0,1; 0,01; 0,001 и 0,0001 мл
| |||||
| 0,1 | 0,01 | 0,001 | 0,0001 | Коли-индекс | Коли-титр |
| - | - | - | - | менее 9000 | более 0,111 |
| - | - | - | + | 9000 | 0,111 |
| - | - | + | - | 9000 | 0,111 |
| - | + | - | - | 9500 | 0,105 |
| - | - | + | + | 18000 | 0,056 |
| - | + | - | + | 19000 | 0,053 |
| - | + | + | - | 22000 | 0,046 |
| + | - | - | - | 23000 | 0,043 |
| - | + | + | + | 28000 | 0,036 |
| + | - | - | + | 92000 | 0,011 |
| + | - | + | - | 94000 | 0,010 |
| + | - | + | + | 180000 | 0,006 |
| + | + | - | - | 230000 | 0,004 |
| + | + | - | + | 960000 | 0,001 |
| + | + | + | - | 2380000 | 0,0004 |
| + | + | + | + | более 2380000 | менее 0,0004 |
|
|
|
Таблица 4.4.3.6.
| Объемы: 0,01; 0,001; 0,0001 и 0,00001 мл
| |||||
| 0,01 | 0,001 | 0,0001 | 0,00001 | Коли-индекс | Коли-титр |
| - | - | - | - | менее 90000 | более 0,0111 |
| - | - | - | + | 90000 | 0,0111 |
| - | - | + | - | 90000 | 0,0111 |
| - | + | - | - | 95000 | 0,0105 |
| - | - | + | + | 180000 | 0,0056 |
| - | + | - | + | 190000 | 0,0053 |
| - | + | + | - | 220000 | 0,0046 |
| + | - | - | - | 230000 | 0,0043 |
| - | + | + | + | 280000 | 0,0036 |
| + | - | - | + | 920000 | 0,0011 |
| + | - | + | - | 940000 | 0,0010 |
| + | - | + | + | 1800000 | 0,0006 |
| + | + | - | - | 2300000 | 0,0004 |
| + | + | - | + | 9600000 | 0,0001 |
| + | + | + | - | 23800000 | 0,00004 |
| + | + | + | + | более 23800000 | менее 0,00004 |
|
|
|
4.5. Метод определения микроорганизмов рода Staphylococcus
Клетки стафилококков сферические, 0,5-1,5 мкм в диаметре. В результате деления более чем в одной плоскости образуют гроздьевидные скопления. Неподвижные, грамположительные. Образуют внеклеточные ферменты и токсины. Температурный оптимум 35-40 °С, пределы для роста 6,5-46 °С. Оптимум рН 7,0-7,5, пределы рН для роста - 4,2-9,3. Стафилококки активно образуют пигмент (липохром) золотистый, эмалево-белый, лимонно-желтый, особенно при комнатной температуре (20 °С) и при доступе воздуха. Колонии стафилококков на плотных средах имеют форму правильных дисков от 2 до 4 мм в диаметре. Края колонки ровные, поверхность слегка выпуклая блестящая, непрозрачная, окрашена в цвет пигмента. В жидких средах дают сильное диффузное помутнение, образуя постепенно осадок. Согласно последней классификации (Берги, 1980) род Staphylococcus включает три вида: St. aureus, Staph. epidermidis, Staph. saprophyticus. Стафилококки, относящиеся ко всем трем видам, могут быть причиной различных заболеваний человека, а стафилококки, вырабатывающие энетеротоксины, при определенных условиях могут вызывать пищевые интоксикации. В настоящее время Staph. aureus целесообразно использовать в качестве санитарно-показательного микроорганизма при исследовании пищевых продуктов, а также при обследовании объектов общественного питания, особенно пищеблоков в детских дошкольных и подростковых учреждениях для оценки их санитарного содержания.
|
|
|
4.5.1. Методика количественного определения Staph. aureus
Методика выделения St. aureus предусматривает его количественное определение в пищевых продуктах и наличие его в смывах.
1 этап. Из исходной 10% взвеси продукта производят посев на элективные среды: желточно-солевой (ЖСА) или молочно-солевой (МСА) агары. Основную 10% взвесь в количествах 0,5 и 0,1 мл (0,05 и 0,01 г продукта) наносят на поверхность среды, равномерно распределяют и тщательно растирают шпателем. Кроме этого, 1 мл исходной взвеси (0,1 г продукта) засевают в пробирки с 5 мл 6,5%-го солевого бульона. Продукты жидкой консистенции высевают на плотные среды в количестве 0,5 и 0,1 мл, а в жидкие - 1,0 мл. Продукты с пониженной водной активностью (  0,86) или с повышенным содержанием поваренной соли дополнительно засевают также в количестве 1,0 мл (0,1 г, мл продукта) на сахарный бульон, разлитый в пробирки по 5 мл.
0,86) или с повышенным содержанием поваренной соли дополнительно засевают также в количестве 1,0 мл (0,1 г, мл продукта) на сахарный бульон, разлитый в пробирки по 5 мл.
Посевы инкубируют при 37 °С в течение 18-24 часов, чашки с плотными средами оставляют еще на сутки при комнатной температуре*.
___________________
* - На средах, содержащих желток, стафилококк, выделенный от человека, образует у 60-70% выделенных культур венчик вокруг колонии (положительная лецитовителлазная реакция). Стафилококки животного происхождения дают положительную лецитовителлазную реакцию в 5-10% культур.
2 этап. а) Просматривают посевы на МСА или ЖСА. На ЖСА колонии стафилококков дают радужный венчик, на МСА - образуют пигмент: золотистый, кремовый, эмалево-белый и др. Изолированные колонии, подозрительные на стафилококк, изучают, микроскопируют с окраской по Граму и высевают на скошенный МПА или на сектора чашки с молочным агаром. Число колоний, взятых для идентификации, должно быть не менее 5-7.
б) Из сред обогащения производят высевы на сектора чашки с молочным агаром.
Все посевы инкубируют при 37 °С в течение 18-24 часов.
3 этап: Выделенную чистую культуру с секторов на чашках с молочным или из пробирок со скошенным МПА подвергают микроскопии с окраской по Граму. При наличии мелких грамположительных кокков ставят реакцию плазмокоагуляции.
4.5.2. Постановка реакции плазмокоагуляции
Наилучшим методом предварительной идентификации St. aureus в лабораторных условиях является коагулазная проба в пробирке, закрытой ватной пробкой, с кроличьей или человеческой плазмой. При чтении реакции плазмокоагуляции установлено 3 градации активности фермента коагулазы:
1) ++++ - сгусток плотный, 2) +++ - сгусток, имеющий небольшой отсек, 3) ++ - сгусток в виде взвешенного мешочка.
Эту реакцию следует читать очень осторожно, чтобы не повредить и не нарушить начало ее образования.
Постановка реакции: В пробирку с 0,5 мл цитратной плазмы, разведенной изотоническим раствором натрия хлорида в соотношении 1:4, вносят петлю суточной культуры стафилококка и ставят в термостат при 37 °С. Осторожно просматривают реакцию плазмокоагуляции через 30 мин, 1 час, 2-4 часа и оставляют до утра при комнатной температуре для окончательного учета. Ускорение реакции производят за счет использования 3-4 часовых бульонных культур, добавляя их в количестве 0,1 мл к 0,5 мл разведенной плазмы.
После полного подтверждения принадлежности выделенных штаммов к St. aureus производят подсчет колоний на плотной среде и устанавливают содержание стафилококков в 1 г (мл) исследуемого продукта.
4.5.3. Определение St. aureus в особо скоропортящихся продуктах, имеющих микробиологический норматив*
_____________________
* - "Временные указания по микробиологическим нормативам для ряда особо скоропортящихся продуктов и методы их исследования", М., 1982 г. Утв. МЗ СССР 30/XII-81 г. N 2510-81
В ряде продуктов общественного питания микробиологические нормативы предусматривают отсутствие St. aureus в 0,1 г и в 1,0 г продукта.
В тех случаях, когда отсутствие St. aureus предусматривается в 0,1 г продукта, необходимо 1 мл 10%-й взвеси продукта, приготовленной в соответствии с п.4.2., внести в 9 мл солевого бульона (6,5% NaCl). В тех случаях, когда отсутствие St. aureus предусматривается в 1 г продукта, для этих целей усредненная проба массой в 10 г растирается в стерильной ступке и отсюда делается навеска на стерильном часовом стекле или стерильном пергаменте массой 1,0 г и засевается в 9 мл солевого бульона.
Посевы инкубируют при 37 °С в течение 18-24 часов. После чего из солевых бульонов производят подтверждающий посев петлей на сектора чашки Петри с желточно-солевым агаром или молочно-солевым агаром. Инкубацию посевов производят при 37 °С в течение 18-24 часов. После чего чашки просматривают. При отсутствии роста типичных колоний для St. aureus делают заключение об отсутствии этого микроорганизма в исследуемой навеске продукта (в 1,0 г или 0,1 г.).
При наличии роста подозрительных на стафилококки колоний производят их изучение, как в п.п.4.5.1. (этапы 2 и 3), 4.5.2.
При наличии коагулазоположительных St. aureus делают заключение о присутствии этого микроорганизма в исследуемой навеске продукта. Следовательно, данный продукт не соответствует требуемому нормативу - "отсутствие St. aureus в 1,0 или 0,1 г продукта".
4.5.4. Дополнительные тесты идентификации St. aureus
При наличии санитарно-эпидемиологического неблагополучия следует использовать дополнительные тесты.
Прежде всего еще раз уточнить реакцию плазмокоагуляции, с этой целью культуру пересевают 2-3 раза на скошенном МПА и повторяют постановку реакции, или рассевают культуру на чашках с мясо-пептонным агаром для проведения повторной идентификации из новых колоний стафилококков. В случае неудовлетворительных результатов целесообразно из первичных посевов взять ряд других колоний и подвергнуть их вновь идентификации.
Если выделенную культуру не идентифицировали как St. aureus, следует использовать дополнительно тесты: постановку реакции на термостабильную ДНКазу, окисление маннита, фосфатазу, лецитовителлазу.
4.5.4.1. Тест на лецитовителлазу
При использовании для первичного посева среды, содержащей желток, специального дополнительного определения лецитовителлазной активности у стафилококков проводить не следует. В случае выделения культур с других сред и необходимости определения у них этого признака на чашку с желточным агаром сеют испытуемую культуру штрихом или бляшкой - последнее экономнее. Чашки инкубируют при 37 °С в течение 18-20 часов. При положительном результате вокруг колонии стафилококка образуется радужный венчик, что обусловлено выделением фермента лецитовителлазы и разложением лецитина, находящегося в среде. Реакцию следует учитывать в отраженном свете.
4.5.4.2. Реакция на разложение маннита в анаэробных условиях
Используют среду, приготовленную из сухого препарата с индикатором ВР и маннитом, разливают в пробирки по 10 мл, стерилизуют при 0,7 атм. 20 минут. Перед посевом среду освобождают от воздуха, для чего пробирки кипятят в водяной бане при 100 °С 10 мин, затем быстро охлаждают в ледяной воде и немедленно производят посев уколом. Сверху засеянную среду заливают расплавленным 2% водным агаром слоем 2-3 см, чтобы исключить попадание воздуха. Посевы термостатируют при 37 °С в течение 4 дней. Просмотр осуществляют на 2 и 4 дни. Результаты расценивают как ферментацию маннита, когда нижняя и верхняя части среды четко изменяют цвет из зеленого на синий. В этом случае микроорганизмы идентифицируют как St. aureus. Если посинеет только верхняя часть среды, то имеет место окисление маннита. Если спустя 4 дня инкубации не произошло посинения, сбраживания маннита не произошло. В 2-х последних случаях микроорганизмы относят к St. epidermidis или St. saprophyticus.
4.5.4.3. Определение активности кислой фосфтазы
Среда: к 100 мл 2% МПА, расплавленного и остуженного до 45 °С, добавляют 50 мг паранитрофенилфосфата натрия, разливают в чашки Петри. Посев производят бляшками - до 20 бляшек на чашку. Реакцию можно учитывать уже через 2 часа инкубации при 37 °С. Вокруг бляшек при положительной фосфатазной пробе среда окрашивается в желтый цвет. Интенсивность окрашивания увеличивается через 18-24 часа - практически окрашивается вся среда.
4.5.4.4. Тест на наличие термостабильной дезоксирибонуклеазы (ДНКазы)
ДНКаза определяется по методу, основанному на метахроматических свойствах толуидина голубого. Этот метод диффузии в агар термостабильной ДНКазы St. aureus, позволяет определить ее в концентрации примерно 0,005 мкг.
Среда: к 1000 мл 0,05 М трио-буфера (оксиметиламинометан), рН 9,0, добавляют 0,3 г ДНК, затем 10,0 г агара дифко, 1 мл 0,01 М СаCl  , 10,0 г NaCl, 3,0 мл 0,1 М толуидина голубого. Среду разливают в пробирки по 12-15 мл, закрывают резиновыми пробками и хранят в холодильнике до 3-5 месяцев. Перед постановкой реакции среду растапливают и разливают в чашки Петри, подсушивают при 4 °С в течение 1 часа, вырезают лунки диаметром 3 мм, отсасывают пипеткой агар и вносят в лунки пастеровской пипеткой культуры, инкубируют при 37 °С.
, 10,0 г NaCl, 3,0 мл 0,1 М толуидина голубого. Среду разливают в пробирки по 12-15 мл, закрывают резиновыми пробками и хранят в холодильнике до 3-5 месяцев. Перед постановкой реакции среду растапливают и разливают в чашки Петри, подсушивают при 4 °С в течение 1 часа, вырезают лунки диаметром 3 мм, отсасывают пипеткой агар и вносят в лунки пастеровской пипеткой культуры, инкубируют при 37 °С.
Перед изучением культур пробирки с суточным ростом стафилококков на полужидком агаре прогревают в кипящей водяной бане 15 минут и вносят в лунки в агаровой пластинке, содержащей толуидин голубой. Зоны просветления с розовым окрашиванием образуются в результате гидролиза ДНК, находящейся в среде, термостабильной ДНКазой стафилококков. Появление через 1-2 часа после внесения розовоокрашенных зон расценивается как положительная реакция на наличие термостабильной ДНКазы.
4.5.8. Идентификация стафилококков
| Дифференцирующие признаки | Наименование вида
| ||
| St. aureus | St. epidermidis | St. saprophyticus | |
| 1. Морфология с окраской по Граму | мелкие кокки, грам + | кокки, грам + | крупные кокки, грам + |
| 2. Реакция плазмокоагуляции | + | - | - |
| 3*. Ферментация маннита в анаэробных условиях | + | - | - |
| ______________ * - тесты на окисление маннита, термоустойчивую ДНКазу и кислую фосфатазу проводят в случае отрицательной р-ции плазмокоагуляции.
| |||
| 4. Лецитовителлазная актив-ть | + | ± | - |
| 5*. Тест на ДНКазу | ± | - | - |
| ______________ * - тесты на окисление маннита, термоустойчивую ДНКазу и кислую фосфатазу проводят в случае отрицательной р-ции плазмокоагуляции
| |||
| 6*. Тест на кислую фосфатазу | - | - | - |
| ______________ * - тесты на окисление маннита, термоустойчивую ДНКазу и кислую фосфатазу проводят в случае отрицательной р-ции плазмокоагуляции
| |||
4.6. Метод определения бактерий рода Proteus
Среди пищевых токсикоинфекций этиологическим фактором могут являться бактерии рода Proteus. Обнаружение небольших количеств протея в исследуемых продуктах не является поводом для подозрения его как возбудителя пищевого отравления. Однако, факт обнаружения протея является сигналом для проведения ряда санитарно-гигиенических и профилактических мероприятий на обследуемых объектах.
К роду Proteus относятся грамотрицательные бескапсульные в основном, подвижные бактерии, разжижающие желатину и расщепляющие (…..)*, не образующие ацетилметилкарбинол и дающие положительную реакцию с метил-рот.
________________________
* Брак оригинала. Примечание "КОДЕКС".
На основании различий по некоторым ферментативным свойствам возможна дифференциация рода Proteus на две биогруппы: Proteus vulgaris, который образует индол, ферментирует мальтозу и не декарбоксилирует орнитин, и Proteus mirabilis, который не образует индола, не ферментирует мальтозу и декарбоксилирует орнитин.
4.6.1. Методика выделения бактерий рода Proteus
1 день.
а) для получения чистой культуры первичный посев исследуемого материала из основного разведения (10% взвесь) производят по 0,6 мл в конденсат свежескошенного агара по методу Шукевича.
На 2-й день просматривают посевы на скошенном МПА, если наблюдается (…..)*зающий нежный вуалеобразный рост, то с верхнего края выросшей культуры готовят препарат, окрашивают по Граму и микроскопируют. При наличии грамотрицательных полиморфных палочек дают заключение о наличии бактерий рода Proteus в исследуемом продукте.
Кроме того, можно использовать посев на поверхности питательной среды Плоскирева или среды Вильсон-Блера, который производят в количестве 2,5 мл исходной взвеси, тщательно втирая шпателем, инкубируют при (.....)* 18-24 часа. На поверхности сред Плоскирева или Вильсон-Блера вырастает О-форма протея. Для получения из О-форм колоний Н-формы одну петлю суточной бульонной культуры протея наносят на поверхность свежеприготовленных 1,5% МПА чашек в центре чашки. Через 16-18 часов инкубирования при 37 °С наблюдается феномен “(…)*рения” - поверхность покрывается тонким слоем налета с голубоватым оттенком.
________________________
* Брак оригинала. Примечание "КОДЕКС".
После инкубации в течение 18-24 часов при 37 °С чашки с посевами просматривают и отмечают колонии, подлежащие дальнейшему исследованию. На среде Плоскирева штаммы растут в виде прозрачных колоний, слегка подщелачивая среду, которая окрашивается вокруг них в желтоватый цвет. При более длительном хранении чашек с посевами колонии мутнеют, а центр их приобретает бурую окраску. На висмут-сульфитном агаре (среда Вильсон-Блера) через 48 часов штаммы вырастают в виде изолированных колоний грязно-коричневого цвета, окраска среды под колониями не изменяется.
Если рост 18-24 часовой культуры однородный, то для дальнейшего изучения используют не менее 3-х колоний. При росте разных колоний для их изучения надо брать больше колоний, различных по внешнему виду.
При наличии характерной микроскопической картины дают заключение о присутствии бактерий рода Proteus в исследуемом продукте*.
____________________
* - Идентификацию бактерий рода Proteus проводят в случае эпидситуации на объекте в соответствии с Инструкцией о порядке расследования, учета и проведения лабораторных исследований в учреждениях санэпидслужбы при пищевых отравлениях, Москва, 1975 г.
Случайные находки бактерий рода Proteus при определении бактерий группы кишечных палочек необходимо отражать в ответе.
4.7. Определение сальмонелл
В соответствии с рекомендациями ФАО/ВОЗ в большинстве пищевых продуктов нормируется отсутствие сальмонелл в определенной массе продукта. Сальмонеллы признаны индикаторными микроорганизмами при контроле пищевых продуктов на возможное присутствие патогенных микроорганизмов.
В особо скоропортящейся продукции общественного питания сальмонеллы не допускаются в 25 г. Анализ проводят в соответствии с Инструкцией о порядке расследования, учета и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях, Москва, 1975.
МЕТОДИКА ИССЛЕДОВАНИЯ СМЫВОВ
5.1. Объем исследования
При текущем санитарном надзоре за предприятиями общественного питания и торговли, детскими и лечебными учреждениями исследование смывов проводят на присутствие бактерий группы кишечных палочек.
Исследование на наличие St. aureus, бактерий рода Proteus, определение общей бактериальной обсемененности производится по показаниям.
Например:
а) Исследование смывов на стафилококки проводят при обследовании кремово-кондитерских цехов, столовых и ресторанов, молочных кухонь и других пищеблоков, обращая особое внимание на контроль рук персонала;
б) общую микробную обсемененность можно определять для установления эффективности санитарной обработки посуды в посудомоечных машинах, а также при оценке новых моющих и дезинфицирующих средств.
В случае повторного обнаружения бактерий группы кишечных палочек и значительном проценте смывов на объекте рекомендуется провести исследование смывов с инвентаря, оборудования и рук персонала на наличие энтеробактерий*.
___________________
* - при исследовании смывов по эпидпоказаниям производят посев тампона в смывной жидкости на среды обогащения - селенитный бульон или магниевую среду (возможно использование сред Мюллера и Кауфмана). Дальнейшее выделение и идентификацию проводят согласно Инструкции о порядке расследования, учета и проведения лабораторных исследований в учреждениях санэпидслужбы при пищевых отравлениях, М., 1975 г.
5.2.1. Методика посева смывов на бактерии группы кишечных палочек
При плановых санитарно-гигиенических обследованиях для выявления БГКП производят посевы смывов на среде Кесслер с лактозой или КОДА, при этом в пробирку со средой опускают тампон и переносят оставшуюся смывную жидкость.
Посевы на средах Кесслер или КОДА инкубируют при 37 °С, через 18-24 часа со среды Кесслер производят высев на плотную дифференциальную среду Эндо, со среды КОДА высев производят только в случае изменения окраски среды или ее помутнения. Дальнейший ход исследования см. п.п.4.4.1.
5.2.2. Методика посева на общую бактериальную обсемененность
для определения общей обсемененности поверхностей, контролируемых предметов взятие смывов производят по методике, описанной выше (п.4.3.), перед посевом в пробирку с тампоном добавляют 5 мл 0,1% пептонной воды или изотонического раствора хлорида натрия. Тампон тщательно отмывают, после чего 1,0 мл смывной жидкости помещают в чашку Петри и заливают расплавленным МПА. Чашки помещают в термостат при 30 °С. Предварительный подсчет выросших колоний производят через 48 часов, окончательный - через 72 часа. Количество колоний, выросших на чашке, умножают на 10 для определения общего количества бактерий, содержащихся на поверхности исследуемого предмета.
5.2.3. Методика посева на St. aureus
Для выявления St. aureus посев смывов производят на чашки с МСА или ЖСА, непосредственно втирая посевной материал тампоном, затем последний погружают в пробирку с 6,5% солевым бульоном. Если необходимо определить и бактерии группы кишечных палочек, то остатки смывной жидкости переносят пипеткой в среды Кесслер или КОДА (п.4.4.1.).
5.2.4. Оценка результатов
Обнаружение санитарно-показательных и условно-патогенных бактерий в смывах с поверхностей чистых, подготовленных к работе предметов, инвентаря и оборудования, а также рук персонала свидетельствует о нарушении санитарного режима и дает основание для проведения административных мер.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД
6.1. Изотонический раствор - 0,85% раствор хлористого натрия
Для приготовления изотонического раствора с рН 6,9-7,0 используют дистиллированную воду рН, которой проверяют индикатором бромтимолбазу, при добавлении которого цвет воды должен быть бутылочно-золотым. В этих случаях воду не используют. Изотонический раствор разливают в пробирки или флаконы в необходимых количествах, стерилизуют при 1 атм. 20 мин.
6.2. 0,1%-й водный раствор пептона (пептонная вода)
К 1 л дистиллированной воды добавляют 1 г пептона. После размешивания среду кипятят, фильтруют и разливают по пробиркам и флаконам в необходимых количествах, стерилизуют при 1 атм. 30 мин.
6.3. Среда для определения общего количества мезофильных аэробных и факультативно анаэробных микроорганизмов
| Сухой питательный агар (ДагНИИПО) | - 35,0 г | |||
| Сухой экстракт кормовых дрожжей | - 2,5 г |
| ||
| Глюкоза | - 1,0 г |
| ||
| Вода дистиллированная | - 1000 мл |
| ||
Довести рН до 7,0, разлить в пробирки по 15 мл, стерилизовать в течение 20 мин при 121 °С (1,1 атм.).
6.4. Среда Кесслер с лактозой
К 1 л водопроводной воды прибавляют 10 г пептона и 50 мл желчи крупного рогатого скота, кипятят смесь при помешивании 20-30 мин в водяной бане и фильтруют через вату. В полученном фильтрате растворяют 2,5 г лактозы и доводят объем до 1 л, устанавливают реакцию среды (рН 7,4-7,6), после чего добавляют 2 мл 1% водного раствора кристаллического фиолетового, разливают в пробирки по 5,0 мл, 10,0 мл и во флаконы по 50 мл. Готовая среда должна иметь темно-фиолетовый цвет. Среду стерилизуют при 1 атм. 10 мин, предварительно опустив в пробирки поплавки.
6.5. Среда КОДА
Среду готовят по прописи на этикетке. Разливают по 5 и 10 мл в пробирки без поплавков.
6.6. Бульон с лактозой, бычьей желчью и бриллиантовым зеленым ЖЛБ
| пептон | - 10 г | |||
| лактоза | - 10 г |
| ||
| сухая бычья желчь | - 20 г (или 200 мл свежей фильтрованной желчи крупного рогатого скота) |
| ||
| бриллиантовый зеленый | - 0,0133 г |
| ||
| дистиллированная вода | - 1000 мл |
| ||
Растворяют пептон и лактозу в 500 мл дистиллированной воды, добавляют бычью желчь, растворенную в 200 мл воды, смешивают, доводят объем до 950 мл, рН до 7,4. Добавляют 13,3 мл 0,1% водного раствора бриллиантового зеленого, доводят общий объем водой до 1 л. Разливают в пробирки с поплавками по 10 мл. Стерилизуют 15 мин при 121 °С.
6.7. ЕС-бульон (для подтверждающего посева на E. coli (по методу НВЧ)*
_____________________
* - пропись ФАО/ВОЗ в модификации Института питания АМН СССР.
| Сухой панкреатический гидролизат казеина | - 20,0 г (или 10-кратное количество жидкого ПГК) с содержанием ок. 500 мг % аминного азота) | |||
| Желчь крупного рогатого скота жидкая | - 15-16 мл |
| ||
| лактоза | - 5 г |
| ||
К  НРО НРО 
| - 4,0 г |
| ||
КН  РО РО 
| - 1,5 г |
| ||
| NaCl | - 5,0 г |
| ||
| дистиллированная вода | - 1000,0 мл |
| ||
Растворяют ингредиенты, доводят рН до 6,9, разливают по 15 мл в пробирки с поплавками, стерилизуют в течение 15 мин при 121 °С.
6.8. Среда Гисса с глюкозой
На 1 л дистиллированной воды берется 10 г пептона, 5 г хлористого натрия, 2,5 г глюкозы. В дистиллированную воду вначале добавляют пептон, хлористый натрий и кипятят до растворения ингредиентов, затем добавляют 10 мл реактива Андреде, устанавливают рН 7,2-7,4, добавляют углевод и фильтруют. Среду разливают в стерильные пробирки с поплавками по 2-3 мл. Стерилизуют при 0,5 атм. 20 мин.
Приготовление индикатора Андреде
Фукоин кислый в количестве 1 г растворяют в 200 мл дистиллированной воды, добавляют 32 мл нормального раствора едкого натра. Полученную смесь настаивают в течение 3 суток при комнатной температуре или в течение суток при 37 °С, после чего фильтруют. Реактив хранят во флаконе с притертой пробкой.
6.9. Среды Эндо, Левина
Среды Эндо, Левина (эозинметиленовоголубой агар) выпускаются в сухом виде Дагестанским НИИ питательных сред, их следует готовить согласно прописям на этикетках банок. Изготовленные и разлитые в стерильные чашки Петри среды можно хранить при температуре 4 °С±1 °С до 10 суток.
6.10. Среда для определения индолообразования
| Сухой панкреатический гидролизат казеина | - 10,0 г | |||
| NаCl | - 5,0 г |
| ||
| Д(…..)* -триптофан | - 1,0 г |
| ||
| Дистиллированная вода | - 1000 мл |
| ||
_________________
* Брак оригинала. Примечание "КОДЕКС".
Довести рН до 7,0, разлить в пробирки по 5 мл, стерилизовать 15 мин при 121 °С.
Реактив на индол
пара-диметиламинобензальдегид - 5,0 г
соляная кислота концентрированная - 25,0 мл
изоамиловый спирт - 75,0 мл
6.11. Бульон на переваре Хоттингера для определения индолообразования
В случае отсутствия среды 6.10. используется для теста на индол.
Для приготовления бульона основной перевар Хоттингера разводят дистиллированной водой (или водопроводной) до содержания аминного азота 120-130 мг%, добавляют хлористый натрий в концентрации, 5%, фосфорнокислый двузамещенный калий (К  НРО
НРО  ) - 0,1%. Устанавливают рН 7,4-7,6 и кипятят 15-20 минут. Приготовленный бульон фильтруют через ватно-марлевый фильтр, разливают в пробирки по 5-8 мл. Стерилизуют при 1 атм. 20 мин.
) - 0,1%. Устанавливают рН 7,4-7,6 и кипятят 15-20 минут. Приготовленный бульон фильтруют через ватно-марлевый фильтр, разливают в пробирки по 5-8 мл. Стерилизуют при 1 атм. 20 мин.
Индикаторная бумажка на индол
| Спирт этиловый 96° | - 50 мл | |||
| Парадиметиаминобензальдегид | - 2,5-3 г |
| ||
| Фосфорная кислота (конц.) | - 10 мл |
| ||
Добавленные в спирт ингредиенты смешать до полного растворения. Полученной желтоватой жидкостью смочить край, приблизительно на 1/3, полоски фильтровальной бумаги. Цвет смоченного конца полоски бумаги должен быть желтым. При образовании индола изучаемой культурой цвет бумажки меняется от сиренево-розового до интенсивно-малинового.
6.12. Среда Кларка
Пептон - 5-7 г
Глюкоза - 5 г
К  НРО
НРО 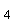 - 5 г
- 5 г
дистиллированная вода - 1000 мл
Растворить ингредиенты, довести рН до 6,9 и профильтровать, стерилизовать 20 мин при 115 °С.
6.13. Раствор метилового красного для теста с метил-рот
Растворить 0,1 г метилового красного в 300 мл 90% этилового спирта. Развести до 500 мл стерильной водой, хранить при +4 °С
6.14. Реактивы для реакции Фогеса-Проскауэра
5% альфа-нафтол: растворить 5,0 г альфа-нафтола в 100 мл абсолютного этилового спирта. Хранить при +4 °С.
40% КОН. Растворить 40 г гранул КОН приблизительно в 60 мл дистиллированной воды. Разбавить до 100 мл дистиллированной водой. Хранить при +4 °С.
6.15. Цитратная среда Козера
Na(NH  )HPO )HPO
| - 1,5 | |||
К  НРО НРО 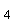
| - 1,0 г |
| ||
| магния сульфат | - 0,2 г |
| ||
| натрия цитрат трехзамещенный | - 3,0 г |
| ||
| дистиллированная вода | - 1000 мл |
| ||
Растворить ингредиенты в 950 мл дистиллированной воды, добавить 10 мл 0,5% спиртового раствора бромтимолового синего. Установить рН 6,8, проверяя значение рН на потенциометре. Довести объем дистиллированной водой до 1 л. Разлить в пробирки по 10 мл, стерилизовать в течение 15 мин при 121 °С.
6.16. Среда Симмонса
Среда готовится аналогично среде Козера (6.15.), но после измерения рН в нее добавляют 20 г±0,1 г агар-агара на 1 л, прогревают на водяной бане до растапливания агара, стерилизуют в течение 15 мин при 121 °С. Разливают в стерильные чашки Петри или пробирки.
6.17. Среда Ресселя с мочевиной из сухих питательных сред
К 100 мл горячей стерильной дистиллированной воды добавляют 4 г сухого препарата с индикатором ВР и лактозой, 0,1 г глюкозы и 1 г мочевины. Полученную среду разливают в стерильные пробирки по 5-6 мл и стерилизуют при 0,5 атм. 20 мин или текучим паром 2 дня подряд по 15-20 мин.
6.18. Трехсахарный агар с мочевиной по Олькеницкому
К 100 мл стерильного питательного агара добавляют 1 г лактозы, 0,02 г соли Мора, 0,03 г гипосульфита, 1 г сахарозы, 0,1 г глюкозы, 1 г мочевины и 0,4% раствора фенолового красного 0,4 мл. Предварительно растворяют соль Мора с гипосульфатом в одной пробирке с небольшим количеством воды, а в другой мочевину с углеводами. После растворения все смешивают с агаром и фильтруют через стерильную марлю. Стерилизуют текучим паром 3 дня подряд по 20 мин. Горячую среду скашивают в пробирках. Незасеянная среда имеет бледно-розовый цвет.
6.19. Солевой бульон
К 100 мл МПБ с рН 7,0 добавляют 6,5 г хлористого натрия. Разливают в пробирки по 5,0 мл и стерилизуют при 1 атм. 20 мин.
6.20. Сахарный бульон
К 100 мл стерильного бульона Хоттингера с рН 7,2-7,4 и содержанием 130-150 мг% аминного азота добавляют глюкозу в количестве 1,0 г. После растворения среду разливают в пробирки по 5,0 мл и стерилизуют при 0,5 атм. в течение 20 мин.
6.21. Стерильное молоко
Стерильное молоко готовят из обезжиренного молока (кислотность 16-18 °Т), которое разливают в пробирки по 10 мл. Стерилизуют при 0,75 атм. 15 мин. Обезжиренное молоко получают путем центрифугирования или кипячения с последующим отстаиванием в цилиндре в холодильнике в течение 2 дней.
6.22. Молочно-солевой агар
К 100 мл расплавленного и остуженного до 45 °С 2% питательного агара с концентрацией 6,5% хлористого натрия добавляют в количестве 10 мл стерильное обезжиренное молоко. Среду тщательно перемешивают и разливают по чашкам.
6.23. Желточно-солевой агар
Желточно-солевой агар может быть приготовлен на основе сухого питательного агара, мясо-пептонного бульона или бульона Хоттингера.
При использовании МПБ к последнему добавляют 2% агар-агара и 6,5% хлористого натрия. При использовании бульона Хоттингера содержание аминного азота в нем должно составлять 150 мг%, для получения солевого агара добавляют 2% агар-агара и 6,5% хлористого натрия.
В случае использования сухого питательного агара к последнему добавляют 6,5% хлористого натрия.
Солевой агар разливают во флаконы по 200 мл и стерилизуют при 1 атм. 30 мин.
Приготовление рабочего раствора желтка
На дно стерильной чашки помещают яйцо, которое тщательно протирают ватой, смоченной спиртом. Пинцетом пробивают, с двух противоположных сторон яйца, два отверстия. Через одно из этих отверстий из яйца полностью удаляют белок, а затем, несколько увеличив отверстие, выливают желток в стерильную банку с 5-6 бусинами. К желтку постепенно добавляют, частями по 20-30 мл стерильного изотонического раствора NаCl, затем содержимое тщательно встряхивают.
Приготовление чашек
На 100 мл расплавленного и остуженного до 45 °С солевого агара добавляют 20 мл рабочего раствора желтка. После полного размешивания агар в условиях бокса разливают в чашки по 15-17 мл. Чашки можно хранить в холодильнике до 1,5-2 недель.
6.24. Молочный агар
К 100 мл 2% расплавленного и остуженного до 45 °С питательного агара добавляют 10 мл стерильного снятого молока. После тщательного перемешивания агар выливают в чашки по 12-15 мл.
6.25. Цитратная плазма кролика
Цитратная плазма кролика для реакции плазмокоагуляции выпускается в сухом виде. Готовят непосредственно перед употреблением согласно прописи в прилагаемом наставлении.
6.26. Среда для определения реакции окисления маннита в анаэробных условиях
Среду готовят из сухого препарата с индикатором ВР и маннитом по прописи на этикетке. Среду разливают в пробирки по 12-15 мл.
6.27. Среда Плоскирева из сухих питательных сред
Среду готовят по прописи на этикетке.
6.28. Висмут-сульфит агар (среда Вильсон-Блера)
Среду готовят по прописи на этикетке. Изготовленную и разлитую в стерильные чашки Петри среду можно хранить в холодильнике при +4 °С до 10 суток.
6.29. Среда для определения ферментации мальтозы
Среду готовят из сухого препарата с индикатором ВР и мальтозой по прописи на этикетке. Среду разливают в пробирки по 2-3 мл.
Дата добавления: 2018-10-26; просмотров: 198; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
