Основные характеристики горючих газов

 Химическая формула газа отражает элементный химический состав последнего и позволяет отчасти представить его химические и физические свойства. Так, углеводородные газы состоят из простых углеводородных соединений, являющихся органическими веществами, содержащими в своем составе два химических элемента: углерод С и водород Н2. Самый простой углеводород, содержащий всего один атом углерода, – метан СН4. Все углеводороды, имеют общую формулу – СmHn, входят в гомологический ряд так называемых предельных или насыщенных углеводородов – соединений, в которых углерод до предела насыщен атомами водорода. При температуре 0 °С и давлении 760 мм рт. ст. изпредельных углеводородов газами являются лишь метан – СН4, этан – С2Н6, пропан – С3Н8 и бутан – С4Н10. Наряду с нормальными предельными углеводородами существуют так называемые изомерные соединения, имеющие одинаковые с первыми химические формулы, но отличающиеся от них характером расположения атомов углерода, а также некоторыми свойствами. Пропан изомера не имеет. Начиная с бутана, каждая суммарная формула алканов охватывает несколько углеводородов, имеющих одинаковые молекулярные массы, но разную структуру. Так формуле С4Н10 отвечают два бутана: СН3–СН2–СН5–СН3 нормальный бутан; СН3–СН–СН3–СН3 изобутан. Изомер бутана – изобутан. Для обозначения нормального бутана используют русскую строчную курсивную букву «н»и записывают н-бутан, а к химической формуле изобутана добавляют приставку изо (также курсивом) и записывают изо-С4Н10 либо i-С4H10. Кроме предельных и их изомеров в составе сжиженных углеводородов могут присутствовать ненасыщенные или непредельные углеводороды, характеризующиеся двойной или тройной связью между атомами углерода. Это этилен – С2Н4, пропилен – С3Н6, бутилен – C4H8 и изобутилен – i-C4H8. Непредельные углеводороды с называются олефинами, или алкенами. Топливные газы представляют собой смесь отдельных газов, но при рассмотрении теплотехнических характеристик этой смеси нужно учитывать, что ее компоненты не вступают в химические реакции друг с другом.
Химическая формула газа отражает элементный химический состав последнего и позволяет отчасти представить его химические и физические свойства. Так, углеводородные газы состоят из простых углеводородных соединений, являющихся органическими веществами, содержащими в своем составе два химических элемента: углерод С и водород Н2. Самый простой углеводород, содержащий всего один атом углерода, – метан СН4. Все углеводороды, имеют общую формулу – СmHn, входят в гомологический ряд так называемых предельных или насыщенных углеводородов – соединений, в которых углерод до предела насыщен атомами водорода. При температуре 0 °С и давлении 760 мм рт. ст. изпредельных углеводородов газами являются лишь метан – СН4, этан – С2Н6, пропан – С3Н8 и бутан – С4Н10. Наряду с нормальными предельными углеводородами существуют так называемые изомерные соединения, имеющие одинаковые с первыми химические формулы, но отличающиеся от них характером расположения атомов углерода, а также некоторыми свойствами. Пропан изомера не имеет. Начиная с бутана, каждая суммарная формула алканов охватывает несколько углеводородов, имеющих одинаковые молекулярные массы, но разную структуру. Так формуле С4Н10 отвечают два бутана: СН3–СН2–СН5–СН3 нормальный бутан; СН3–СН–СН3–СН3 изобутан. Изомер бутана – изобутан. Для обозначения нормального бутана используют русскую строчную курсивную букву «н»и записывают н-бутан, а к химической формуле изобутана добавляют приставку изо (также курсивом) и записывают изо-С4Н10 либо i-С4H10. Кроме предельных и их изомеров в составе сжиженных углеводородов могут присутствовать ненасыщенные или непредельные углеводороды, характеризующиеся двойной или тройной связью между атомами углерода. Это этилен – С2Н4, пропилен – С3Н6, бутилен – C4H8 и изобутилен – i-C4H8. Непредельные углеводороды с называются олефинами, или алкенами. Топливные газы представляют собой смесь отдельных газов, но при рассмотрении теплотехнических характеристик этой смеси нужно учитывать, что ее компоненты не вступают в химические реакции друг с другом.
|
|
|
Масса т, физическая величина, являющаяся мерой инертности и тяготения вещества (жидкости, газа). Измеряется в килограммах (кг). Однако масса не является мерой количества вещества. Единицей количества вещества считается моль, который равен количеству вещества системы, содержащей столько же структурных элементов (атомов, молекул), сколько атомов содержится в углероде массой 0,012 кг. Массу одного моля (киломоля) М называют молярной массой.
Объем газов Vизмеряют в кубических метрах (м3). Вследствие того, что объем газов изменяется при нагревании, охлаждении и сжатии, за его единицу принимают 1 м3 газа при нормальных условиях. Если температура t или давление Р отличаются от нормальных, то объем газа при нормальных условиях V0определяется по формуле
|
|
|

где V – объем газа, измеренный при рабочих условиях, м3; Рd – барометрическое давление, кПа, нормальное атмосферное давление Рd = 101,3 кПа; Ри – избыточное давление (измеренное манометром), кПа; Р – абсолютное давление, кПа, Р = Рd + Ри; t – температура, °С.
Основными точками для градуировки шкалы являются: температура плавления льда 0 °С и температура кипения воды 100 °С при нормальном атмосферном давлении 101,325 кПа; Т – абсолютная температура, К (абсолютная температура Т связана с температурой в градусах Цельсия t уравнением Т = t + 273 °С, абсолютный нуль температуры в градусах Цельсия равен – 273,15 °С).
Плотность газа – r характеризует его массу, приходящуюся на единицу объема (кг/м3). Известно, что плотность газов и их объем зависят от температуры. С повышением температуры объем газа в незамкнутых пространствах увеличивается, а в замкнутых возрастает его избыточное давление. В обоих случаях изменяется плотность газа. Для возможности сравнения свойств различных газов основные их характеристики должны быть приведены к одинаковым условиям. В технических расчетах это нормальные условия (Р = 760 мм рт. ст. t = 0 °С).
|
|
|
В финансовых же расчетах между поставщиками и потребителями газа применяют стандартные условия. В этом случае фактический объем газа, измеренный приборами учета при рабочем давлении и температуре, приводят с помощью специальных таблиц к объему при давлении 760 мм рт. ст. и температуре 20 °С. Плотность газа при нормальных условиях обозначается r0.
Зависимость изменения плотности при изменениях температуры и давления может быть выражена для газа однокомпонентного состава формулой
 ,
,
где r – плотность газа при температуре отличной от 0 °С; r0 – плотность газа при температуре 0 °С и давлении 760 мм рт.ст.; Р – фактическое избыточное давление, мм рт. ст.; Рd – атмосферное (барометрическое) давление, мм рт. ст.; t – температура газа, °С; Р – абсолютное давление, мм рт. ст.; Т – абсолютная температура, К;
Плотность сложных газов при нормальных физических условиях может быть определена по формуле
rсм = 0,01(Sri × ri),
rсм = 0,01(r1r1 + r2r2 + ... + rn rn) = 0,01(0,72×СН4 + 1,35×С2Н6 +
+ 2,01×С3Н8 + 2,7×С4Н10 + 3,22×С5Н12 + 1,53×Н2S + 1,97×СО2 +
|
|
|
+ 1,25×N2) кг/м3;
ρ1, ρ 2, ..., ρn – плотность компонентов газа, кг/м3;
r1, r2, ..., rn – содержание компонентов, %.
Удельный объем v – величина обратная плотности r, определяющая отношение объема газа (м3) к его массе (кг), измеряется в кубических метрах на килограмм (м3/кг).
Давление – физическая величина, характеризующая интенсивность нормальных (перпендикулярных к поверхности) сил, с которыми одно тело действует на поверхность другого. В газовой среде давление связано с передачей импульса при столкновениях находящихся в тепловом движении молекул газа друг с другом или с поверхностью граничащих с газом тел. В СИ единица измерения давления – паскаль (Па). Паскаль равен давлению, вызываемому силой 1Н (ньютон), равномерно распределенной по нормальной (вертикальной) к ней поверхности площадью 1 м2. Удобно использовать Па×10 , т. е даПА так как давление выраженное в даПа равно величине давления выраженному в мм. рт. ст. На практике еще действующей единицей давления является техническая атмосфера (1 атм), равная в системе МКГСС давлению 1 кгс на поверхность 1 см2 (1 кгс/см2). Многие страны пользуются единицей давления – бар. Соотношения наиболее употребляемых в теплотехнике единиц, включая единицы давления, приводятся в табл. 4.
Для паров и газов различают избыточное Pи, абсолютное Pаи парциальное Pпдавление. Причем абсолютное давление включает в себя избыточное давление (измеренное манометром) и барометрическое (атмосферное давление на данный момент).
Поскольку топливные газы практически всегда являются смесями отдельных (идеальных) газов, не вступающих между собой в химические соединения, то каждый идеальный газ, входящий в смесь, распространяется по всему объему смеси и имеет свое давление, называемое парциальным. Согласно закону Дальтона общее давление смеси равно сумме давлений отдельных газов, образующих эту смесь
Pa = P1 + P2 + ...+ Pn.
Таблица 4
Соотношение единиц давления
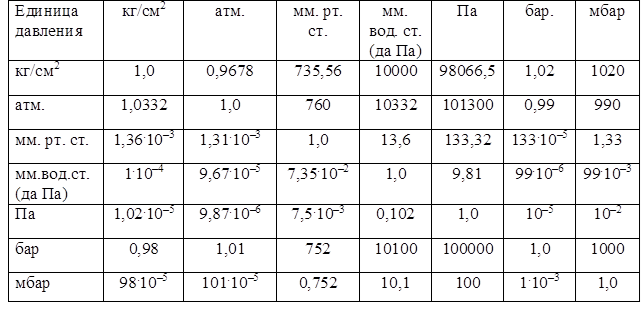
При этом парциальное давление каждого компонента смеси pi равно общему давлению, умноженному на объемное (молярное) содержание yi данного газа в смеси:
pi = yi Pи.
Давление избыточное Pи газов в практике их использования является одним из основных показателей, определяющих технику и технологию их применения. Системы газоснабжения по этому показателю подразделяются на четыре градации:
высокого давления I категории при избыточном давлении от 1,2МПа до 0,6МПа включительно для природного газа и газовоздушных смесей, и от 1,6МПа для сжиженных углеводородных газов (СУГ);
газопроводы высокого давления II категории при избыточном давлении газа свыше 0,3 МПа (3 кгс/см2) до 0,6 МПа (6 кгс/см2);
газопроводы среднего давления – при рабочем давлении свыше 500 даПа (0,05 кгс/см2) до 0,3 МПа (3 кгс/см2);
газопроводы низкого давления – при рабочем давлении газа до 500 даПа (0,05 кгс/см2) включительно.
Теплота сгорания Q – количество тепла, которое выделяется при полном сгорании единицы массы или объема газа (топлива). Теплоту сгорания газов в СИ измеряют в кило(мега) джоулях на килограмм (кДж/кг, МДж/кг) или в кило (мега-) джоулях на кубический метр (кДж/м3, МДж/м3), а на практике – нередко в килокалориях на килограмм (ккал/кг) или в килокалориях на кубический метр (ккал/м3), а так же в кВт.
Соотношения между единицами теплоты сгорания газов
1ккал/м3 = 4,19 кДж/м3; 1ккал / (ч×м2)  = 1,16 Вт/м2; 1МДж = 3,6 кВт
= 1,16 Вт/м2; 1МДж = 3,6 кВт
Для оценки тепловых свойств газов могут применяться низшая QH и высшая QB теплота сгорания. QH отличается от QB тем, что она не включает в себя скрытую теплоту испарения водяных паров, образующихся при сгорании одной единицы топлива. Поэтому не следует понимать показатель низшей и высшей теплоты сгорания как некие пределы, в границах которых колеблется теплообразующая способность топлива. Теплота сгорания некоторых индивидуальных газов, входящих в состав топливных углеводородных газов, приведена в табл. 4.
Определение низшей теплоты сгорания сложного газа
Qн = 0,01(SQ н i × CmHn), кДж/м³
где Q н i – низшая теплота сгорания отдельного компонента; CmHn – процентное содержание горючего в смеси газа.
Qн = 0,01(35880×CH4 + 64360×C2H6 + 93180×C3H8 +
+ 123600×C4H10), кДж/м³
Число Воббе W o – показатель, также характеризующий тепловые свойства газа во взаимосвязи с его относительной плотностью. Определяется по формуле:
 или
или 
где Woн и Woв – число Воббе низшее и высшее, кДж/м3; Qн – низшая теплота сгорания газа, кДж/м3; Qв – высшая теплота сгорания газа, кДж/м3; d – относительная плотность газа.
Определение относительной плотности

где rсм – плотность смеси сложного газа при нормальных физических условиях, кг/м3; rв =1,29, кг/м3 – плотность воздуха при нормальных физических условиях.
Равенство чисел Воббе  указывает на взаимозаменяемость газов, т. е. возможность их использования в одном горелочном устройстве без изменений конструкции последнего. Практически считается, что взаимозаменяемость газов без нарушения нормальной работы газогорелочных устройств возможна при колебаниях числа Воббе в пределах ±5% номинального значения и равенстве скоростей распространения пламени. ПГ и СУГ имеют скорость распространения пламени 0,36–0,37 м/сек. Скорости распространения пламени ИГ и БГ значительно отличаются от скорости сгорания ПГ и СУГ из-за присутствия в них значительного количества балластных газов и водорода.
указывает на взаимозаменяемость газов, т. е. возможность их использования в одном горелочном устройстве без изменений конструкции последнего. Практически считается, что взаимозаменяемость газов без нарушения нормальной работы газогорелочных устройств возможна при колебаниях числа Воббе в пределах ±5% номинального значения и равенстве скоростей распространения пламени. ПГ и СУГ имеют скорость распространения пламени 0,36–0,37 м/сек. Скорости распространения пламени ИГ и БГ значительно отличаются от скорости сгорания ПГ и СУГ из-за присутствия в них значительного количества балластных газов и водорода.
Температура воспламенения – это минимальная температура, при которой газовоздушная смесь воспламеняется. Для большинства горючих газов температурой воспламенения является температура открытого огня самого различного происхождения: пламени спички, зажженной сигареты, ударной или электрической искры. Например, температура воспламенения газовоздушной смеси метана 645, пропана 490, бутана 475 °С. Значения минимальных температур воспламенения газовоздушных смесей приведены в табл. 4.
Максимальная температура продуктов полного сгорания газов адиабатических условиях при температуре газа и воздуха равной 0 °С – tж (жаропроизводительность). Это максимальная температура, которую будут иметь продукты сгорания газа (табл. 4). Максимальная температура горения углеводородных газов достигается при осуществлении комплекса условий, обеспечивающих полноту их сгорания. К этим условиям относятся обеспечение стехиометрического состава газовоздушной смеси, поддержание стабильной температуры горения в течение экзотермической реакции окисления горючих компонентов газа кислородом воздуха.
Сложность практического создания указанных условий объясняет значительную разницу между теоретической максимальной температурой и температурой, действительно достигаемой при сжигании топлива. Так, теоретическая температура горения большинства углеводородных газов приблизительно одинакова и равна 2000 °С, а температура, создаваемая, например, в топочном пространстве паровых котлов, составляет 1200–1400 °С.
Пределы воспламеняемости. Диапазон необходимой концентрации газа в смеси с воздухом, при котором возможна реакция окисления (горения), начинающаяся с внесением открытого огня или другого источника высокой температуры, называют пределами воспламеняемости или пределами взрываемости. Минимальное процентное (по объему) содержание горючего газа в смеси с воздухом, при котором с введением источника огня начинается реакция горения горючих компонентов газа, называют нижним пределом воспламеняемости (взрываемости) Lн, а максимальное – верхним пределом воспламеняемости (взрываемости) Lв в % объемных. Значения пределов воспламеняемости отдельных горючих газов приведено в табл. 4. При содержании газа в газовоздушной смеси меньше нижнего предела воспламеняемости горения не будет. Если газа в газовоздушной смеси больше верхнего предела воспламеняемости, эта смесь может гореть, взрыва не будет. Воздуха в этой смеси не достаточно для сгорания газа, присутствующего в смеси, поэтому сгорит столько газа на сколько хватит воздуха.
Пределы воспламеняемости (взрываемости) сложных газов можно определить по формуле Ле Шателье:

где 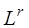 – нижний или верхний предел воспламенения сложного газа в газовоздушной или газокислородной смеси, % об.;
– нижний или верхний предел воспламенения сложного газа в газовоздушной или газокислородной смеси, % об.;  – нижние или верхние пределы воспламения отдельных компонентов сложного газа в газовоздушно смеси в % об. по данным табл. 2;
– нижние или верхние пределы воспламения отдельных компонентов сложного газа в газовоздушно смеси в % об. по данным табл. 2;  –содержание отдельных компонентов в сложном газе, % об.;
–содержание отдельных компонентов в сложном газе, % об.;  ;
;
При наличии в газе небольшого количества балластных примесей пределы воспламеняемости могут быть определены по формуле:
Нижний предел воспламеняемости с балластом:

где  – нижний или верхний предел воспламенения смеси, содержащей инертные (балластные) примеси, % об.;
– нижний или верхний предел воспламенения смеси, содержащей инертные (балластные) примеси, % об.;  – нижний или верхний предел воспламенения горючей части смеси, % об.;
– нижний или верхний предел воспламенения горючей части смеси, % об.;  – содержание балластных примесей (СО2 и N2), в долях единицы.
– содержание балластных примесей (СО2 и N2), в долях единицы.
При содержании в газе балластных примесей для определения пределов воспламеняемости необходимо пересчитать процентное содержание горючей части. Например, в смеси присутствует 90 процентов горючих газов и 10 процентов не горючих, т. е. балласта. Принимаем 90% за 100% и определяем для каждого горючего компонента смеси его новое процентное количество. Определение нового процентного содержания горючих компонентов выполняют следующим расчетом:




Дата добавления: 2018-09-23; просмотров: 444; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
