Ультразвук - это волны с частотами больше 20 кГц.
142.Интенсивность звука - величина, определяемая средней по времени энергией, переносимой звуковой волной за 1 с через площадку 1 м2, перпендикулярную направлению распространению волны. I = W/St
Молекулярная физика. Тепловые явления.
143.Молекулярная физика - раздел физики, изучающий строение и свойства вещества, исходя из молекулярно-кинетических представлений о его строении.
144. Основные положения молекулярно-кинетической теории:
Все тела состоят из атомов, молекул и ионов, имеющих в свою очередь сложное строение.
Атомы, молекулы и ионы находятся в непрерывном хаотическом движении, называемом тепловым. Скорость этого движения зависит от температуры.
Между атомами и молекулами существуют силы взаимного притяжения и отталкивания.
145. Экспериментальным подтверждением справедливости первых двух положений являются диффузия, броуновское движение, растворимость и др.
146. Диффузия - это явление самопроизвольного проникновения молекул одного вещества в промежутки между молекулами другого вещества, происходящее в результате теплового движения.
146а Броуновское движение - это движение мельчайших макроскопических тел (пылинок, цветочной пыльцы, частичек туши и т.д.) под действием ударов со стороны молекул жидкости или газа. Подтверждением справедливости третьего положения служит явление возникновения сил упругости при деформации тел.
|
|
|
147. Диаметр молекул имеет порядок 10-10 м, а масса - 10-26 кг.
148.Количество вещества - величина, равная числу структурных элементов (атомов, молекул, ионов), составляющих систему. n = N/NA=m/m, где N - число частиц, NA - постоянная Авогадро, m – масса вещества, m - молярная масса вещества. Единицей количества вещества является 1 моль.
149. 1 Моль - это порция молекул, равная числу Авогадро. Nа=6,025.1023 1/моль. Более точное определение 1 Моля: это порция молекул или других структурных единиц вещества, в которой содержится столько же молекул или других структурных единиц, сколько их содержится в 0,012 кг углерода.
150.Молярная масса - это масса одного моля данного вещества. Единицей молярной массы являетсякг/моль.
150.а. Относительная молекулярная масса – это величина численно равная отношению массы молекулы данного вещества к 1/12 массы изотопа атома углерода 6С12. Измеряется в углеродных единицах (у. ед) или атомных единицах (а.ед.м.)
151. Число N молекул в теле массой m можно подсчитать по формуле: N= n Na=mNa/M, где n- количество вещества, Na- число Авогадро, М - молярная масса вещества, из которого состоит тело.
151.а. Число молекул в единице объёма n (концентрация молекул) можно подсчитать по формуле: 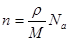 , где
, где  – плотность вещества, Na – число Авогадро, М – молярная масса вещества
– плотность вещества, Na – число Авогадро, М – молярная масса вещества
|
|
|
152. Идеальным называется газ, потенциальная энергия взаимодействия, между молекулами которого равна нулю.
153. Основное уравнение МКТ: 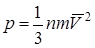 , где n - число молекул в единице объёма, m - масса молекулы,
, где n - число молекул в единице объёма, m - масса молекулы,  - cредний квадрат скорости.
- cредний квадрат скорости.
154.  , где р давление,
, где р давление, 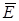 - средняя кинетическая энергия молекул.
- средняя кинетическая энергия молекул.
155. Средняя квадратичная скорость молекул  , где М – молярная масса вещества, m – масса молекулы.
, где М – молярная масса вещества, m – масса молекулы.
156. Средняя кинетическая энергия поступательного движения молекулы идеального газа
 ,
,
157. Зависимость давления газа от концентрации молекул и температуры: p = nkT
158.Температура - величина, характеризующая состояние термодинамического (теплового) равновесия макроскопической системы.
159.Абсолютный нуль температуры - это предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объёме или объём идеального газа стремиться к нулю при неизменном давлении.
Можно сформулировать иначе: Абсолютный нуль температуры- это предельная температура, при которой прекращается поступательное движение молекул.
|
|
|
160.Абсолютная (термодинамическая) шкала - это шкала температур, в которой за начало отсчета принят абсолютный нуль. Единица температуры в этой шкале - кельвин (К), величина которого совпадает с градусом Цельсия. В шкале Цельсия абсолютный нуль равен -273,150 С. Связь между абсолютной температурной шкалой и шкалой Цельсия выражается формулой Т = (t + 273) К
161.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона): pV=mRT/M= n RT, где р - давление, V-объём, R=8,31Дж/(моль.К) - универсальная газовая постоянная, T-абсолютная температура, M-молярная масса газа, n - количество вещества. Или р= r RT / m , где r - плотность газа.
162.Уравнение Клапейрона или объединённый газовый закон: при постоянной массе газа PV/T = const
163.Изотермическим называется процесс, протекающий при постоянной температуре. Если при этом масса газа не изменяется, то процесс подчиняется закону Бойля-Мариотта. Формулировка закона: Для данной массы газа произведение давления на объём при постоянной температуре есть величина постоянная. pV=const. Или p 1 V 1 = p 2 V 2 =….
164.Изобарным называется процесс, протекающий при постоянном давлении. Если масса газа не меняется, то процесс подчиняется закону Гей-Люссака. V/T=const. Для данной массы газа при постоянном давлении отношение объёма к абсолютной температуре есть величина постоянная.
|
|
|
165.Изохорным называется процесс, протекающий при постоянном объёме. Если масса газа постоянна, то процесс подчиняется закону Шарля. Для данной массы газа при постоянном объёме отношение давления к абсолютной температуре есть величина постоянная. Р/T=const.
Дата добавления: 2018-09-22; просмотров: 179; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
