Радон. Радиоактивный и инертный
Открытие радона происходило несколько раз. Причем каждое новое открытие не опровергало предыдущее, а дополняло его. В период 1900-1904 года Резерфорд и Оуэнс, Рамзай и Содди, Дебьерн, Дорн независимо друг от друга продолжали работы супругов Кюри в области радиоактивности. Все они совершили открытие «нового элемента», обнаружив новые радиоактивные газообразные элементы. Но по факту все они открыли радиоактивные изотопы одного и того же элемента – радона. В те времена не было понятия о нейтронах, протонах и устройстве атома и, в частности, ядра.
Все открытые «новые элементы» имели разные периоды полураспада, по которым их собственно и идентифицировали. Дорн открыл самый долгоживущий изотоп 222Rn с периодом полураспада 3,82 дня. Он образуется в цепочке радиоактивного распада 238U. Резерфорд и Оуэнс открыли изотоп 220Rn с периодом полураспада 54,5 секунды. Он образуется в цепочке радиоактивного распада тория. Дебьерн тоже открыл члена радиоактивного семейства тория, но изотоп 219Rn с периодом полураспада 4 секунды. Так как все они были получены из твердых минералов, то назывались эманациями. Эманирование – это выделение газа твердыми телами. Позже данному элементу было подобрано название радон, которое созвучно с названиями других инертных газов: неон, аргон, криптон, ксенон.
Применение радона обусловлено его свойствами. Так, например, его радиоактивность применяется в медицине. Из этого элемента делают радоновые ванны: в воде растворяют микроколичества радона, а затем пациенты принимают такие ванны. Вдыхать радон небезопасно. Мало того, что он радиоактивен, так и его дочерние продукты деления тоже радиоактивны. Поэтому при приеме ванн воздушное пространство и содержимое ванны разделяют, и пациент не дышит испарениями из воды.
|
|
|
Также было обнаружено, что в подземных водах вблизи землетрясений повышается концентрация радона до самого землетрясения. Этот факт стали применять для прогнозирования землетрясений.
Оганесон. Последний
Это 118-ый и самый последний химический элемент, который удалось синтезировать ученым. Известно про него совсем немного: он относится к инертным газам и обладает радиоактивностью. О химических и физических свойствах говорить сложно, так как в Дубне было получено всего 3 атома оганесона. Хватит пальцев одной руки, чтобы пересчитать, и то, лишние останутся.

Существуют ли элементы после оганесона, например 119, 120 и т. д., пока никто не знает.
118-ый элемент на данный момент является краем науки о веществе. Предполагается, что где-то там возможно существование стабильных изотопов разных элементов. Но это вопрос будущего. Возможно именно ты, дорогой читатель, выучишься на физика-ядерщика и займешься данными исследованиями в научном институте в городе Дубне.
|
|
|
На заметку:
Начиная с висмута, включительно, все элементы до 118-ого имеют только радиоактивные изотопы. Рано или поздно они распадутся с образованием стабильных изотопов других, более легких элементов.
Стоит отметить, что оганесон впервые синтезирован и определен, и был получен именно новый элемент, в научном институте в городе Дубна Московской области коллективом под руководством Юрия Цолаковича Оганесяна. Право давать имя новым открытым элементам дается их первооткрывателям. Коллектив, работавший над его синтезом, выдвинул вариант «оганесон». Здесь отметим, что выдвигаемое название должно быть удобным в произношении практически на всех языках мира. И окончательное решение по присвоению имени принимает международная комиссия из ИЮПАК/IUPAC (International Union of Pure and Applied Chemistry/ Международный союз теоретической и прикладной химии).
После долгих обсуждений и неоспоримых доказательств, что 118-ый элемент был получен именно коллективом ученых из Дубны, в 2016 году комиссия ИЮПАК приняла решение утвердить название оганесон. Это второй случай, когда имя новому элементу, названного в честь его первооткрывателя, дают при жизни самого первооткрывателя. Например, Эйнштейн совсем чуть-чуть не дожил до присвоения 99-ому элементу имени эйнштейний.
|
|
|
Галогены
В следующем столбце, который находится слева от инертных газов, находятся элементы, которые называют галогенами.
Все они имеют ns2np5 конфигурацию внешней электронной оболочки. Каждому из них не хватает всего одного электрона, чтобы полностью заполнить шестью электронами свой внешний р-уровень. И все они стремятся сделать это, чтобы быть такими же, как инертные газы. Это стремление, собственно, и определяет химические свойства данных элементов.
Проще всего отобрать электрон у щелочных металлов. Он у них всего один на внешнем уровне. До заполнения всего уровня очень далеко. Поэтому мы ежедневно сталкиваемся с такими соединениями, как самая обычная поваренная соль. Это хлорид натрия NaCl. Соединение хлора – галогена и натрия – щелочного металла.
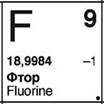
Соединения фтора называют фторидами (KF), соединения хлора – хлоридами (NaCl), соединения брома – бромидами (KBr), соединения йода – йодидами (KI). Все достаточно просто и запоминается легко.
|
|
|
Причем самый «злой» из всех галогенов – это фтор. Его атом самый маленький из них, поэтому желание получить всего один электрон самое большое. У остальных галогенов все больше и больше электронные оболочки, внешний электронный уровень все дальше и дальше от ядра, поэтому желание получить еще один электрон все меньше. Но это не значит, что они безопаснее. Нет, конечно же.
Это свойство также хорошо видно, если взять, например, раствор иодида калия KI и добавить к нему бром Br2. У брома желание больше, поэтому он выгонит йод из соединения с калием и образует бромид калия. При этом выделится элементарный йод I2, имеющий коричневый цвет.
2KI + Cl2 → 2KCl + I2
Отметим, что при нормальных условиях (25оС и 101,3 кПа) йод твердый. Аптечный же йод является более сложным соединением состава K[I(I2)]. О химии таких соединений читатель может узнать уже в вузе.
Если же атомам галогенов неоткуда взять электроны, то они соединяются с такими же атомами галогенов, которые есть поблизости. Поэтому все молекулы галогенов двухатомные: F2, Cl2, Br2, I2. Индекс 2 справа внизу от символа элемента говорит о том, что в данной молекуле 2 атома этого элемента. Но если они на своем пути повстречают какое-то вещество, которое им по зубам, то они его профторируют, прохлорируют, пробромируют или пройодируют.
Фтор. Зло воплоти
Фтор – самый активный, самый реакционноспособный, самый элеткроотрицательный, самый агрессивный, самый злой в химическом понимании. Если вы имеете дело со фтором, то будьте крайне аккуратны. Он вступает в химические реакции практически со всем, что встречает на своем пути. Ведь ему так нужен этот единственный электрон, чтобы полностью завершить свою внешнюю электронную оболочку. В его поведении все подчинено именно этой цели. Он настолько «злой» и жадный, что даже способен вступать в реакцию с инертными газами, лишь бы заполучить этот несчастный восьмой электрон.
Ионы (F-) и атомы фтора очень малы, поэтому, образовав связь с каким-либо другим атомом, оторвать его крайне тяжело. К тому же, здесь еще начинает играть роль геометрия молекул. Да-да, молекулы имеют определенные геометрические формы, достаточно точные углы, определенные длины связей. Например, молибден образует соединение со фтором, присоединяя целых шесть атомов фтора (MoF6). Если взять другой галоген больших размеров, например, йод, то он образует с тем же самым молибденом молекулу, содержащую только три атома йода (MoI3).
Как мы уже сказали, фтор самый элеткроотрицательный элемент. То есть он способен притягивать электроны сильнее всех остальных. В потоке фтора горит даже вода, с выделением кислорода. Теперь вы понимаете, что фтор выгоняет из молекулы воды сам кислород. Обычно под горением понимают взаимодействие какого-то вещества с кислородом. Здесь же горение идет не из-за кислорода, а из-за фтора. Также в струе фтора горят такие не горючие вещества, как асбест, кирпич, различные металлы. Кремний и древесный уголь вовсе самовоспламеняются в потоке фтора. Явно напрашивается вопрос: а как же тушить такое возгорание? Ответ банален: либо прекратить доступ фтора, либо дождаться, когда весь фтор прореагирует и все сгорит. Фтор с греческого переводится, как «разрушающий». И это имя ему более чем подходит. К тому же, стоит отметить, что фтор очень токсичен, что делает его очень опасным и требует осторожности при работе с ним.
В начале XVIII века была открыта плавиковая кислота (HF). Из нее впервые был получен газообразный фтор Карлом Вильгельмом Шееле. Так как фтор очень токсичен, о чем не знали ученые тех времен, то и пострадали они от него не мало. Английские химики братья Томас и Георг Нокс пытались получить фтор. В итоге первый погиб, а второй стал инвалидом. Аналогично закончили свою жизнь Д. Никлес и П. Лайет. Гемфри Дэви, ученый, впервые получивший натрий, калий, магний, кальций, стронций, барий в результате попыток получить фтор сильно отравился и тяжело заболел. Ж. Гей-Люссак и Л. Тенар тоже пытались получить фтор, но только потеряли свое здоровье при этих попытках. Также пытались получить фтор А. Лавуазье, М. Фарадей и Э. Ферми. Получить не получили, но зато остались живы и здоровы. Как видите, в списке «неудачников» значатся такие великие фамилии, которые заложили основы современных наук. Но фтор им не давался и стремился убить своих первооткрывателей. Прямо серийный киллер великих ученых.
Работа со фтором очень опасна. Малейшая оплошность, и у человека разрушаются зубы, ногти, становятся хрупкими кости, кровеносные сосуды в свою очередь становятся ломкими.
Только 26 июня 1886 года французский химик Анри Муассан при помощи электролиза безводного фтористого водорода при температуре – 23°С смог получить газообразный фтор. Электролизер был сделан из платины, а электроды из сплава иридия и платины. Но и это не спасало от образующегося фтора. Он постепенно разъедал электролизер. Стоит отметить, что и в настоящее время электролиз является единственным способом получения фтора. Только промышленные установки делают из меди, никеля, стали и графита – более дешевых материалов.
Фтор, а точнее его многочисленные соединения имеют очень широкое применение. Самое банальное, которое вы можете встретить – тефлон. Им покрывают сковородки, делая их антипригарными.
С помощью фтора делают фторопласт, который применяется в химической промышленности. Например, в чем-то надо хранить концентрированные кислоты. Просто стальные емкости не подойдут – их разъест. Поэтому в них делают вкладыши из фторопласта и только потом заливают кислоты. Со фторопластом они не реагируют. Такой метод защиты емкостей называется футеровкой. И в таких емкостях можно безопасно хранить ту же самую плавиковую кислоту. А она в свою очередь применяется в стекольной, нефтяной, пищевой, атомной, металлургической, химической, бумажной и других отраслях промышленности.
В тонне воды содержится около 0,2 мг фтора в виде его соединений. Даже в состав зубной эмали входит 0,02 % фтора. Без него зубы быстро бы сгнивали от кариеса. В медицине применяется множество лекарственных средств с содержанием фтора, от разных заболеваний от малярии и диабета, до глаукомы и рака. Естественно, здесь важно понимать, что большие дозы фтора – яд, малые дозы – лекарство. Этот принцип распространяется не только на фтор, но и на большое количество веществ, используемых в медицине.

В старых холодильниках в качестве хладагента применялся фреон. А это фторорганическая жидкость. Также соединения фтора с другими галогенами использовали в качестве окислителя для жидкого ракетного топлива.
Дата добавления: 2018-09-20; просмотров: 309; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
