Биохимические циклы кислорода
Кислород - самый распространенный элемент земной коры: его кларк равен 47 [9, с. 196]. Основная масса кислорода на периферии Земли находится в кристаллическом силикатном веществе земной коры. Еще выше концентрация кислорода в мировом океане – 85,7 %, а в живом веществе – 70 %. Для биосферы исключительно важное значение имеет свободный молекулярный кислород, аккумулированный в атмосфере и растворенный в гидросфере. Будучи продуктом процессов жизни, кислород в то же время служит одним из основных условий существования ее главных форм и определяет самые важные реакции в биосфере.
Образование свободного кислорода связано со световой энергией Солнца и поэтому может осуществляться только на поверхности Земли либо абиогенно, путем фотолиза паров воды, либо путем биологического фотосинтеза. Исходным «сырьем» для образования кислорода посредством реакций фотолиза и фотосинтеза служит вода. Связывание 1 г углерода в органическое вещество при реакции фотосинтеза сопровождается выделением 2,7 г кислорода в результате расщепления молекулы воды.
Эволюция процессов на Земном шаре сопровождается увеличением содержания кислорода. Наличие органического вещества установлено в древних осадочных отложениях, возраст которых исчисляется в 3,8 млрд. лет. Следовательно, выделение кислорода в процессе фотосинтеза продолжается миллиарды лет. В настоящее время количество кислорода в атмосфере равно 1,185∙1015 т. При годовом выделении кислорода (280-300)×109 т указанное количество может быть удвоено примерно за 4000 лет. Но этого не происходит, так как на протяжении года разными путями разлагается такое количество органического вещества, которое почти равно образованному при фотосинтезе, и при этом поглощается почти весь выделившийся кислород. Тем не менее, благодаря сохранению части органического вещества, свободный кислород постепенно накапливается в атмосфере.
|
|
|
Второй миграционный цикл свободного кислорода связан с массообменном в системе тропосферы – природные воды. В 1 л воды растворено от 2 до 8 см3 О2. Следовательно, в воде океана находится от 3×109 до 10×109 м3 растворенного кислорода. Холодная вода высоких широт поглощает кислород; поступая с океаническими течениями в тропический пояс, она выделяет О2. Поглощение и выделение кислорода происходят также при смене теплых и холодных сезонов года. По подсчетам А. П. Виноградова (1967), в годовой массобмен между атмосферой и океаном вовлекается около 0,5 % атмосферного кислорода, т. е. 5900×109 т. Это почти в 20 раз больше биогенного продуцирования кислорода.
В биохимическом круговороте можно выделить потоки кислорода, четко выраженные между отдельными компонентами биосферы (рис. 33).
|
|
|
Кислород расходуется в громадном количестве окислительных реакций, большинство из которых имеют биохимическую природу. В этих реакциях высвобождается энергия, поглощенная в ходе фотосинтеза. В почвах, илах, водоносных горизонтах развиваются микроорганизмы, использующие кислород для окисления органических соединений. Запасы кислорода на планете огромны. Он входит в состав кристаллических решеток минералов и высвобождается из них живым веществом.
Таким образом, общая схема круговорота кислорода в биосфере складывается из двух основных ветвей:
- образование свободного кислорода при фотосинтезе;
- поглощение кислорода в окислительных реакциях.
Согласно расчетам Дж. Уолкера (1980), основные составляющие глобального годового цикла кислорода следующие:
- выделение растительностью мировой суши - 150×1015 т;
- выделение фотосинтезирующими организмами океана – 120∙1015 т ;
- поглощение процессами аэробного дыхания – 210∙1015 т;
- биологическая нитрификация и др. процессы - 70×1015 т.
Сейчас свободный кислород образуется со скоростью 1,55×109 т/год, а расходуется его 2,16×1010 т/год, т. е. больше чем на порядок по сравнению с его приходом. Это обстоятельство свидетельствует о нарушении экологического компонента в биосфере в результате антропогенного воздействия.
|
|
|

Рис. 33. Круговорот кислорода в природе
Выделите негативные стороны цивилизации в изменении содержания свободного кислорода…
[1] химические соединения, сброшенные предприятиями в природные воды, связывают растворенный в воде кислород, нарушая природные потоки этого элемента;
[2] загрязнение почв, вырубка лесов, опустынивание земель уменьшают обмен кислородом и углекислым газом между атмосферой и сушей; огромное количество О2 расходуется при сжигании топлива;
[3] в наше время фотосинтез и дыхание в природных условиях с большой точностью уравновешивают друг друга; в связи с этим накопление кислорода в атмосфере не происходит, а его содержание (20,946 %) остается постоянным (без учета деятельности человека);
[4] ситуация расценивается как проблемная, которая без вмешательства в антропогенные явления может перерасти в экологически конфликтную ситуацию, как общественно неоправданную или опасную ситуацию, вызванную ухудшением среды жизни человека.
|
|
|
Биохимический цикл водорода
Содержание водорода в земной коре невелико [1, с. 211]: кларк гранитоидов составляет 0,15 %. В земной коре большая часть атомов водорода входит в состав воды, углей, нефти, горючих газов, глинистых минералов, живых организмов. Геохимия водорода тесно связана с историей воды и живого вещества: кларк водорода гидросферы равен 10,72, а живого вещества – 10,5.
Водород – один из двух химических элементов, которые благодаря ничтожной массе их ядер могут диссипировать: уходить из поля тяготения Земли. Транзит водорода и гелия проходит через биосферу. Гелий, как инертный газ, не образует химических соединений, а водород под влиянием жизнедеятельности организмов вступает в соединения и вследствие этого задерживается в биосфере.
Водород в свободной (молекулярной) форме и в составе химических соединений дегазируется из мантии. Значительные массы Н2 поступают на поверхность Земли при вулканических извержениях и поствулканических процессах, выделяются в результате жизнедеятельности водородных бактерий, участвующих в преобразовании органического вещества в анаэробных условиях, образуются при разложении воды при электрохимических реакциях и под воздействием продуктов распада радиоактивных элементов. В то же время в атмосфере находится Н2 всего 0,18×109т благодаря его диссипации. Скорость диссипации водорода 25×103 т/год. За время существования Земли общая потеря элемента составила 0,1×1015 т (Г. А. Заварзин, 1984).
Накопление кислорода в атмосфере связано с удалением из нее водорода. На ранних стадиях истории Земли ведущую роль в удалении водорода, образовавшегося при фотолизе паров воды, играл процесс диссипации. В дальнейшем все большее значение стало приобретать удаление водорода путем связывания его в составе органического вещества. Для создания массы растительности Мировой суши, существовавшей до вмешательства человека, было расщеплено примерно 1,8×1012 т воды и соответственно связано 0,3×1012 т водорода. В настоящее время в процессе фотосинтеза природной растительностью на суше и фотосинтетиками в океане на протяжении года расщепляется около 200×109 т воды и в органическом веществе связывается примерно (30-35)×109 т водорода.
Концентрирование водорода в организме человека – около 10 % (7 кг) по сравнению с его содержанием в земной коре (1 %) – свидетельствует об исключительной роли водорода в биологических процессах. На 100 атомов водорода в организме человека приходится всего 58 атомов остальных элементов. В организме человека водород содержится в виде различных биоорганических соединений и воды. Вода – одно из самых важных и распространенных на Земле соединений водорода. Водное пространство занимает почти 75 % поверхности земного шара.
В организме взрослого человека в среднем содержится 65-67 % воды, у эмбрионов (4-месячных) – 94, у новорожденных – 74 %. Все химические реакции в организме протекают только в водной среде. Жизнь без воды невозможна.
Организмы закрепляют водород в биосфере планеты, связывая его не только в органическом веществе, но и участвуя в фиксации водорода минеральным веществом почвы. Это становится возможным в результате диссоциации кислотных продуктов метаболизма с высвобождением иона Н+. Последний, как правило, с молекулой воды образует посредством водородных связей ион гидроксония (Н3О+). При поглощении иона гидроксония гипогенными силикатами происходит трансформация их кристаллохимических структур в глинистые минералы. Таким образом, интенсивность продуцирования кислотных продуктов метаболизма является важным фактором гипергенного преобразования кристаллических горных пород и образования коры выветривания.
Изменение концентрации водородных ионов влияет на подвижность многих металлов. Большинство их, растворяясь в кислых растворах, образуют катионы, но с повышением рН они обычно выпадают в осадок в форме гидроксидов или основных солей. С подобным явлением сталкиваются при миграции растворов от сульфидных рудных тел. Щелочностью среды во многом определяется миграция глинозема и кремнезема: при рН = 5-9 первый практически нерастворим, а второй становится подвижным. С изменением кислой среды на щелочную многие окислительно-восстановительные реакции меняют свое направление:
Fe3+ + V4+ ® Fe2+ + V5+ ; 2 Fe2+ + U6+ ® 2 Fe3+ + U4+.
Известны три изотопа водорода: протий 11Н, дейтерий 21Н (или Д), тритий 13Н (или Т). Протий и дейтерий – стабильные изотопы; тритий – радиоактивен (период полураспада 12,5 лет). Кислород состоит из трех стабильных изотопов со следующей распространенностью:  О – 99,759 %;
О – 99,759 %; 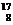 О – 0,0374 %;
О – 0,0374 %;  О – 0,203 %. Многократно повторяющиеся циклические процессы миграции химических элементов способствуют дифференциации изотопов. Один из наиболее мощных циклических процессов, существующих на поверхности Земли с момента образования атмосферы и океана, – круговорот воды.
О – 0,203 %. Многократно повторяющиеся циклические процессы миграции химических элементов способствуют дифференциации изотопов. Один из наиболее мощных циклических процессов, существующих на поверхности Земли с момента образования атмосферы и океана, – круговорот воды.
Именно цикл массообмена воды наиболее заметно сказывается на разделении изотопов водорода и кислорода. Как это проявляется…?
[1] пары воды при испарении обогащаются легкими изотопами, поэтому атмосферные осадки, поверхностные и грунтовые воды содержат больше легких изотопов;
[2] пары воды при испарении обогащаются тяжелыми изотопами, поэтому атмосферные осадки, поверхностные и грунтовые воды содержат больше тяжелых изотопов;
[3] океанические воды характеризуются устойчивым изотопным составом; материковые льды Арктики и Антарктиды содержат наиболее легкую воду, так как активность разделения изотопов кислорода усиливается при понижении температуры;
[4] океанические воды характеризуются переменным изотопным составом, материковые льды Арктики и Антарктиды содержат наиболее тяжелую воду, так как активность разделения изотопов кислорода понижается при низкой температуре.
Биохимический цикл серы
Сера является одним из элементов [1, с. 221], играющих важную роль в круговороте веществ биосферы. Она определяет важные биохимические процессы живой клетки, являясь компонентом питания растений и микрофлоры.
Сера является компонентом белков и входит в состав ряда аминокислот: цистина, цистеина, метонина. Образование гомоцепей из атомов серы характерно и для ее соединений, выполняющих существенную биологическую роль в процессах жизнедеятельности. Так, в молекулах аминокислоты – цистина - имеется дисульфидный мостик – S – S - :
COOH COOH
½ ½
H2N – C - Н H2N – C - H
½ ½
CH2 - S – S – CH2
Эта аминокислота играет важную роль в формировании белков и пептидов.
Благодаря дисульфидной связи полипептидные цепи оказываются скрепленными между собой. Характерно для серы и образование водородосульфидной (сульфидгидрильной) тиоловой группы – SH, которая присутствует в аминокислоте цистеине, белках, ферментах. Аминокислоты синтезируются растениями, использующими минеральную серу. В организм животных сера попадает с пищей. При окислении тиоловых групп образуются дисульфидные связи и, наоборот, при восстановлении связей (S – S –) образуются SH-группы, т. е. эти переходы обратимы:
Н
R1 – S – S – R2 « R1SH + R2SH
О
В некоторой степени этот обратимый переход защищает организм от радиационных поражений.
Под влиянием ионизирующего облучения в результате радиолиза воды в организме образуются свободные радикалы, в том числе весьма активные Н● и ОН●, инициирующие процессы окисления. Водородосульфидные группы вступают в реакцию со свободными радикалами:
RSH + OH●× ® RS●× + H2O.
Радикалы RS● малоактивны. Тем самым предотвращается воздействие активных радикалов на нуклеиновые кислоты и другие биомолекулы.
Соединения серы участвуют в формировании химического состава почв, в значительных количествах находятся в подземных водах, а это, в свою очередь, играет решающую роль в процессах засоления почв. Основную роль в обменном фонде серы играют специализированные микроорганизмы. Каждый вид микроорганизмов выполняет определенную реакцию окисления или восстановления этого элемента.
Так, фототрофные серные бактерии окисляют сероводород с образованием в качестве метаболита сульфата: Н2S + CO2 ® CH2O +SO42- .
Сульфатредуцирующие микроорганизмы, разрушающие органические соединения в почве, восстанавливают серу в Н2S или в минеральную серу. Сульфат- окисляющие микроорганизмы окисляют серу, превращая ее в сульфаты. Последние поглощаются растениями и вновь попадают в круговорот.
Сера, находящаяся в глубоководных отложениях в составе различных химических соединений, подвергается воздействию микроорганизмов (сульфатредуцирующих бактерий), в результате чего происходит ее регенерация. При этом создается вертикальный поток серы в виде Н2S.
Одно из наиболее интересных открытий – установление фракционирования изотопов живыми организмами. В природе известны четыре стабильных изотопа серы. Самый легкий из них 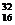 S имеет распространенность 95,1 %. Распространенность других следующая:
S имеет распространенность 95,1 %. Распространенность других следующая:  S – 0,74 %;
S – 0,74 %;  S – 4,2 %;
S – 4,2 %;  S – 0,016 %. Практический интерес представляет соотношение двух изотопов
S – 0,016 %. Практический интерес представляет соотношение двух изотопов 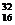 S и
S и  S. Установлено, что биогенные соединения серы – твердые и газообразные - обогащены легким изотопом. Наибольший эффект характерен для реакции биохимического восстановления сульфата до сероводорода, производимого бактериями. При этом в Н2S увеличивается содержание легкого изотопа
S. Установлено, что биогенные соединения серы – твердые и газообразные - обогащены легким изотопом. Наибольший эффект характерен для реакции биохимического восстановления сульфата до сероводорода, производимого бактериями. При этом в Н2S увеличивается содержание легкого изотопа 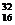 S, а не охваченные биохимическими процессами ионы SO4- остаточно обогащаются изотопами
S, а не охваченные биохимическими процессами ионы SO4- остаточно обогащаются изотопами  S.
S.
В результате биогеохимических и биологических процессов происходит изменение в соотношении изотопов в сторону увеличения легкого изотопа в верхних гумусовых горизонтах почв. Это свидетельствует в пользу того, что интенсивный биологический круговорот серы в почвах охватывает только ее верхние слои. Однако почвенно-грунтовые и подземные воды также принимают участие в биохимическом цикле серы. На это указывает сходство изотопного состава серы подземных, почвенно-грунтовых вод и воднорастворимых сульфатов из горизонта С сульфатно-содовых солончаков и свидетельствует об участии серы подземных вод в формировании сульфатно-содового засоления. Таким образом, в засоленных почвах биогеохимический круговорот серы не ограничивается верхними гумусовыми горизонтами, а охватывает значительную толщу: 5-10 м и более.
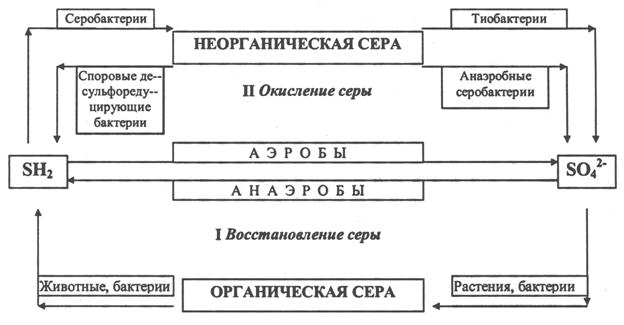
Рис. 34. Биохимический цикл серы (по Ф.Я. Шипунову, 1980): I - минерализация органической серы живыми организмами до H2S; II - дисульфофикация
Биохимический цикл серы состоит из четырех стадий (рис 34).
I. Усвоение минеральных соединений серы живыми организмами (растениями и бактериями) и включение серы в состав белков и аминокислот.
II. Превращение серы живыми организмами (животными и бактериями) в конечный продукт – H2S.
III. Окисление минеральной серы живыми организмами (серобактериями, тионовыми бактериями) в процессе сульфатредукции. На этой стадии происходит окисление сероводорода, элементарной серы, ее тио- и тетрасоединений.
IV. Восстановление минеральной серы живыми организмами (бактериями) в процессе дисульфофикации до H2S. Таким образом, важнейшим звеном всего биохимического цикла серы в биосфере является биогенное образование сероводорода.
Приходные статьи баланса серы в общем круговороте следующие(Шипунов, 1980), т/год:
- дегазация зеленой коры - 12×106
- выветривание осадочных пород (пирит, гипс и другие.) - 42×106
- антропогенное поступление серы в виде SO2 - 65∙106
Итого: 119∙106
Уход серы за пределы биосферы в остаточные отложения в виде сульфидов и сульфатов – 100∙106 т/год. Видно, что антропогенное поступление серы в биосферу существенно изменяет круговорот этого элемента, в биосфере в целом наблюдается приход нециклической серы.
Укажите пути поступления нециклической серы…
[1] способность серы под влиянием микробиологических процессов образовывать газообразные соединения (SO2, H2S) и благодаря этому активно участвовать в массообмене между сушей и океаном, с одной стороны, и атмосферой - с другой;
[2] образующийся при разрушении сульфатов Н2S переводит растворимые в воде железо и другие металлы в форму труднорастворимых сульфидов, которые уходят в осадки морей и надолго связывают массы серы;
[3] трансформацией сернистых газов в хорошо растворимые сульфаты и заменой газовой миграции серы на водную;
[4] одним из наиболее крупных и трудноподдающихся очистке загрязнителей атмосферного воздуха, выбрасываемых главным образом энергетическими установками, является SO2 и в меньших количествах SO3. Техногенные выбросы серы в год достигают (75-100)∙106 т (снижение прозрачности атмосферы, гибель хвойных лесов и плодовых растений, нарушение процессов фотосинтеза и дыхания).
Биохимический цикл фосфора
Несмотря на невысокий кларк в земной коре (около 1 %), фосфор играет очень важную роль в биосфере [12, с. 426]. Основные запасы его находятся в горных породах земной коры, в донных отложениях морей и океанов, в гумусовом горизонте наземных и подводных почв. Главное геохимическое направление мирового круговорота соединений фосфора направлено в сторону озер, устьев рек, морей и шельфа океана.
Распределение масс фосфора (в тоннах) в биосфере следующее:
Резервуары 1×109
Мировая суша
природная растительность суши
(до вмешательства человека) 5,0
органическое вещество педосферы 4,7
Океан
Биомасса фотосинтетиков 0,04
Растворенное неорганическое вещество 15,0
Земная кора
Осадочная оболочка 311 000
Гранитный слой континентального блока 6 330 000
По содержанию в организме человека (0,95 %) фосфор относится к макроэлементам. Фосфор – элемент-органоген (основу живых систем составляют только шесть элементов: С, Н, О, N, P, S, получивших название органогенов; эти элементы составляют в организме 97,4 %) и играет исключительно важную роль в обмене веществ. В форме фосфата фосфор представляет собой необходимый компонент внутриклеточной АТФ. Он входит в состав белков (0,5 - 0,6 %), нуклеиновых кислот, нуклеотидов и других биологически активных соединений. Фосфор является основой скелета животных и человека (кальций ортофосфат, гидроксил- апатит), зубов (гидроксилапатит, фтороапатит).
Многие реакции биосинтеза осуществляются благодаря переносу фосфатных групп от высокоэнергетического акцептора к низкоэнергетическому. Фосфатная буферная система является одной из основных буферных систем крови
(H2PO4- « H+ + HPO42-).
Живые организмы не могут обходиться без фосфора. Значение фосфора состоит и в том, что сахара и жирные кислоты не могут быть использованы клетками в качестве источников энергии без предварительного фосфорилирования.
Круговорот фосфора в биосфере связан с процессами обмена веществ в растениях и животных (рис. 35).

Рис. 35. Глобальный цикл фосфора в биосфере (по ДиVigneaud, 1974)
Резервуаром фосфора является минеральная часть литосферы. Основными источниками неорганического фосфора являются изверженные породы (апатиты) или осадочные породы (фосфориты). Из пород неорганический фосфор вовлекается в циркуляцию выщелачиванием и растворением в континентальных водах. Попадая в экосистемы суши, почву, фосфор поглощается растениями из водного раствора в виде неорганического фосфат-иона (PO43-) и включается в состав различных органических соединений, где он выступает в форме органического фосфата. По пищевым цепям фосфор переходит от растений к другим организмам экосистемы. Химически связанный фосфор попадает с остатками растений и животных в почву, где вновь подвергается воздействию микроорганизмов и превращается в минеральные ортофосфаты, а в дальнейшем происходит повторение цикла.
В водные экосистемы фосфор переносится текучими водами. Реки непрерывно обогащают фосфатами океаны. В соленых морских водах фосфор переходит в состав фитопланктона, в последующем накапливаясь в тканях морских животных, например рыб. Отмершие остатки организмов приводят к накоплению фосфора на разных глубинах. Отсюда следует, что фосфор, попадая в водоемы, насыщает, а нередко и перенасыщает их экосистемы. Частичный возврат фосфатов на сушу связан с поднятием земной коры выше уровня моря. Определенное количество фосфора переносится на сушу морскими птицами, а также благодаря рыболов- ству.
В почвах и породах широко распространено явление фиксации фосфора. Фиксаторами фосфора являются гидроксиды железа, марганца, аммония, глинистые минералы (особенно группы каолинита). Повышенная кислотность среды, образование Н2СО3 способствуют десорбции фосфора и усилению миграции фосфорных соединений. В восстановительной среде образуются соединения фосфора с двухвалентным железом и это тоже способствует выносу фосфора из почвы. Миграция фосфора возможна и за счет таких явлений, как водная и ветровая эрозия.
Соединения фосфора, как и азота, являются важнейшими минеральными удобрениями почв в современном земледелии. Дефицит фосфора для растений объясняется низкой физиологической доступностью его нерастворимых соединений и особенно необратимой фиксацией в почве самого фосфора.
Укажите характерные особенности глобального цикла фосфора…
[1] фосфор в отличие от других биофильных элементов в процессе миграции не образует газовой формы;
[2] присутствие постоянно действующего геохимического потока, возвращающего крупные массы элемента на сушу;
[3] глобальный цикл фосфора является наименее замкнутым по сравнению с углеродом, серой, азотом, водородом, кислородом;
[4] «фосфор – наиболее слабое звено в жизненной цепи, которая обеспечивает существование человека» (П. Дювиньо).
Дата добавления: 2018-08-06; просмотров: 1292; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
