Модификация гистоновых белков.
Вводное начало по дисциплине «Основы молекулярной биологии» для школьников 10-11 классов.
Примечание.
Дорогой читатель, прежде чем начать читать мою книгу, надеюсь ты решишься прочитать оглавление и задашься вопросом, почему я решил написать эту книгу. При поступлении в медицинский ВУЗ в мои школьные годы биология была в числе моих любимых предметов, которая была близка к моей душе. Стала она таковой после того, как я узнал, что для того, чтобы стать врачом необходимо знание биологии. В школе им. М.В.Ломоносова многие 11-классники хотели поступить на эту специальность, однако были и те, кто рассматривал этот предмет в качестве «крайнего» самого легкого, по их мнению варианта. Даже помнится подошел ко мне один парень и спросил, что я выбираю, и , когда я ответил на его вопрос, он заявил: «У тебя же хорошо работает голова, Ермек! Зачем ты выбрал биологию?». Видимо, его не волновал факт того, что я хочу пойти на врача. Однако прошу вас так не думать, потому что именно такие люди обычно уходят с 1 курса, не вынося тяжестей учёбы. Мне тоже пришлось столкнутся с неприятными трудностями при изучении «Основ молекулярной биологии», когда порой читал и не понимал, что читаю. Итак, мой мотив: дорогой читатель, собирающийся поступить в МедВУЗ не допустить этого с тобой. Я постарался максимально понятно изъяснить материал, который ты,я надеюсь,будешь читать. Ещё все-таки желательно читать её, если вы владеете базовыми знаниями по биологии 9 класса. Молекулярная биология - молодая и очень интересная наука, жизнь повсюду кипит на нашей планете, а мы в ней всего лишь песчинка, набор «удачной» комбинации атомов, но как… За этой наукой кроется будущее, так как зная, молекулярные механизмы жизненных процессов, можно будет уметь контролировать и уметь направлять их в нужное русло, можно будет лечит многие неизлечимые на данный момент наследственные болезни. И пусть эта мысль движет тобою при чтенни этой книги. Может в будущем ты и станешь, тем человеком, который найдет лекарство от рака. Главное верить в себя, ведь как говорил А.П.Чехов: «Чем выше цель стремлений, тем быстрее и социально продуктивней развивается человек». Конечно, моя книга не сравнится с теми, что вы прочитаете, но моя задача- заложить основу, которая пока хранится в моей памяти.
Убедительная просьба: смотрите картинки для более легкого усвоения материала ради себя!
Абилдахан Е.А.
Темы:
1. Наследственный материал клетки. Хромосомы и уровни её организации.
2. Понятие о гене. Строение гена эукариот и прокариот, их сравнительная характеристика.
3. Репликация (удвоение молекулы ДНК). Значение теломер (концевые участки хромосом)
4. Транскрипция(синтез и созревание иРНК)
5. Генетический код. Трансляция (биосинтез белка).
6. Наследственная изменчивость. Мутагенез и мутагенные факторы. Мутации. Генные мутации.
7. Репарация ДНК.
8. Клеточный цикл. Митоз. Регуляция клеточного цикла.
9. Апоптоз – запрограммированная гибель клетки. Механизмы апоптоза.
10. Онкогенетика.Молекулярные механизмы канцерогенеза.
11. Фармакогенетика.
12. Эпигенетика.
1.Наследственный материал клетки. Хромосомы и уровни её организации.
Наследственный материал клетки- это, то благодаря чему мы отличаемся друг от друга, то что дается нам от родителей, а им отих и так далее. Огромный и наверняка претерпевший сильные изменения за большой промежуток времени он передался вам. Наследственный материал содержится в наших ДНК, заглядывая наперед скажу, что ДНК безусловно важная структура, но без белоксинтезирующего аппарата(информационная РНК, рибосомы, транспортная РНК) он бы не значил для нас ничего, так как ваше телосложение похожее скажем на отца, а голубой цвет глаз матери – это белки- результат экспрессии (проявляемости) гена. Ген- это участок молекулы ДНК, которая содержит информацию о структуре, кодируемого белка, который в организме будет служить либо ферментом( например, гидролитические ферменты лизосомы), либо регулятором какого- то процесса жизненного процесса (регулятор митоза, репликации и.т.д), либо будет частью клетки(структурный белок, например, белок плазматической мембраны). ДНК в свою очередь расположено в хромосомах и занимают примерно 50-55% её объема, остальное приходится на структурные гистоновые(щелочные) и негистоновые (кислые) белки, которые укорачивают цепь ДНК. Наверняка задается вопрос: «Зачем это нужно? Какой смысл?» . Если бы не было подобной упаковки, то ДНК попросту не поместилась в клетке, ведь её истинная длина около 2 м. , вследствие чего выделяют 6 уровней организаций:
1) Нуклеосомный уровень- это, когда 8 гистоновых белков(Н2А, Н2В, Н3, Н4 по две штуки каждая) образуют шар, по- научному белковый кор. И вокруг этого кора наматывается ДНК ,делая вокруг неё 1,75 оборота , благодаря чему он укорачивается в 2-4 раза.
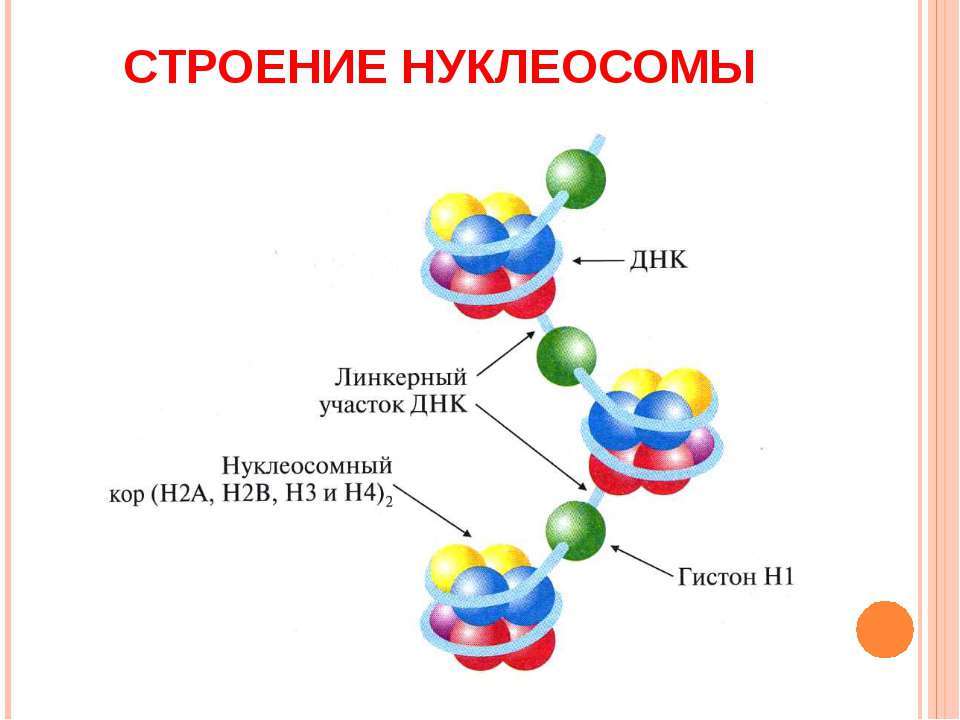
2) Нуклеомерный уровень организации. На картинке вы видите линкерныеучаастки (участки между корами). В данном уровне организации они занимают ключевое место, так там будет находится еще один гистоновый белок Н1, который будет притягивать друг к другу эти коры и тем самым укорачивать ещё сильнее длину ДНК в 6-7 раз. Получившуюся в итоге структуру также называют хроматиновой фибриллой или соленоидным хроматином.
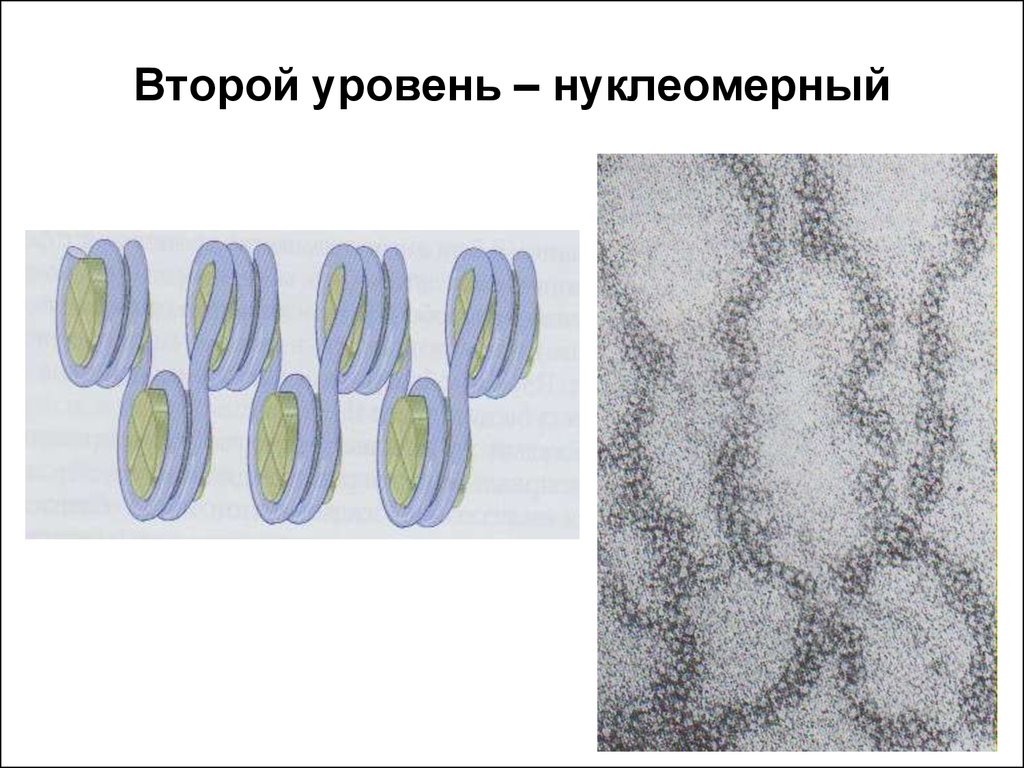
3) Следующий уровень укорочения-хромомерный уровень организации. На данном уровне укорочения уже участвуют негистоновые (кислые) белки. Укорочение на этом уровне достигается образованием петлевых структур.
4) Хромонемный уровень организации-дальнейшее укорочение ДНК достигается благодаря сближению петель и образование петлевых доменов. Этот уровень можно увидеть в интерфазе- период до деления клетки.
5) Хроматидный уровень организации-дальнейшая петлизация хромонемы и образование хроматиды.
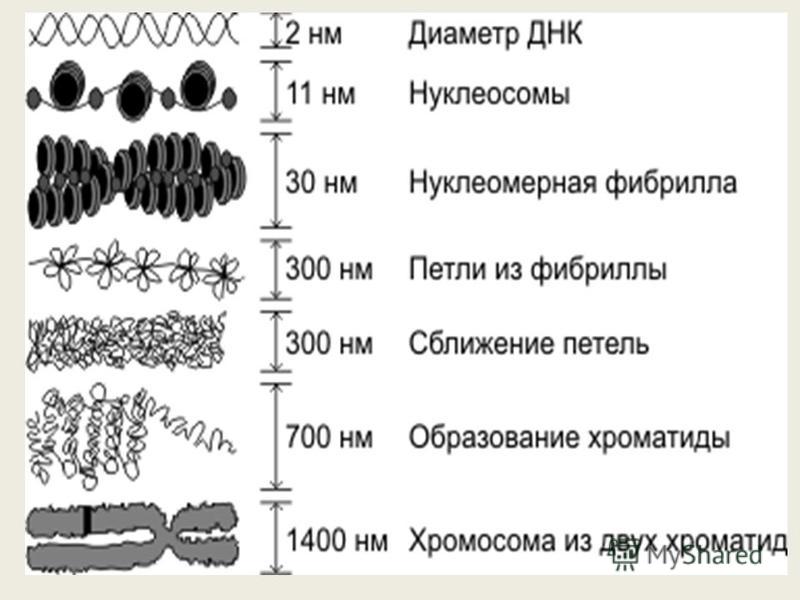
6) Хромосомный и самый высший уровень организаций. Хромосома- структура, состоящая из 2 хроматид, соединенных по середине центромерой. Концевые участки хромосомы называются теломерами. Теломеры заняты гетерохроматином– плотный хроматин, с которого не осуществляются процессы транскрипции, как и центромерные участки. Промежуток между этими двумя частями(между центромерой и теломерой) занято эухроматином- с которого осуществляются процессы транскрипции, потом трансляции и синтезируется белок, следовательно ген проявляется.
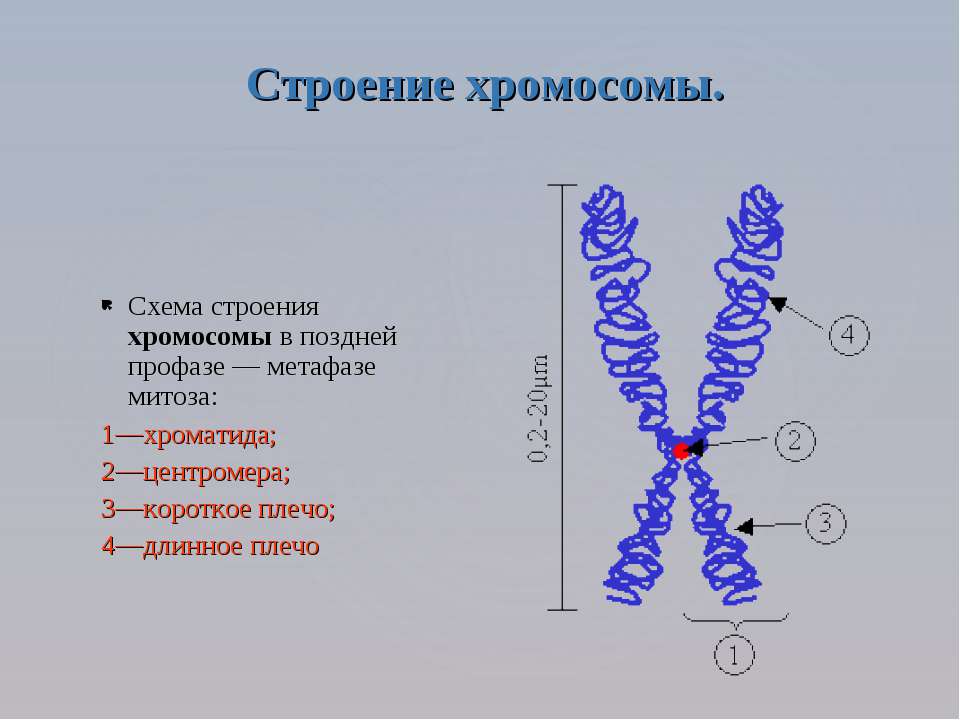
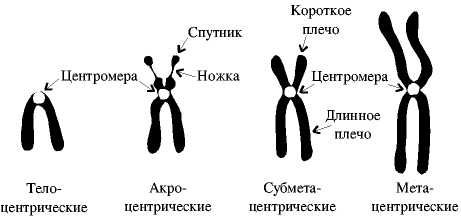
В зависимости от положения центромеры хромосомы подразделяются на:
1) Метацентрические хромосомы-центромера располагается по середине, вследствие чего плечи(смотри на картинку) равной длины.
2) Субметацентрические- плечи немного отличаются в длине. В такой хромосоме уже различают какое плечо длинное, а какое короткое.
3) Акроцентрические- плечи сильно различаются в длине.
4) Телоцентрические- всего 1 плечо, центромера на краю. Подобных хромосом в организме как правило нет. Их наличие- приводит к патологии.
Хромосомы можно изучать благодаря остановке митоза на стадии метафазы, когда они таковыми представлены(хорошо видимы) и изучить на наличие хромосомных мутации.
Понятие о гене. Строение гена эукариот и прокариот, их сравнительная характеристика.
Что мы называем геном и где они расположены? Геныв количестве примерно 30000 располагаются в ДНК, те в хромосомах, те в ядре. История формирования первичных представлении о гене берет начало с работ Менделя, которые к тому времени по его предположению носили название «наследственных факторов», отвечающих за развитие конкретного признака. Позже эти «наследственные факторы» В.Иогансеном в 1909 г. получили название гены. Работы Менделястали основой для формирования классических представлений о структуре гена и формирования постулата: «Один ген- один признак». В соответствии с представлениями классической генетики, ген- неделимая структурно- функциональная единица наследственности, отвечающая за развитие какого-то признака(цвет глаз например). Но, эти представления в дальнейшем были опровержены экспериментами Серебровского и Дубинина, Им были показаны, что при облучении, что при облучении мух рентгеновскими лучами возникали различные мутации в пределах одного гена, отвечающего за щетинки на теле мух. У одной группы при облучении наблюдался усиленный рост щетинок, у второй- укорочение, у третьей- отсутствие и четвертой- сохранились в норме. В соответствии с представлениями классической генетики Менделя ожидалось увидеть только третий вариант- отсутствие щетинок из- за мутации этого гена. Эти данные привели к пониманию сложности строения гена и формированию нового постулата (формулировка) «Один ген- одна полипептидная цепь(белок)». Ген не всегда определяет признак, порой для этого нужно несколько, а не один, белков.
Строение гена.Ген- участок молекулы ДНК, состоящий из 2 частей: регуляторного и кодирующего участков. Разделены они между собой последовательностью в 300 нуклеотид, называемой точкой начала транскрипции. По отношению к этой точке разделяют +(правее- кодирующая часть) и – (левее- регуляторная часть) последовательности. Функция регуляторной части- контролирует начало и интенсивность процесса транскрипции- образовании информационной РНК(иРНК)- матрица(как бы то, на что опираются, прототип) для синтеза белка. Кодирующая часть- матрица для синтеза иРНК. Прошу пожалуйста ради собственного блага смотреть картинки, которые я вставляю, так как это поможет вам при освоении материала.
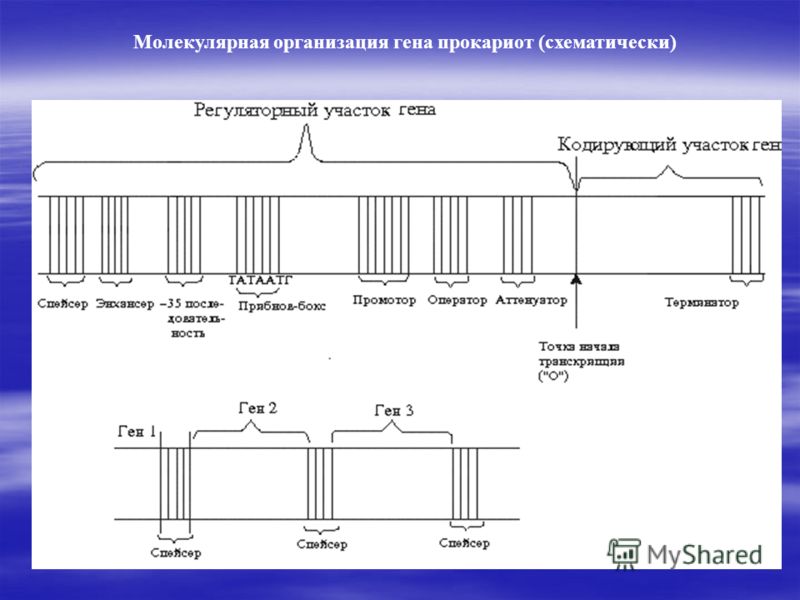
Итак, регуляторная часть у прокариот содержит следующие нуклеотидные последовательности:
1) Промотор- последовательность нуклеотидов, с которым связывается РНК- полимераза- белок, осуществляющий синтез иРНК и состоящее из 2 частей:
а) Прибнов- бокс(-10 последовательность(-10 значит, что она находится на расстоянии в 10 нуклеотидов от точки начала транскрипции )) – с ним связывается РНК- полимераза.
б) узнаваемая последовательность( -35 последовательность)- с ним связывается сигма субъединица РНК- полимеразы, которая является как бы активатором процесса транскрипции;
2) оператор- последовательность нуклеотидов, с которыми связываются регуляторные белки. Если в этом участке имеется регуляторный белок, то процесса транскрипции не происходит;
3) аттенуатор- последовательность нуклеотидов, запускающая или предотвращающая процесс транскрипции
4) энхансер- последовательность нуклеотидов, увеличивающая скорость транскрипции
5) сайленсер (на картинке его нету, но знайте, что он распологается ближе энхансера )- последовательность нуклеотидов, снижающая скорость транскрипции.
Кодирующая часть гена прокариот состоит только из экзонов- информативных кодируемых участков и терминатора- последовательность нуклеотидов(АТТ, АТЦ, АЦТ), служащая сигналом об окончании транскрипции, когда РНК- полимераза доходит до сюда, он дальше не идет.
Строение гена эукариот.Строение гена эукариот мало чем отличается отпрокариот, в ней имеются в основном все те же последовательности нуклеотидов за некоторыми исключениями. Так уэукариот нету оператора, а промотор состоит из 3 частей:
1) ТАТА- бокс(Голдберга- Хогнесса бокс, -20 последовательность)- с ней связывается РНК-полимераза;
2) ЦААТ- бокс(-60 последовательность)
3) ГЦ-бокс(- 80 последовательность)
ЦААТ и ГЦ- боксы регулируют скорость транскрипции.
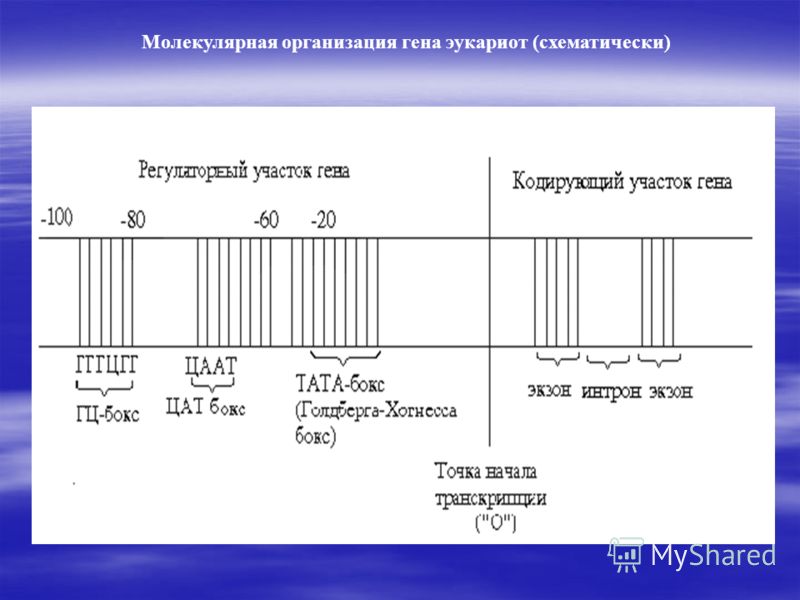
Кодирующая часть эукариот состоит еще из интронов - некодируемых последовательностей, но не спешите с выводами, так как они выполняют 2 важные функции:
1) Они снижают частоту мутации;
2) Обуславливают процесс альтернативного сплайсинга (об этом позже, не зациклывайтесь )
В человеческом организме 30000 генов, но они занимают всего 2 % хромосом, так что гены разделены между собой обширными нетранскибируемыми нуклеотидными последовательносями-спейсарами.





Теперь, когда вы знаете строение гена я бы хотел вернуться к опыту Серебровского и Дубинина (прочитайте ещё раз, если забыли). Чрезмерный рост щетинок был обусловлен мутацией в энхансере , медленный рост- мутацией в сайленсере, отсутствие – в промоторе, а когда изменений не происходило в интроне, так как эта часть не кодируется(не участвует в определений структуры кодируемого с гена белка). Если вы поняли предпоследнее предложение, значит хорошо усвоили эту тему.
Репликация (удвоение молекулы ДНК). Значение теломер (концевые участки хромосом)
Репликация- это сложный процесс самоудвоения молекулы ДНК. В неделящейся клетке наследственный материал можно выразить 2n2c(n-количество хромосом, а с- количество ДНК). В интерфазе происходит процесс репликации, следовательно наследственный материал становится 2n4c. Данный процесс протекает по определенным нерушимым правилам, или как принято говорить принципам репликации:
1) Комплементарность- это когда аденину одной цепи противопоставлен тимин другой (между ними 2 водородные связи), гуанину- цитозин(между ними 3 водородные связи);
2) Полуконсервативность- когда в результате деления одна цепь старая(материнская цепь), а вторая- новая (дочерняя цепь) ;
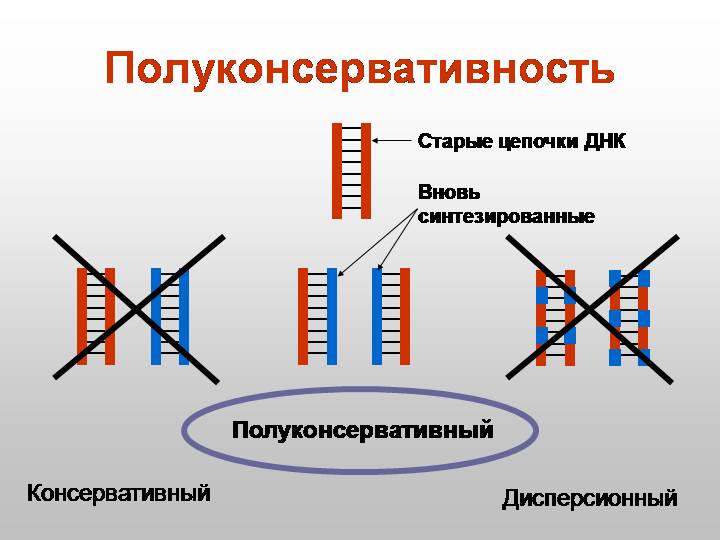
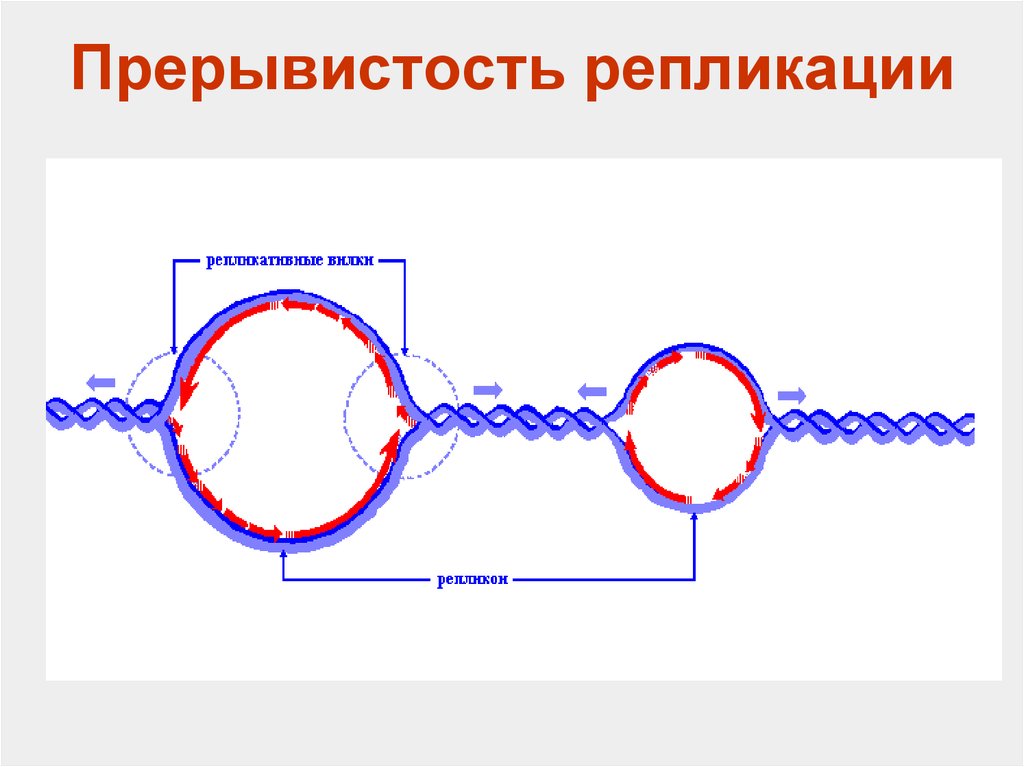
3) Прерывистость- ДНК настолько обширна, что если бы репликация начиналась на одном месте и заканчивалась в другом, то это бы заняло очень большое количество времени, вследствие чего начинается в нескольких местах.
Для вашего понимания 4 и 5 принципов прежде я должен вам напомнить строение нуклеотида- «кирпичики», из которых состоит ДНК.
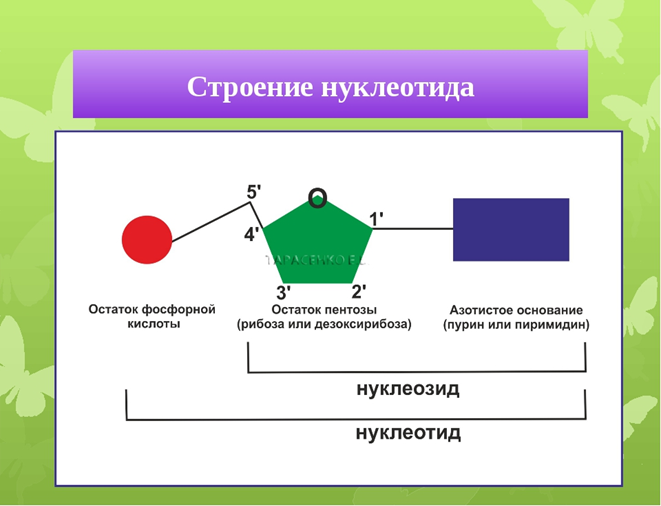
Нуклеотид состоит из азотистого основания (А,Т,Ц,Г), пятиуглеродного сахара- дезоксирибозы и остатка фосфорной кислоты. Когда изображают ДНК в схематическом виде вы увидите 5̕ и 3̕. Что они значат? Немного химии: на 3̕ имелась группа ОН, но она соединилась с другой такой же группой ОН, но не дезоксирибозы , а фосфорной кислоты, далее выделяется Н20 и образуется прочная ковалентная связь, это значит что удлинение молекулы ДНК происходит с 5̕ → 3̕ конец.
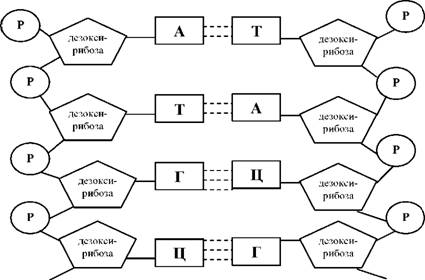
51---АТТГАТАЦАГГЦ---31
31 ---ТААЦТАТГТЦЦГ---5̕
(Схематическое изображение ДНК)
4) Итак, следующий принцип-антипараллельность- это если, одна цепь с 5̕ -3̕, то вторая будет с 3̕ - 5̕ (смотри выше)
5) Униполярность- синтез дочерних цепей осуществляется всегда с 5̕ -3̕ .
Процесс репликации идет в 3 стадии:
1) Инициаиция
2) Элонгация
3) Терминация
Теперь перейдем к самому процессу. Так как репликация идет прерывисто образующиеся в результате структуры называются репликонами, а зоны репликации- репликационными вилками. Предшествует образованию репликативной вилки образование прежде репликационного глазка в области точек начала репликации. При этом от точки начала репликации могут образоваться либо 1 репликационная вилка(у эукариот) или 2 у прокариот. Образование репликативного глазка и есть 1 этап- инициация репликации.
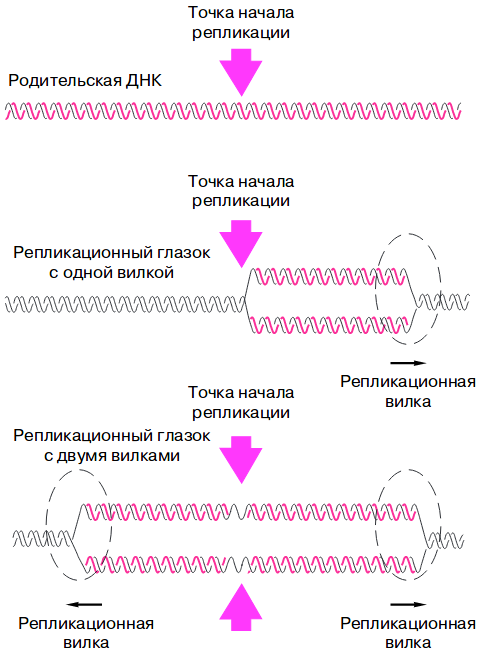
Элонгация- основной этап процесса репликации. Она осуществляется благодаря целому каскаду ферментов, без которых этот процесс невозможно было бы представить. При репликации одна дочерняя цепь синтезируется непрерывно, потому что её направление совпадает с направление хеликазы, а 2 дочерняя- кусками- фрагментами Оказаки. Синтезирующаяся непрерывно цепь называется лидирующей(2 на рисунке), а фрагментами- отстающей(1 на рисунке).
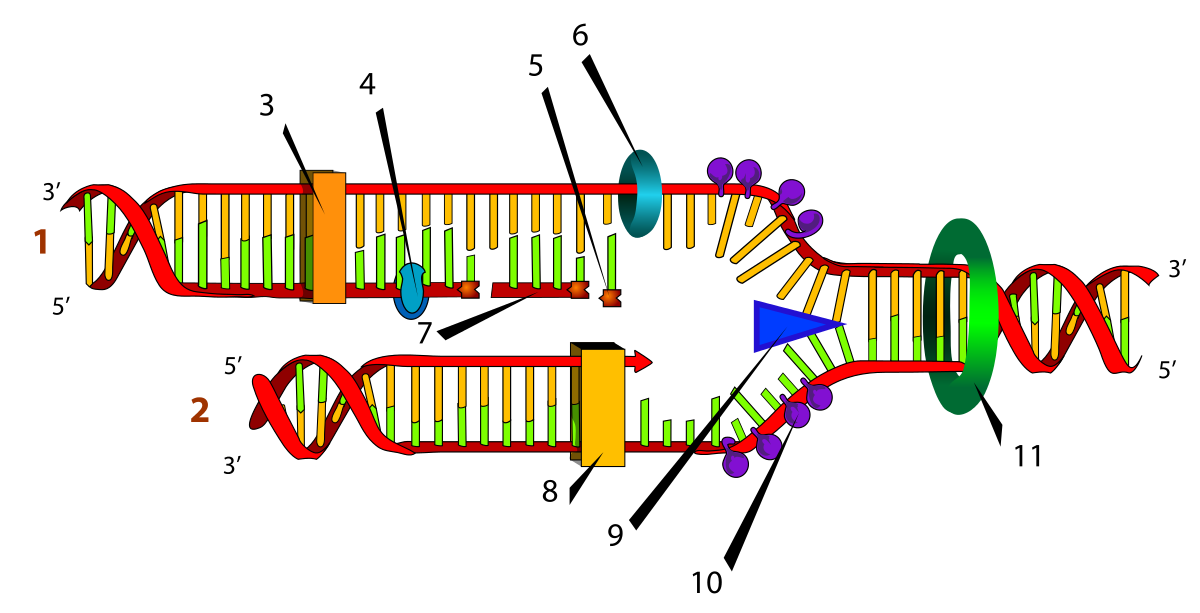
1) Хеликаза- функцией этого фермента является расплетение двух нитей ДНК, на рисунке она обозачена под цифрой 9.
2) Топоизомераза- когда хеликаза разрывает две нити, то в них накапливается напряжение и они начинают быстрее вращаться- явление суперспирализации. Топоизомераза специально предназначена ради того, чтобы её снять. На рисунке под цифрой 11.
3) ДНК-полимераза- синтезирует дочернюю цепь(на рисунке под цифрами 3 и 8)
4) ДНК-лигаза – сшивает фрагменты Оказаки.
5) РНК-праймаза- синтезирует РНК- затравки(РНК- праймеры), которые выступают в роли маяка для ДНК-полимераз, указывая им откуда начать, и только после присоединения к затравке ДНК- полимераза может начать синтез дочерней цепи. При этом для лидирующей цепи нужно всего один праймер, а дочерней- множество.(6 на рисунке)
6) SSB- белки- нужны для того, чтобы удерживать разъединившиеся цепи вдали друг от друга, чтобы те не соединились вновь.(10 на рисунке)
По некоторым данным в процессе репликации принимают участие около 20 белков, но здесь перечислены основные.
Терминация репликации. В ДНК имеются специфические последовательности, с которыми связываются терминаторные белки, препятствующие дальнейшему продвижениюрепликативной вилки. Синтез ДНК заканчивается.
Значение теломер для репликации. Как оказалось ДНК-полимераза начинает синтез только со специального РНК-праймера. После окончания синтеза ДНК РНК-праймеры удаляются, а пропуски в одной из дочерних цепей ДНК заполняются ДНК-полимеразой. Однако на 3'-конце ДНК такой пропуск заполнен быть не может, и поэтому 3'-концевые участки ДНК остаются однотяжевыми, а их 5'-концевые участки – недореплицированными, вследствие чего одна из 2 дочерних цепей становится короче на 60-80 нуклеотидов.
Так происходит практически у всех клеток живого организма, за исключением опухолевых, половых и стволовых клеток(в костном мозгу- синтезируют клетки крови) за счет наличия специального фермента, называемого теломеразой. Его работа состоит из 2 этапов: элонгации и транслокации. Элонгация – удлинение теломерного участка, а транслокация- его перемещения для следующей элонгации.
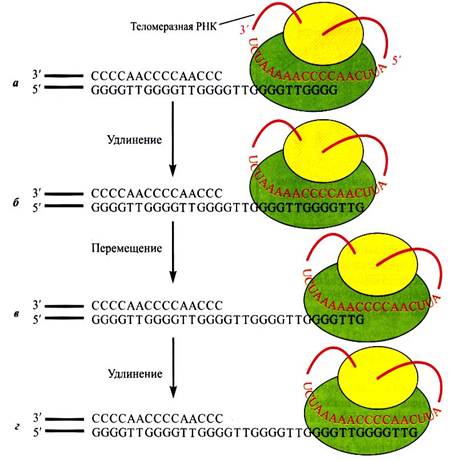
Благодаря их наличию эти клетки никогда не стареют. Существует даже теломерная теория старения, которая утверждает , что жизнь клетки прямо пропорционально длине теломер. Теломеры- это плотно упакованный нетранскибируемыйгетерохроматин(красный ), который защищает ценный эухроматин(фиолетовый).
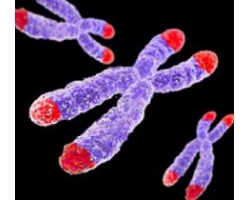
Так что существует определенное число делений после которого теломера исчезает и клетка погибает. Это число называется лимитом Хейфлика.
Транскрипция(синтез и созревание иРНК)
Транскрипция- сложный процесс синтеза иРНК на матрице одной из 2 цепей ДНК. Транскрипция наряду с трансляцией являются механизмами экспрессии(проявляемость, свидетельство активности) генов и в результате этой экспрессии синтезируется белок- продукт активности гена. Но о трансляции позже, уверен, если вы дочитали до сюда, то начальное представление вы о ней уже имеете. Вернемся к транскрипции, как и у репликации есть нерушимые правила(принципы) транскрипции:
1) Комплементаность- у иРНК тоже есть те же азотистые основания, как и у ДНК, за исключением тимина, поэтому аденину- урацил, цитозину- гуанин.
2) Консервативность-иРНКодноцепочечная и эта цепь, так как одна не содержит старой цепи как при репликации, поэтому он называется принципом консервативности, а не полуконсервативности
3) Антипараллельность-это если, одна цепь с 5̕ -3̕, то вторая будет с 3̕ - 5̕ .
4) Униполярность- синтез иРНК всегда происходит в направлении 5̕ -3̕ .
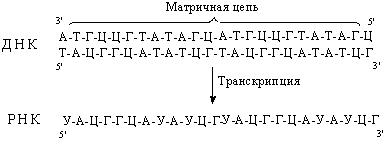
Не запутайтесь матрицей для синтеза иРНК на рисунке послужила 1 цепь(3 и 4 принципы).
Процесс транскрипции осуществляется в 3 этапа:
1) Инициация
2) Элонгация
3) Терминация
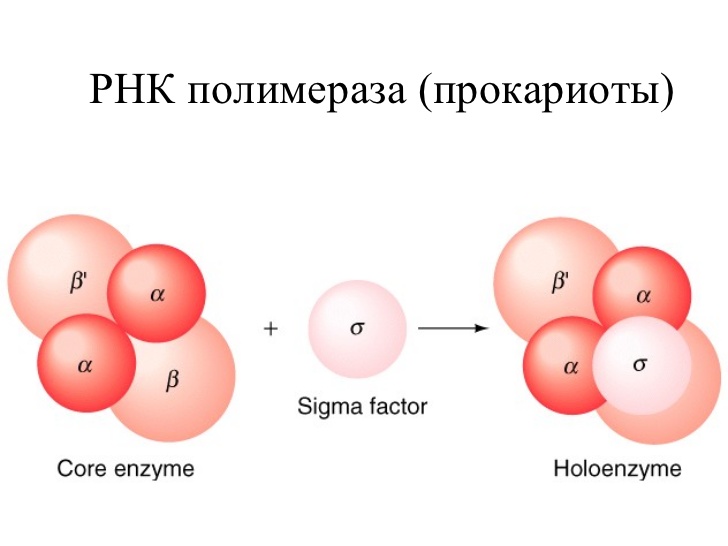
Основным ферментом синтеза иРНК является фермент РНК- полимераза, которая состоит из 2 альфа и 2 бета субъединиц. Также в ней особое место занимает сигма субъединица, которая активирует этот комплекс и как видите на рисунке кор-фермент(пассивный) становится холо-ферментом(активный)
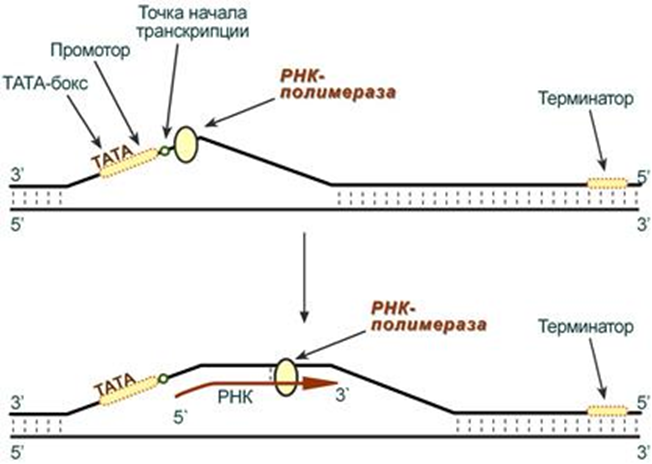
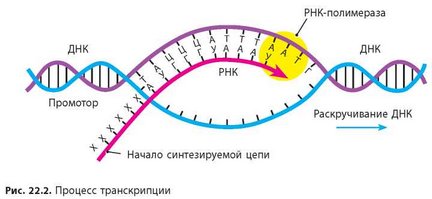
Для начала процесса инициации необходимо, чтобы образовался холо-фермент на промоторе. При этом вначале присоединяется кор- фермент к ТАТА- боксу(- 10 последовательность) и лишь после сигма субъединица к узнаваемой последовательности(-35 последовательность) после чего между двумя цепями начинают разрываться водородные связи и ДНК начинает раскручиваться как на рисунке. У эукариот процесс инициации протекает несколько сложнее, так как для образования этого комплекса им нужен целый ряд ферментов- называемых для удобства факторами транскрипции. И если у прокариот имеется всего 1 разновидность РНК-полимеразы, синтезирующая все 3 типа РНК(тРНК, иРНК, рРНК), то у эукариот их 3. Потом пройдете, что за что отвечает. И если вспромнить строение гена, то на процесс транскрипции как и у прокариот, так и у эукариот могут влиять на процессивность: энхансеры(усиливают процесс), сайленсеры(тормозят процесс).
Элонгация.Эта стадия основная. Холо- фермент продвигается в направлении кодирующей части ДНК и после синтеза 8-10 первых нуклеотидов иРНК на матрице 1 цепи ДНК сигма субъединица отрывается и дальнейший синтез иРНК осуществляет кор-фермент. Свою функция активатора сигма субъединица выполнила и теперь может идти отдыхать. На данном этапе, как и при инициации у эукариот, как и у прокариот, так и эукариот существуют факторы элонгации, которые ускоряют этот процесс.
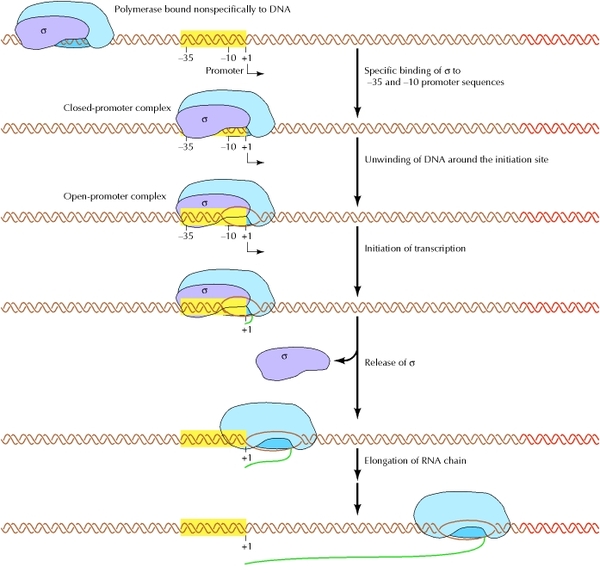
Терминация транскрипции. Окончание процесса транскрипции происходит тогда, когда РНК- полимераза синтезирует один из трех терминирующих кодона(УАА, УГА, УАГ).
Созревание пре-иРНК
Этот процесс по-научному называют процессингом или посттранскрипционной модификацией. Дело в том, что образующаяся в результате иРНК оказывается первичной (несозревшей) и только после протекания процесса созревания она может служить матрицей для синтеза белка на рибосомах. Причем этот процесс может быть и у тРНК и рРНК и только у эукариот, так как из- за нахождения наследственного материала в цитоплазме , еще не успевшая полностью синтезироваться иРНК подвергается в тот же момент процессу трансляции. Процессинг включает в себя 3 стадий:
1) Кэпирование- этот процесс протекает ещё во время транскрипции и состоит в том, что к 5̕ концу соединения 7- метилгуанозина. Функциональное значение этого процесса- защита пре-иРНК с 5̕ конца от экзонуклеаз- ферменты, расщепители.
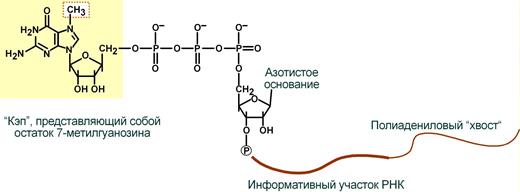
2) Полиаденилирование- процесс присоединения к 3̕ концу иРНК при помощи фермента поли(А)-полимеразы от 100 до 200 аденинов. Синтез подобного хвоста необходим для защиты иРНК от экзонуклеаз с 3̕ конца.
3) Сплайсинг. Если вспомните строение гена эукариот, то у них в кодирующей части были интроны, которые не содержат в себя никакой информации для синтеза будущего белка и поэтому они должны быть вырезаны. Процесс этот осуществляется при помощи малых ядерных РНК, при этом интроны вырезаются, а экзоны сшиваются.
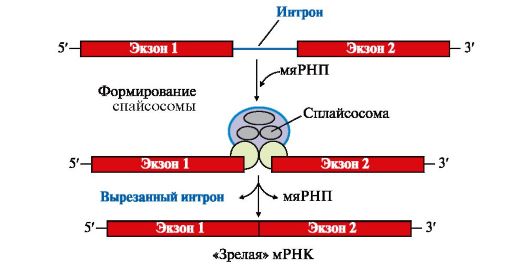
Также учеными был обнаружен альтернативный сплайсинг, когда экзоны могут расположится не в том порядке, в каком они были в гене, а по- другому. Смотри на рисунок для понимания.
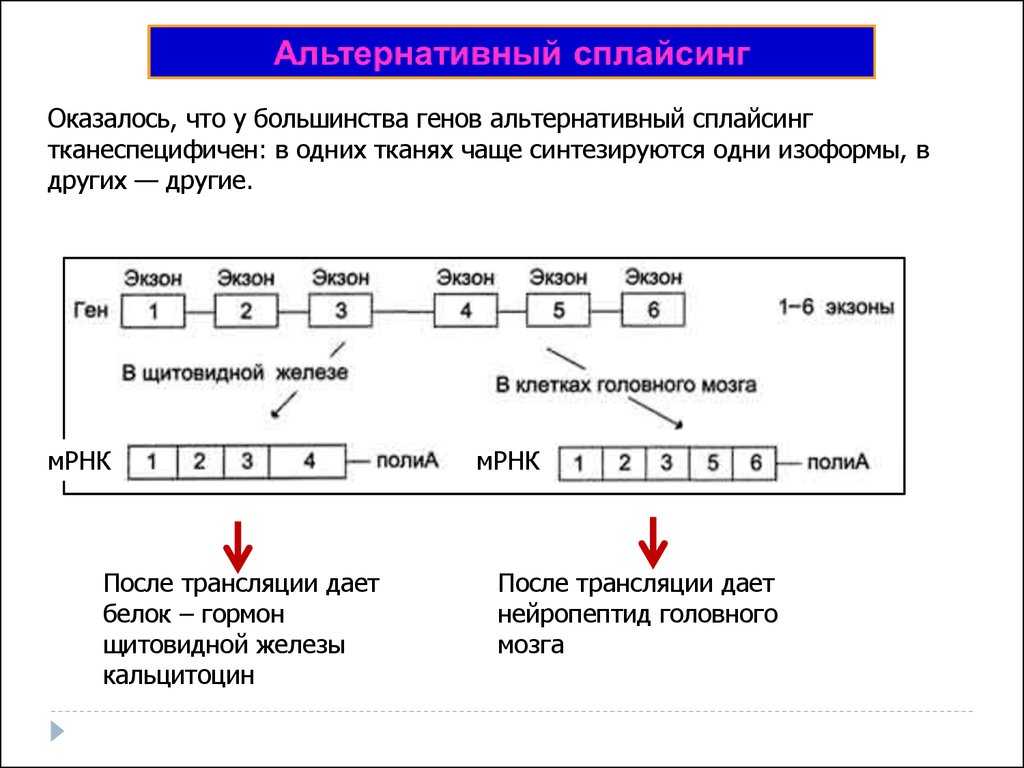
Генетический код. Трансляция (биосинтез белка)
Прежде чем начать говорить трансляции я должен сказать о генетическом коде. Генетический код- это способ кодирования информации о порядке аминокислот в белке. Ключом к кодированию является триплет(кодон)- последовательность из 3 нуклеотидов. Каждому триплету соответствует определенная аминокислота. И так как в ДНК 4 азотистых основания, а аминокислоте соответствует 3, то 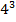 будет 64 кодона, из них 61 являются смысловыми, то есть они кодируют аминокислоту, а три являются бессмысленными(терминируюшими)- УАГ,УАА,УГА.
будет 64 кодона, из них 61 являются смысловыми, то есть они кодируют аминокислоту, а три являются бессмысленными(терминируюшими)- УАГ,УАА,УГА.
Свойства генетического кода:
1) Триплетность- единицей кода является триплет(кодон).
2) Непрерывность- триплеты при трансляции считываются непрерывно, триплет за триплетом без пропусков.
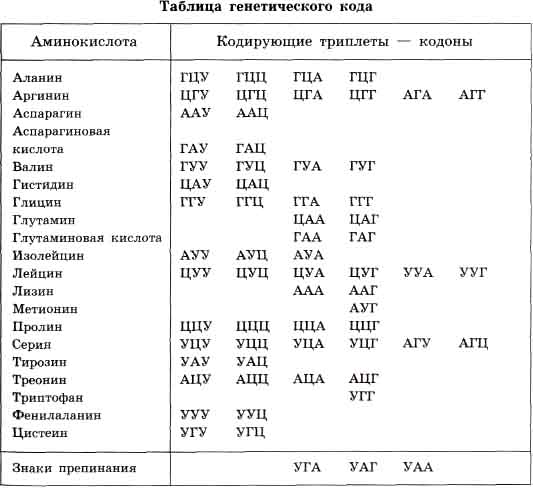
3) Вырожденность- 20 аминокислотам соответствует 61 кодон, значит одну аминокислоту может кодировать несколько кодонов. Вырожденность подразделяется на:
а) полную: первые 2 нуклеотида в триплете одинаковые, различается третий(например, аминокислоту пролин кодирует 4 триплета: ЦЦА, ЦЦУ, ЦЦЦ, ЦЦГ)
б) неполная: первые 2 нуклеотида разные (аминокислоту серин кодируют 4 триплета-УЦУ, УЦЦ, УЦА,УЦГ)
4) специфичность- каждому 1 триплету- 1 аминокислота. Если 1 аминокислоту могут кодировать несколько триплетов, то обратная связь не канает
5) неперекрываемость- это значит, что 1 нуклеотид в триплете входит в состав только этого триплета и не может принадлежать 2 триплетам одновременно
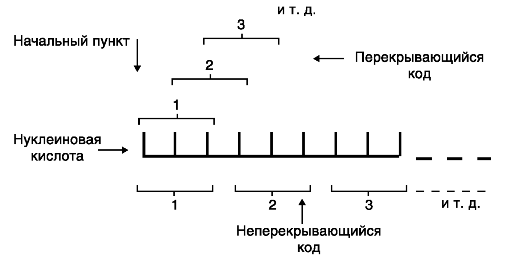
5) универсальность- генетический код одинаков от вирусов до человека, по сути это свойство свидетельство единства происхождения всех живых организмов на нашей планете.
Трансляция
Трансляция- сложнейший процесс синтеза белка из аминокислот на матрице иРНК. В этом процессе, в отличие от репликации и транскрипции принимают участие все 3 класса РНК. Процесс осуществляется на рибосомах – органеллах клетки, состоящих из малой и большой субъединиц, которые вместе образуют целостный комплекс только при синтезе белка. Как наверняка вам известно, аминокислоты переносятся тРНК к рибосоме, но в прежде они должны быть к ней присоединены. Этот процесс осуществляется благодаря ферменту аминоацил-т-РНК-синтетазе.
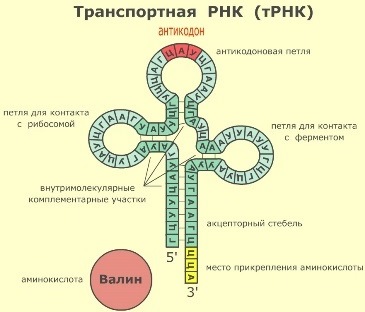
На картине очень хорошо куда именно прикрепляется аминокислота . Транспортных РНК всего 20 как и аминокислот и значит и 20 антикодонов, но как вы спросите ведь смысловых кодонов 61, оказалось, что такое возможно благодаря специальному нуклеотиду инозину, который при определенных условиях может превращаться в либо аденин, либо урацил или цитозин и гуанин.
Сам процесс трансляции состоит из 3 этапов:
1) Инициация
2) Элонгация
3) Терминация
Инициация. Для начала синтеза белка необходимо образование инициаторного комплекса. Так заведено, что первой аминокислотой во всех белках у эукариот является метионин, а у прокариот он подвергается метилированию(СН3) и называется метилметионином. И чтобы найти именно этот триплет, который является начальным, то есть кодирует метионин(или метилметионин), ведь в пептиде может быть несколько метионинов у прокариот перед ним на расстоянии в 10 нуклетидов стоит последовательность нуклеотидов АГГАГГУ , которую в науке назвали последовательностью Шайна- Дальгарно. Уэукариот же этот процесс протекает в 5̕кэпированном конце при участии определенных инициаторных белков(IF1, IF2,IF3). Далее после узнавания последовательности Шайна-Дальгарно малая рибосомная субъединица движется в сторону кодона, который кодирует метионин(начальный кодон также одинаков у всех- АУГ) . После узнавания этого кодона с малой рибосомной субъединицей соединяется большая рибосомная субъединица и образуется полноценная рибосома.
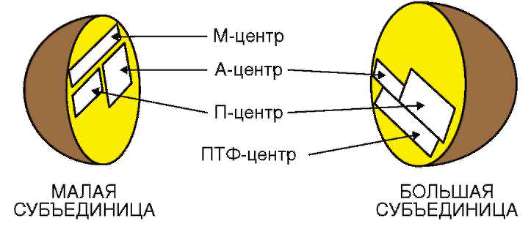
Как видите на рисунке у большой субъединицы различают П(пептидильный)- центр, А(аминокислотный)- центр и ПТФ(пептидилтрансферазный) центр. Я это говорю к тому, что после образования целостной рибосомы в П-центр заходит тРНК, переносящее аминокислоту метионин, метионин от нее отщепляется и остается в ПТФ- центре . после А- центр идет вторая т-РНК со второй аминокислотой, она также отщепляется и идет в ПТФ- центр. Между 1 и 2 аминокислотами образуется пептидная связь(СО-NH) при помощи гуанозин- нуклуотид связывающего белка(ГТФ).На этом процесс этап инициации заканчивается.4
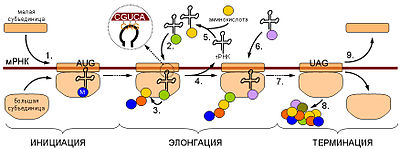
Элонгация.Процесс элонгации- циклический процесс. Отличается от инициации еще и тем, что при его осуществлении происходит перемещение рибосомы, для того, чтобы освободился А- центр для следующего тРНК и следовательно аминокислоты, связывание её с предыдущей при помощи всё того же ГТФ, опять перемещение рибосомы и повторение того же процесса вновь и вновь.
Терминация.Конечный этап синтеза полипептидной цепочки и её отделение. Когда один из трех терминирующих кодонов(УАА,УАГ,УГА) попадает в А- центр, нет кодона комплементарного нему и А-центр заполняется специальным белком RF, который ставит точку в этом процессе.
Так синтезируется первичная структура белка, который представляет из себя линейную цепочку аминокислот. Однако некоторым белкам для осуществления своих функций необходимо более сложная структура. Для этого они претерпевают посттрансляционныепреоброзования- по- научнномуфолдинг.
Синтезированный при трансляции белок- полипептидная цепь первичной структуры, аминокислоты в ней соединены только при помощи прочных ковалентных связей(CO-NH).
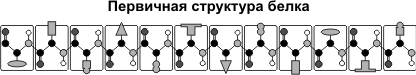
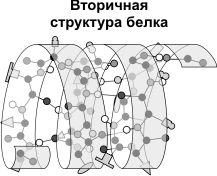
Вторичная структура- это укладывание первичной структуры в спираль благодаря образованию между соседними аминокислотами водородной связи(связь между водородом и сильно отрицательными элементами типо О,SN). В частности это структурные белки(актин, миозин мышц или фиброин шелка и.т.д.)
Третичная структура- дальнейшая укладка в глобулу, при этом образуется множество разнообразных видов связи- это и водородные(О…Н, S…H, N…H), дисульфидные(S-S), ионная( 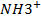 и
и 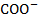 ) и гидрофобные взаимодействия между радикальными остатками аминокислот(СН3 и С2Н5). Примерами белков с третичной структурой выступают многие ферменты, антитела и гормоны.
) и гидрофобные взаимодействия между радикальными остатками аминокислот(СН3 и С2Н5). Примерами белков с третичной структурой выступают многие ферменты, антитела и гормоны.
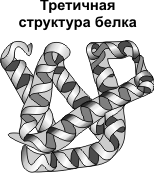
И наконец, самая высшая структура- четвертичная. Она характерна для наиболее сложных белков(гемоглобин эритроцитов). Она характеризуется объединением нескольких глобул в единую структуру.
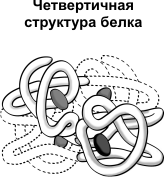
Все эти структуры могут подвергаться денатурации- процессу разрушения под действием неблагоприятных условий( дохождение температуры до 40 по цельсию в подмышечной области, или болезней, спровоцированных вирусами или бактериями ). Но при условии сохранения первичной структуры все прежние структуры могут вернуться в свой прежний вид при возвращении к нормальным условиям(36,6-36,7 градусов по цельсию в подмышечной области, вылечивании)- этот процесс называется ренатурацией и осуществляется под действием белков-шаперонов.Также рибосомы, если вы помните, бывают либо свободными, либо прикрепленными к мембране ЭПС. На свободных рибосомах осуществляются синтез белков для нужд самой клетки(белки плазматической мембраны, белки органелл, ферменты лизосом), а прикрепленные рибосомы- белки «организменного» значения, то есть гемоглобин, амилаза, липаза(клетки тонкой кишки), антитела, гормоны(инсулин, паратгомон, тироксин и др.). Превращение первичной структуры в структуры повыше и выход их из клетки осуществляется в аппаратах Гольджи, но не в ЭПС, в ЭПС они просто накапливаются. Без белков нет жизни, они –продукт экспрессии генов, ведь как выражался Ф.Энгельс: «Жизнь есть способ существования белковых тел…»
Наследственная изменчивость. Мутагенез и мутагенные факторы. Мутации. Генные мутации.
Всем нам знакомо понятие об изменчивости- свойство наследственного материала изменяться под действием различных факторов. Наряду с наследственностью эти 2 свойства относятся к главным и отличительным свойствам живого. Изменчивость подразделяется на:
1) ненаследственную(модификационная, комбинативная)- под действием факторов внешней среды, имеет приспособительное значение и по наследству не передаётся;
2) наследственная (мутационная)- обусловлена действием мутагенных факторов, возникает спонтанно, выявить сложно, так как большинство из них не затрагивает генов, передается стойко по наследству, лечению не поддаются, но можно лечить корректировкой.
Все мутации возникают под действием мутагенных факторов, которые для удобства подразделяют на:
1) физические мутагены- действие высокой температуры, различные виды радиации, действие ультрафиолетового излучения и.т.д
2) химические мутагены- химические вещества, действие никотина табака, алкоголь, запах краски, пестициды, которым травят вредителей, некоторые пищевые добавки, некоторые лекарства
3) биологические мутагены- вирусы.
Мутационная изменчивость внутри подразделяется на:
1) геномные- изменение числа хромосом;
2) генные-измиенение последовательности нуклеотидов в ДНК;
3) хромосомные- изменение строения хромосом.
Геномные мутации подразделяются на:
1) полиплоидия- кратное увеличение числа хромосом (2n+n, 2n+2n, 2n+3nи.т.д). У человека не встречается, чаще бывает у растении, способствуя увеличению их жизнедеятельности и скорости созревания плодов.
2) Анеуплоидия- изменение числа хромосом на одну или несколько(2n+1, 2n+2, 2n-1,2n-2)
Изменение числа хромосом даже на одну приводит к серьезным заболеваниям:
1) Синдром Дауна(47 ХХ(ХУ), 21+);
2) Синдром Патау(47ХХ(ХУ), 13+);
3) Синдром Шерешевского-Тёрнера(45(Х0));
4) Синдром Клаинфельтера (47, XXY; 47, XYY; 48, XXXY; 48, XYYY; 48 XXYY; 49 XXXXY; 49 XXXYY)
Также бывает, что отсутствует 2 хромосомы-нуллисомия(у растений). У человека приводит к мертворождению.
Хромосомные мутации подразделяются на:
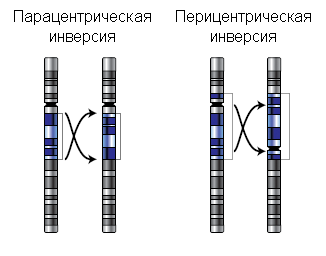
1) Внутрихросомные- в пределах одной хромосомы:
а) инверсия- отрыв и поворот какого-то фрагмента хромосомы на 180 градусов. Она может быть либо парацентрической, если не задевает центромеру, либо перицентрической- если задевает.
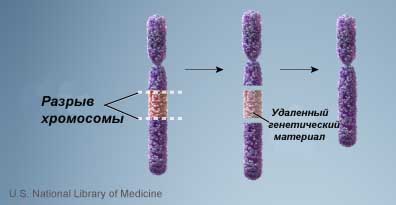
б) делеция- отрыв участка хромосомы.
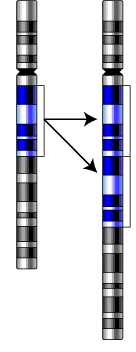
в) дупликация- удвоение участка хромосомы
Генные мутации подразделяются на:
1) Ошибки репликации- замена нормальной пары основании на аномальную. Такое случается если при репликации фермент ДНК- полимераза не замечает ошибки при репликации или под действием различных химических веществ, когда аденин может превратиться в гуанин или цитозин и только при условии .что этого не исправят системы репарации(об этом в следующей теме)- система ферментов, исправляющих различного рода ошибки, возникающие в ДНК. Ошибки репликации в зависимости от того, какие нуклеотиды были заменены подразделяются на:
а) Транзиция. В ДНК 4 азотистых основания, из них А и Г- пуриновые(3 водородные связи), а Т иЦ- пиримидиновые. Транзиция- замена пуринового основания на пуриновое(А→Г), пиримидинового на пиримидиновое(Т→Ц).
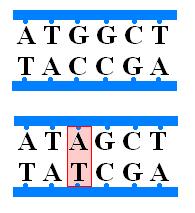
б) Трансверсия- замена пуринового на пиримидиновое(А,Г→Т, Ц)
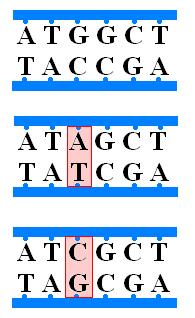
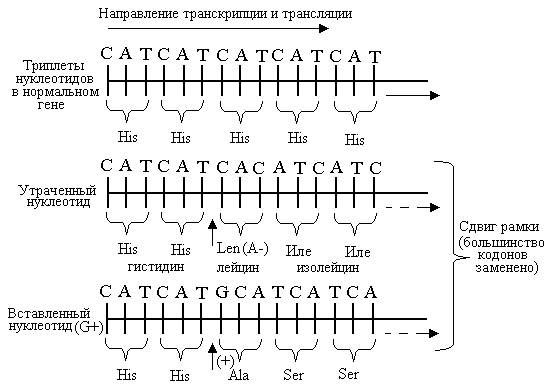
2) Сдвиг рамки считывания- это либо вставка, либо потеря нуклеотида. Также подобные мутации называют фреймшифт- мутациями. Они в человеческом организмы занимают примерно 80% мутации и являются наиболее опасными, так как приводят к изменению всей последовательности аминокислот в белке. Если происходит вставка(инсерция) нуклеотидной пары то это приводит к сдвигу рамки считывания влево, а при потере(делеция)- вправо.
От того насколько мутация повлияет на синтезируемый белок мутации подразделяются на:
1) Миссенс- мутации- замена нуклеотида в триплете, при котором он кодировал одну аминокислоту, привело к появлению другого триплета, кодирующего другую аминокислоту. Например дан нам триплет ГЦУ(в иРНК, но помните, что изменение произошло в ДНК и отразилось в иРНК), кодирующий аланин, и произошла в ней замена 1 азотистого основания на Ц, в итоге образуется триплет ЦЦУ, кодирующий пролин. Данное изменение приводит к синтезу аномального белка, не способного в отличие от нормального выполнять свои функции и провоцированию развития болезни. Это основной класс генных мутации.
2) Нонсенс- мутации- мутации, при котором замена нуклеотида в ДНК приводит к тому, что смысловой триплет становится терминирующим.
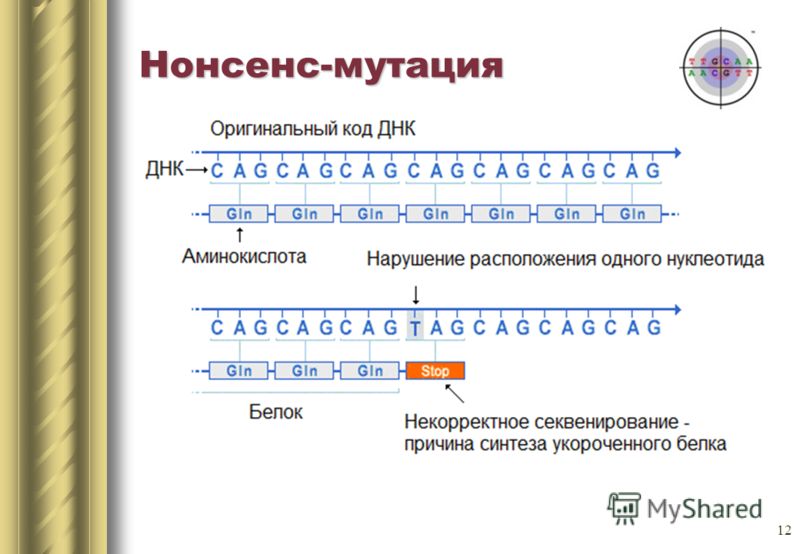
3) Сеймсенс- мутации – мутации, при которых замена нуклеотида в триплете(именно 3 нуклеотида в триплете) не приводит к синтезу другой аминокислоты. Данная мутация обязана свойству вырожденности генетического кода. Например, дан кодон ЦЦЦ, кодирующий аминокислоту пролин и в результате мутации образовалась ЦЦА, кодирующего тот же пролин.
Сплайсинг- мутация- неправильное сшитиеэкзонов, когда при вырезании интронов может случайно захватиться часть экзона, вследствие чего либо будет синтезироваться аномальный белок, либо вообще отсутствовать. Как 1, так и 2 варианты неблагоприятны для организма и будут провоцировать болезни.
Динамические мутации- мутации, при котором увеличивается количество триплетных повторов((CGG)n, (CTG)n, (CAG)n) либо в промоторе, либо в кодирующих областях гена. Мутации подобного рода описаны только у человека и приводит к болезням «экспанссии»- поражение подкорковых структур головного мозга и чем больше триплетных повторов, тем сильнее выражено заболевание.
Регуляторные мутации- когда мутация затрагивает регуляторную часть гена, а именно промотор, энхансер или сайленсер. Это приводит либо к полной остановке синтеза белка(промотор), либо к выработке уменьшенного количества продукта(сайленсер), либо к чрезмерному синтезу белкового продукта(энхансер).
В результате мутации гена на молекулярном уровне возможны следующие варианты: синтез аномального белка; выработка избыточного количества генного продукта; отсутствие выработки первичного продукта; выработка уменьшенного количества нормального первичного продукта.
Генные болезни - это большая группа заболеваний, возникающих в результате генных мутаций. Большинство генных патологий обусловлено мутациями в структурных генах, осуществляющих свою функцию через синтез полипептидов - белков.
Репарация ДНК.
Как мы уже говорили, большинство мутации вредны для организма, поэтому в организме существует специальные антимутационные барьеры, без которых мы бы прожили гораздо меньше:
1) Парность генов в гомологичных хромосомах, которые препятствует фенотипическому проявлению рецессивных мутаций(но эта защита будет бесполезной, если вы выйдете замуж(женитесь) за какого- то близкого родственника, ведь у вас с вашим родственником будут в основном одинаковые гены и вероятность аа будет увеличиваться, следовательно и число болезней);
2) Две цепи в ДНК(одна выступает в качестве запасной и на него будет можно ориентироваться, если повредится какая- то одна из цепей, но если будут повреждены оба цепи, то о восстановлении прежней структуры можно и забыть)
3) Свойство вырожденности генетического кода- одна аминокислота- несколько триплетов(если один триплет будет поврежден можно не переживать за синтез аминокислоты(но, к сожалению аминокислоты пролин и триптофан кодируются всего одним триплетом));
4) Триплетность кода- если повредится 3 нуклеотид, то нестрашно, гораздо страшнее если повредятся 1 и 2(вероятность, того, что генная мутация будет в 3 нуклеотида мала(33,3%), но все же лучше, чем ничего )
5) Наличие в ДНК нескольких повторов одного гена(рРНК, тРНК, иРНК и др.)
6) и-РНК активно разрушаются особыми малыми интерферирующими РНК, если в молекуле есть “неправильно” расположенные кодоны-терминаторы или с ошибками прошло полиаденилирование
7) убиквитин метит полипептиды с ошибками в аминокислотных последовательностей в белке и далее те узнаются белками-шаперонами, которые переносят их в лизосомы и те разрушаются
8) репарация ДНК- целый комплекс сложных реакций, благодаря которым, клетка справляется с мутациями.
Наше ДНК всегда подвержено воздействию самых разнообразных факторов окружающей среды(парниковый эффект- повышение температуры окружающей среды, экология, ГМО и др.). В зависимости от характера повреждения они подразделяются на:
1) спонтанные поврежения:
а) ошибки репликации-некомплементарные пары нуклеотидов.(А-Г, Т-Ц)(о механизме подробнее узнается на кафедре Химии и Биохимии);
б) апуринизация (отщепление азотистых оснований от сахаро-фосфатного остова - образование АР-сайтов). Не зацикливайтесь, поимётесо временем
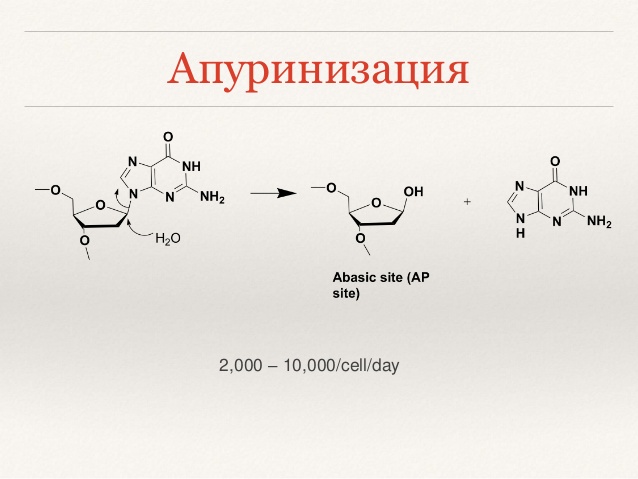 На картинках уловите то, что написано(основную суть) поимёте полностью потом.
На картинках уловите то, что написано(основную суть) поимёте полностью потом.
в) метилирование (алкилирование азотистых оснований )- присоединение СН3, С2Н5 и др.
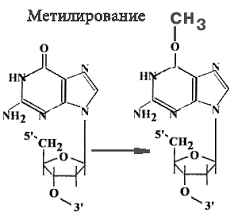 На рисунках, что видите это строение нуклеотида(не зацикливайтесь)
На рисунках, что видите это строение нуклеотида(не зацикливайтесь)
г) дезаминирование (отщепление аминогруппы от азотистого основания)
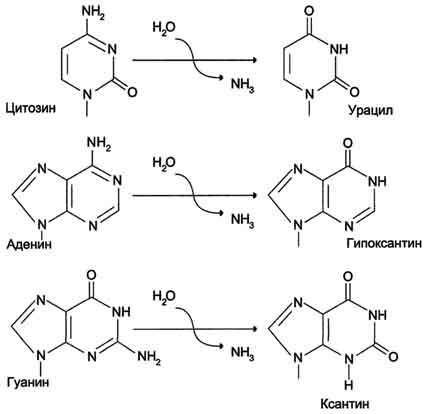
д) окисление(- Н2)
2) к индуцируемым:
а) димеризация- сшивка соседних пиримидиновых оснований(Т, Ц, У).
б) размыкание пуринового кольца(к пуринам относятся А и Г):
в) однонитевые и двунитевые разрывы ДНК:
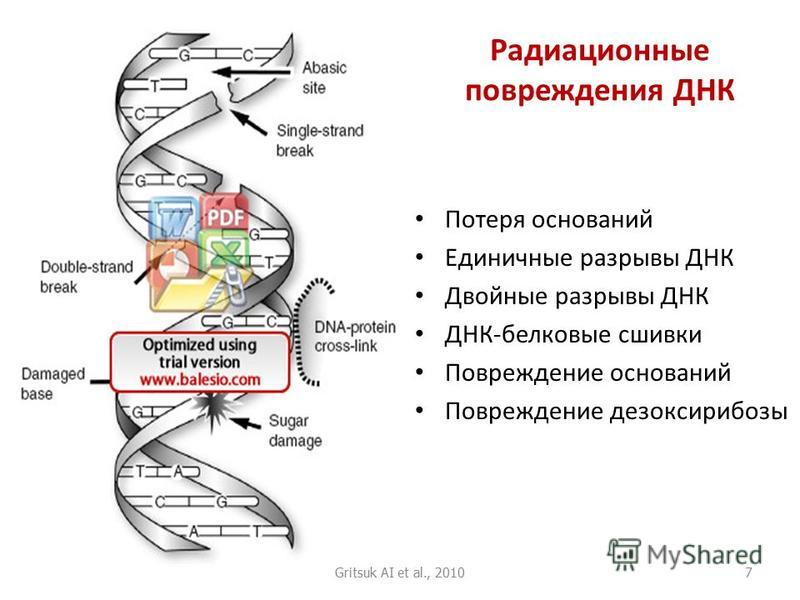
г) сшивки между цепями ДНК
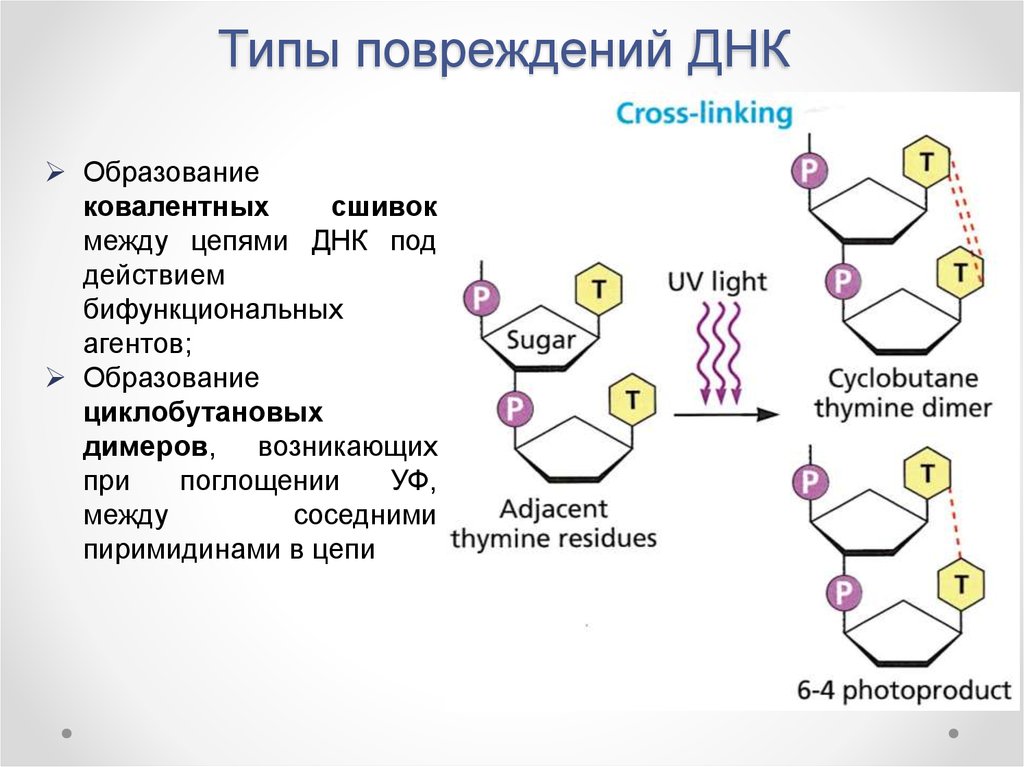
Как видите наше хрупкое ДНК подвержено стольки различным изменениям и всему этому противостоит репарация, и от того насколько хорошо она выполняет свои функции зависит наша жизнь. В этом процессе принимают участие более 150 генов.
Виды репарации:
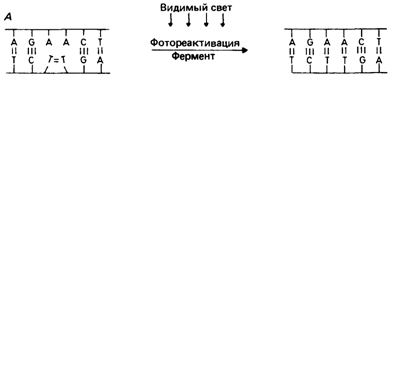
1) Фотореактивация(световая репарация). При длительном нахождении на солнце(ультрафиолетовое излучение) в нашей ДНК могут образовываться сшивки между соседними пиримидиновыми основаниями(Т=Т, Т=Ц), связь эта очень прочная и для её разрыва необходим фермент фотолиаза,которая активируется все тем же светом(как же все- таки парадоксально свет спровоцировал, накосячил, он и исправляет ошибку). Без света данный вид репарации невозможен!
2) Репарация О6- алкилированного гуанина. Мутация бывает из- за присоединения к азотистому основанию (в данном случае гуанину) метильной группы(СН3). Присоединяться может не только метил, но и этил(С2Н5), пропил(С3Н7), но и другие алкильные группы. Их подобная активность объясняется как вы знаете, я надеюсь, наличием активного на наружном слое 1 электрона, который активно ищет себе ещё 1 электрон для образования полноценной пары. Так вот метильная группа присоединяется к гуанину. Репарация в данном случае сводится к отщеплению этой ненужной группы. Осуществляется это благодаря ферменту метилтрансферазе. Причем их нужно 2, так как одна, захватив метильную группу не может от неё освободиться, в помощники ей выступает 2 метилтрансфераза. И если скорость повреждений больше скорости синтеза метилтрансфераз, то метилтрансферазы не успевают исправлять(отрывать СН3) все повреждения, вследствие чего те начинают накапливаться. Попробуйте представить , что дом- это вы, мутации- пули, они не смогут уничтожить дом сразу, постепенно пулевые отверстия будут становиться непомерно большими и дому наступит конец. Также с нашим организмом.
3) Репарация АП(апуриновых)- сайтов за счет прямой вставки пуринов.Вспомним строения нуклеотида. Как вы знаете, он состоит из азотистого основания, сахара дезоксирибозы и фосфатной группы(Н3РО4). При мутациях связь между(гликозидная) между азотистым основанием и сахаро- фосфорной группой может рваться и образуется АП- сайт. Репарация осуществляется благодаря ферменту инсертазе, которые могут вставлять в брешь такое же основание, что и было до повреждения. Вот и все.
4) Эксцизионная репарация(темновая репарация)-более сложный вид репараций, требующий участия комплекса ферментов, а не одного. Она подразделяется на:
а) Эксцизионная репарация азотистых оснований- в отличие от прямой вставки пуринов здесь поврежденное основание необходимо вырезать. Осуществляется этот процесс благодаря ферменту гликозилазе, который рвет связь между модифицированным основание и сахаро- фосфатной группой и образуется АП- сайт. После удаляется и сахаро- фосфатная группа(сахар дезоксирибоза и фосфорная кислота) ферментом фосфодиэстеразойи в ДНК образуется брешь размером в 1 нуклеотид. Далее используя 2 неповрежденную цепь(точнее нуклеотид) в качестве матрицы(антимутационный барьер) и ДНК- полимераза(основной фермент репликации) вставляет в брешь комплементарный нуклеотиду 2 цепи нуклеотид, а лигаза соединяет этот нуклеотид с рядом расположенными в 1 цепи.
б) Эксцизионная репарация нуклеотидов.Отличается тем, что вырезается не 1 поврежденый нуклеотид, но и рядом расположенные неповрежденные. Вначале ДНК раскручивается в месте повреждения, после чего вырезается целый фрагмент(множество неповрежденных и 1 поврежденный ) одной цепи ДНК благодаря действию эндонуклеаз.Далее на основе неповрежденной цепи(матрица) достраивается 2 цепь благодаря ДНК-полимеразе, а лигазасшивает концы вновь синтезированных фрагментов с теми, что не вырезались и сохранились.
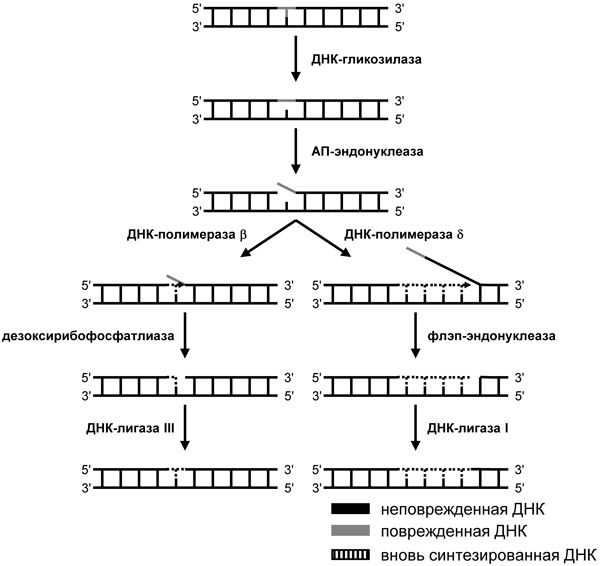
Справа-эксцизионная репарация нуклеотидов, слева- азотистых оснований.
5) Репарация неспаренных оснований(мисмэтч- репарация).В данном случае дефект связан с ошибкой репликации- неправильный характер спаривания между собой нуклеотидов(А-Г, А-Ц, Ц-Т). Ошибки такого рода случаются в наших клетках очень часто и только в дочерних цепях(потому что они синтезируются), матричная же остается неизменной, вследствие чего ферменты репарации оперируют только на дочерней цепи. Но как отличить дочернюю цепь от материнской? Оказалось, что после окончания репликации к полностью синтезировавшейся цепи к А в последовательностях ГАТЦ присоединяются метильные группы и пока дочерняя цепь не успела метилироваться ферментам репарации необходимо успеть отрепарироватьмисмэтчи. Осущестляется этот процесс благодаря белкам МUTH. MUTS, MUTL, MUTU.Вначале к некомплементарной паре нуклеотидов присоединяется MUTS, далееMUTLи 2MUTH, образуя комплекс. Каждый из белков mutH распознает участок ГАТЦ и разрывает дочернюю нить около неметилированныхаденинов в дочерней цепи. После к белку MUTHприсоединяется экзонуклеаза и вместе они разрывают нить ДНК до места повреждения, пройдя даже несколько дальше. После чего ДНК- полимераза застраивает дочернюю цепь на матрице неповрежденной, лигаза сшивает концы вновь синтезированного правильного полностью фрагмента с неповрежденной.
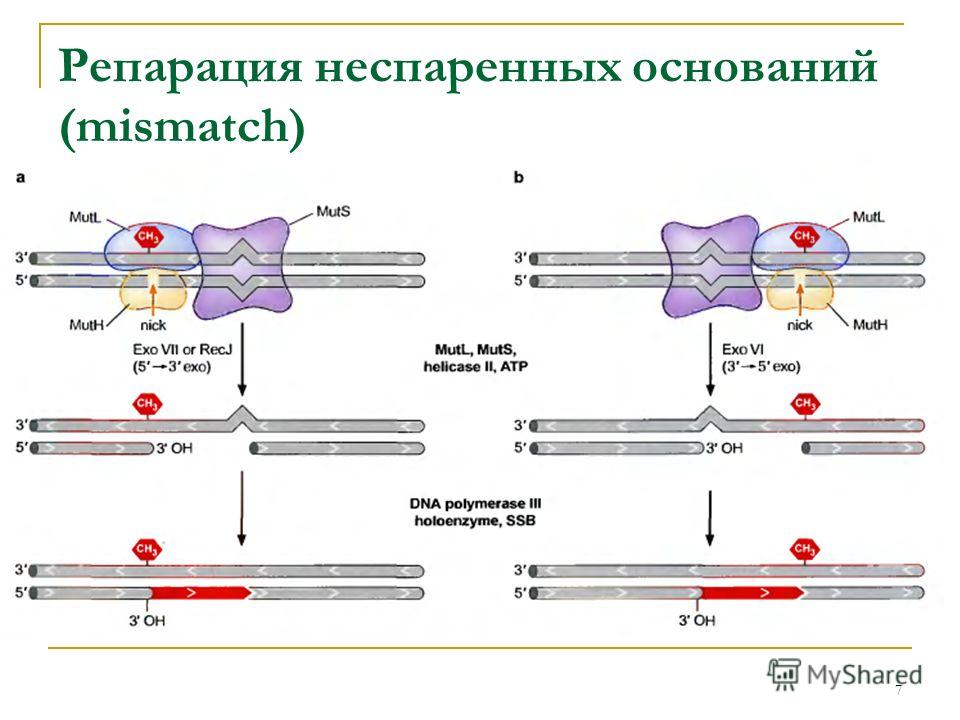
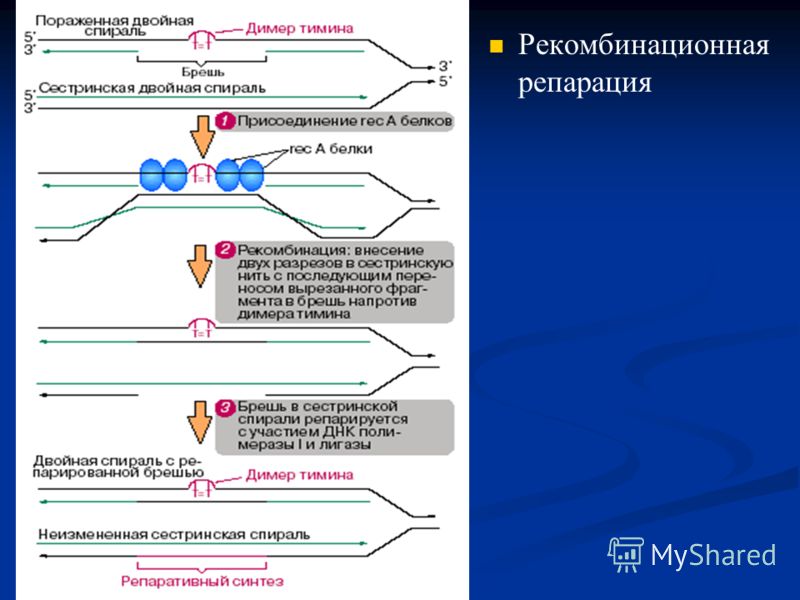
6) Пострепликативная (рекомбинационная) репарация.Данный вид репарации осуществляется , если не срабатывает ни одна из вышеперечисленных систем репарации, вследствие чегов ДНК накапливается количество тиминовыхдимеров(матричная), а в цепи напротив из-за них(тиминовыхдимеров) остаются бреши(дочерняя).И эти бреши необходимо застроить. Осуществляется этот процесс благодаря белкам Rec- A.С их помощью с неповрежденной цепи ДНК (матричной) вырезается фрагмент, комплементарный матричной цепи и вставляется в брешь. Затем лигазы соединяют концы вставленного фрагмента с концами нормально синтезированного участка дочерней нити. Одновременно брешь, оставшаяся после вырезания участка из материнской нити, застраивается ДНК-полимеразой и концы соединяются лигазой.
7) SOS-репарация.Данный вид репарации- как последняя надежда для клетки, к которой она цепляется, не понимая, что лучше смерть, чем SOS- репарация. Она срабатывает, если не работают все вышеперечисленные репарации(включая пострепликативную). При SOS- репарации индуцируется (провоцируется) синтез белков, которые «загрубляют» работу ДНК- полимеразного комплекса и репликация(синтез дочерней цепи) протекает с множеством разного рода ошибок. В результате SOS-репарации клетка спасается от гибели на этом этапе: ее ДНК оказывается удвоенной, хотя и с ошибками, и теперь может произойти клеточное деление, но если жизненно важные функции все-таки безнадежно испорчены, такая клетка все равно погибнет позже из-за неспособности правильно функционировать, что естественно будет намного лучше, но если возникшие мутации не окажут летального действия, клетка худо-бедно, но проживет и ее потомки будут нести уже теперь всегда наследственную память о пережитых некогда последствиях мутационной катастрофы. Несрабатывание систем репарации приводит к ряду заболеваний, носители которых долго не проживут.
Клеточный цикл. Митоз. Регуляция клеточного цикла.
Клеточный цикл- период существования клетки от момента её зарождения путем деления материнской клетки до смерти. Состоит клеточный цикл из 3 этапов:
1) Период покоя
2) Период деятельности
3) Митотический цикл- комплекс мер, направленных на осуществление деления.
Митотический цикл состоит из 2 этапов:
1) Подготовка к делению- интерфаза, которая также подразделяется на 3 этапа:
а) G1(пресинтетический, постмитотический)период- характеризуется высокой синтетической активностью (происходит активная транскрипция и трансляция), благодаря которой клетка вырастает до объема материнской клетки и выполняет свои функции. В конце G1-периода клетка проходит специальный этап (точка рестрикции, R-пункт), после которого она в течение нескольких часов вступает в S-период и изменить этого уже никак нельзя. Период времени между R-точкой и началом S-периода можно рассматривать в качестве подготовительного для перехода в S-период. Длительность- от 2–4 ч до нескольких недель или даже месяцев.
б) S(синтетический)-период- происходит репликация(удвоение молекулы ДНК). Генетический материал с этого момента 2n4c. Длительность- 6-8 часов.
в) G2(постсинтетический, премитотический) период- окончательный перед вступлением клетки в митоз. Характеризуется синтезом белков микротрубочек веретена деления и АТФ, необходимых для процесса митоза.
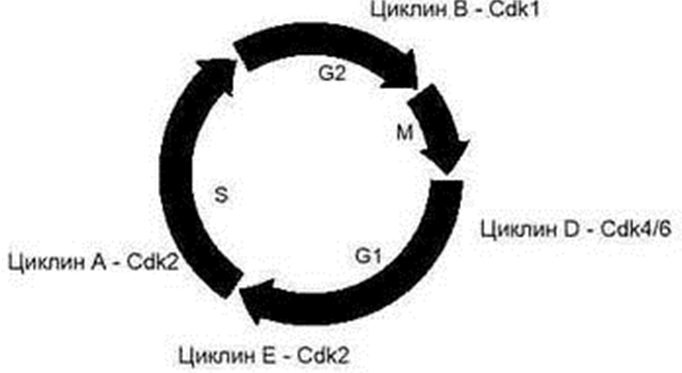
Что лежит в основе перехода одного периода в другой? Я никогда об этом не задумыывался в школьные годы. Оказалось действие специальных белков, называемых циклин- зависимыми протеинкиназами(ЦЗК). Их присутствие в клетках постоянно , но они не активны. Их активация осуществляется другим белком –циклином(активатор ЦЗК), присутствие которых в клетке непостоянно. Их синтез и разновидность синтеза зависит от периода клеточного цикла. Вместе комплекс циклин- ЦЗК на опреденных стадиях клеточного цикла индуцирует синтез регуляторных белков, контролирующие его протекание. За каждую фазу ответственен определенный циклин-ЦЗК.
Контроль уровня циклинов:
1) Фосфолирование/дефосфолирование определенных участок циклин- ЦЗК , при котором они могут быть либо активироованы, либо деактивированы.
2) Ингибирование супрессорными белками комплекса циклин-ЦЗК. Известно два семейства супрессорных белков:
а) семейство INK(p15,p16)- они препятствуют образованию комплекса циклин-ЦЗК, препятствуя раннему вступлению клетки в определенный период клеточного цикла.
б) семейство KIP(p21, p27,p57)- они разрушают уже образовавшийся комплекс циклин-ЦЗК.
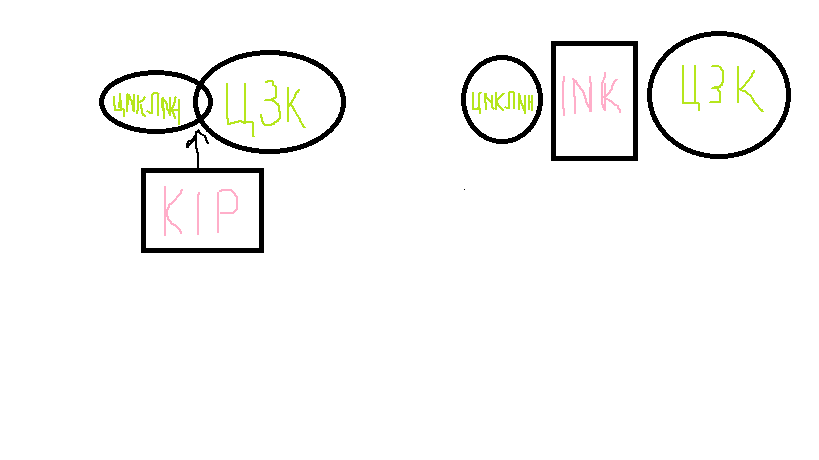
3) Путем регуляции транскрипции(когда один комплекс тормозит транскрипцию второго )
Для перехода клетки в G1- период необходима активация комплекса циклинD- ЦЗК 4(ЦЗК 6). Далее этот(вместе с циклин Е- ЦЗК2) активированный комплекс влечет за собой активацию гена путем фосфолирования рRb и снятию его ингибирующего(подавляющего) влияния на комплекс Е2F-DP. Этот комплекс- транскрипционный фактор для целого ряда генов, продукты(белки) которых необходимы для репликации ДНК в S- периоде.Одним из продуктов активации является циклин Е. Это имеет важное значение, так как во 2-ой половине G1-периода регулирующая роль переходит комплексу циклинЕ- ЦЗК2. Предыдущий комплекс циклинD- ЦЗК4(6) подавляется ингибиторными белками семейства KIP(p21, p27, p57). После начинается S- период. Регулятором выступает циклинА- ЦЗК2(предыдущий подавляется KIP). На этой стадии происходит репликация, ингибироваие комплекса циклинА- ЦЗК 2 и активацияциклина В- ЦЗК1(его также называют митоз стимулирующим фактором(МСФ)) и переход в G2 и митоз непосредственно.Далее идет профаза, а за ней метафаза. Для перехода в анафазу необходимонеобходимо разрушить комплекс циклин В-ЦЗК1. Осуществляется это ферментом убиквитин-лигазой(АРС- anaphasepromotingcomplex). Разрушение МСФ создает возможность отхождения хроматид друг от друга и превращения каждой в хромосому.
Хотелось бы обратить ваше внимание на так называемые чекпойнты- точки, на которых контролируется нормальное осуществление всех периодов. Контроль осуществляется на 4 точках:
1) G1- контроль наличия одно или двунитевых разрывов, непраильноерасхождение(сегрегация) хромосом в результате предыдущего деления и образования микроядер, нарушение числа хромосом.
2) S- контроль количества нуклеотидов на недостаток
3) G2- контроль на повреждение ДНК при репликации, осуществления её полностью и отсутствие недореплицировавшихся частей.
4) Метафаза митоза- контроль прикрепления веретен деления ко всем хромосомам

В результате проверки у клетки есть 3 дальнейших варианта развития событий:
1) Остановка митотического цикла для исправления обнаруженных повреждений, если такое возможно;
2) Безостановочный переход в следующую стадию клеточного цикла(опухолевые клетки)
3) Запуск механизмов апоптоза (запрогромированная гибель клеток(подробнее в следующей теме)), если повреждения неизлечимы(защита от опухолевых клеток).
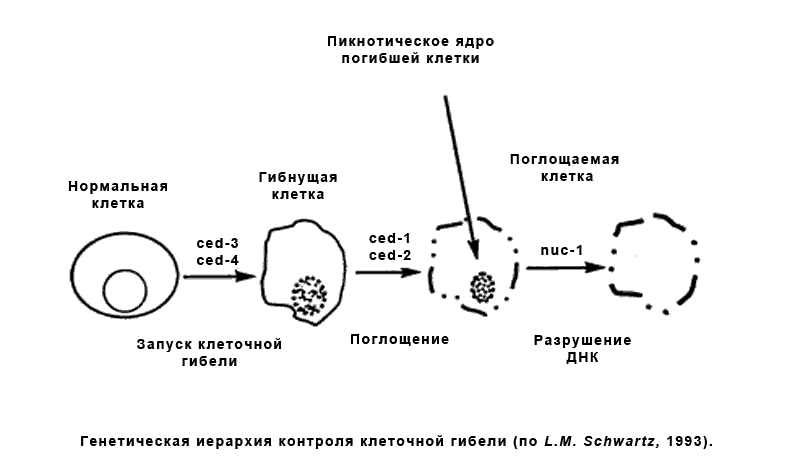
Апоптоз – запрограммированная гибель клетки. Механизмы апоптоза
Всего клетки нашего организма могут самоуничтожаться 2 путями:
1) Некроз-незапрограмированная, индуцированная влиянием неблагоприятных условий среды гибель клетки
2) Апоптоз-запрограмированная гибель клетки.
Каждая клетка нашего организма имеет срок жизнедеятельности(при условии отсутствия опухолевых клеток(вспомните теломеразу)) и способна самоуничтожаться при условии наличия сильных повреждений генетического материала и провоцирования впоследствии активации внутренних генетических программ самоубийства(если это не срабатывает, то человек может заболеть раком). Ежедневно в организме человека погибает несколько десятков миллиардов клеток.Выделяют два вида программированной клеточной гибели:
1) Апоптоз «изнутри»- спровоцировать этот процесс может чрезмерное повреждения генетического материала(чрезмерное накопление неисправимых мутаций), повреждения других внутриклеточных органелл.
2) Апоптоз «по команде» - запускается при подаче сигнала «снаружи» через внутриклеточные рецепторы. Клетка в данном случае вполне даже жизнеспособна, но это все равно необходимо для общего блага организма(порой приходится чем- то жертвовать). Благодаря данному виду апоптоза у большинства людей на этой планете не сращены пальцы и пищеварительная система имеет вид полой трубки. Но , к сожалению, не у всех срабатывают механизм апоптоза, такие люди рождаются с такими болезнями, как атрезия(непроходимость) пищевода, кишечника, синдактилия(сращение пальцев).
Говоря об апоптозе в целом можно выделить 3 стадии:
1) Конденсация хроматина и некоторое сжатие клетки из- за сжатия цитоплазмы.
2) Фрагментация(разделения на несколько) ядра и цитоплазмы с образованием апоптозных телец
3) Фагоцитоз апоптозных телец соседнимиклетками в специальных органеллах, называемых фаголизосомами. Освободившееся в результате место заполняется путем митоза новой клеткой.
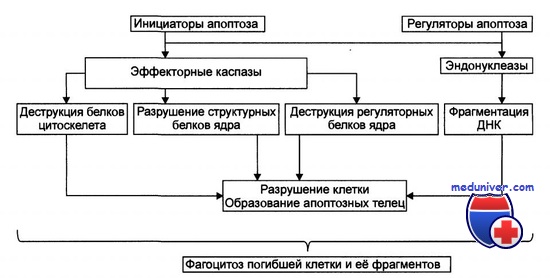
Теперь давайте разберем механизм поподробнее. Дело в том, что в наших клетках существует семейство цитоплазматических протеаз называемых каспазами(всего их 10).Их активация- признак апоптоза. В клетке они существуют в виде предшественников, называемых прокаспазами. Первой в ответ на сигнал, либо повреждение активируется каспаза 8. Далее из- за повреждения мембран митохондрий из неё высвобождаютсяAIF(Apopthoseinductingfactor), цитохром С и Apaf-1, которые в комплексе приводят к превращение неактивной прокаспазы 9 в активную каспазу 9. Каспаза 8 и 9 приводят к активации самой главной каспазы 3(узловаякаспаза). Функцией этих каспаз является ограниченный протеолиз(разрушение) белковых мишеней, которые подразделяются на:
1) Цитоплазматические мишени:
а) фодрин- с его протеолизом связывают образование на поверхности клеточной мембраны впячиваний
б) актин- обеспечивающий внутриклеточный транспорт наряду с микротрубочками
в) регуляторные ферменты: фосфолипаза ,протеинкиназа
2) Ядерные мишени:
а) ферменты репликации: топоизомераза, липаза, ДНК- полимераза и др.
б) белок ламин и гистон Н – их протеолиз приводит к конденсации(уплотнение) хроматина
в) ингибиторы эндонукеаз, следовательно их активация и протеолиз хромосом.
г) протеолиз белка рRb, снятие его ингибирующего(подавляющего) влияния на Е2F-DP, как вследствие вступление клетки в митоз при таких условиях- фатально.
д) активация ДНК-протеинкиназы- фосфолирование ею р53(ключевой белок апоптоза), усиление его активности, потому что первой в ответ либо на повреждение генетического материала(апоптоз изнутри), либо на внешний сигнал(передает сигнал в ядро мембранные тирозинкиназы)отвечает имненно этот белок и лишь после каспазный каскад(что-то типо цепной реакции).
Белок р53 является транскрипционным фактором, активирующим целую группу генов, следовательно и их продуктов- белков. На самом деле этот белок постоянно присутствует в ядре, но не проявляется из- за того, что связан со своим супрессором- белком MDM2. Также на его концентрацию влияют белки ARF(тормозит распад белка р53) и 14-3-3b(антипод MDM2- наоборот активирует ). Активация белка р53 приводит к активации:
1) Стимулирует гены ряда «киллерных» рецепторов, т. е. рецепторов, воспринимающих команду об апоптозе. Белок Fas (Fas- рецептор)и рецептор KILLER. Повышается чувствительность клетки к соответствующим сигналам.
2) Активация гена р21(семейство KIP), которыйингибирует целый ряд комплексов циклин- ЦЗК, что приводит к остановке митотического цикла
3) Ингибирование генов, закрывающих каналы в митохондриальных мембранах(bcl-2, bcl-x) и активация генов, открывающих их(bax). Открытие каналов митохондриальных мебран приводит в высвобождению факторов(цитохром С, Apaf-1, AIF), стимулирующих переход прокасазы 9 в активную каспазу 9.
4) Активациягенов TSP, BAS(следовательно и продуктов) клетки с начавшимся апоптозом секретируют белки (тромбоспондинTspl и т. д.), подавляющие новообразование сосудов в соседней ткани. Это лежит в русле важной функции апоптоза - ограничение опухолевого роста.
5) Активация ß-ингибина, который тормозит пролиферацию соседних клеток.
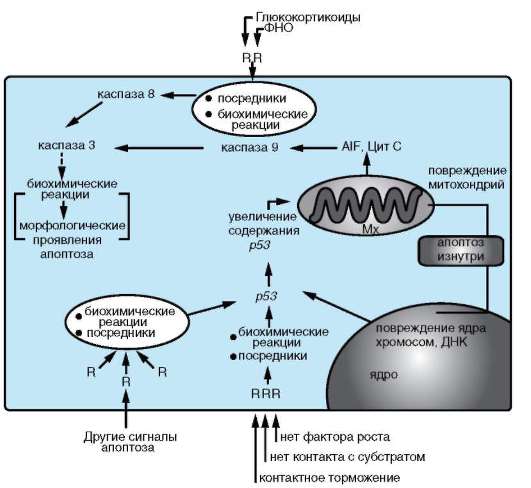
Итак, давайте повторим стадий апоптоза:
1) Повреждение внутриклеточных структур, особенно хромосом и мембран.
2) Передача сигналов (с помощью специальных протеинкиназ и других модифицирующих ферментов) на транскрипционный фактор р53. Модифицироваться может как сам белок р53, так и его ингибитор белок Mdm2. В любом случае достигается следующий результат повышение содержания (за счет замедления распада) и (или) активности фактора р53.
3) Повышение проницаемости митохондриальных мембран благодаря влиянию р53 на гены семейства BCL-2, и непосредственного повреждения мембран.
4) Включение каспазного каскада. Частичныйпротеолизкаспазами многочисленных белков-мишеней.
5) Различные последствия частичного протеолиза:
а) конденсация хроматина (результат протеолиза структурных белков гистона H1 и ламинов),
б) активация ядерных эндонуклеаз (из-за протеолиза их ингибиторов) и в) изменение липидного состава плазмолеммы (по причине изменения активности ряда мембраносвязанных ферментов). Протеолиз может иметь последствия, которые придают апоптозу черты автокаталитического процесса путем усиления или повторного запуска некоторых его предыдущих стадий.
г) Частичный протеолиз ДНК-протеинкиназы тоже активирует этот фермент, отчего последний с новой силой влияет на содержание и активность фактора р53.
д) Протеолиз белка pRb подавляет его ингибиторную активность в отношении транскрипционного фактора E2F-DP. Последний запускает клеточный цикл, репликацию ДНК. Что приводит к новым нарушениям их структуры и к повторной инициации «апоптоза изнутри».
6) Действие эндонуклеаз постепенная фрагментация хроматина.
7) Завершающие морфологические преобразования:
а) фрагментация ядер и цитоплазмы с образованием апоптозных телец;
б) фагоцитоз этих телец окружающими клетками.
Онкогенетика.Молекулярные механизмы канцерогенеза.
На данный момент всем нам знакомо это страшное и неизлечимое понятие. По смертности во всем мире оно заняло 2 место после сердечно- сосудистых заболеваний. Но если в большинстве случаев развития сердечно- сосудистых заболеваний виноваты в основном м сами, то в случае с раком очень тяжело выявить конкретно причину заболевания. Рак(собирательное название всех злокачественных новообразований)- это избыточная (анормальная) масса ткани, возникшая в результате неконтролируемого чрезмерного деления. Обычно рак относится к полиэтиологичным заболеваниям(многофакторным) заболеваниям. Для развития рака даже могут понадобиться десятилетия. Как правило в результате ужасных и неисправимых изменений лишь в 1 единственной клетке может развиться заболевание. Сам процесс превращения нормальной клетки в опухолевую называется канцерогенезом(онкогенозом). Факторы же, провоцирующие этот переход, называются канцерогенными. Они подразделяются на:
1) Физические канцерогены- ионизирующее излучение, ультрафиолет света, слишком горячий чай(в Западном Казахстане много пьющих горячий чай, следовательно и болеющих раком пищевода.), радиация и др.
2) Химические канцерогены-табакокурение ( бензапирен,бензидин составе табачного дыма), алкоголь и еще множество других различных химикатов.
3) Биологические канцерогены- только вирусы.
Единичного генетического повреждения, как правило, недостаточно для превращения клетки в опухолевую (опухолевой трансформации). Лишь накопление 5-10 мутаций в течение продолжительного времени (часто многих лет), изменяющее несколько генных продуктов, приводит к появлению злокачественного новообразования.

| Мутация гена-супрессора р53 |

| Протоонкогены |
| Отключение репаразных систем клетки |
| Онкогены |
| Дефект гена р53, выключение супрессорной функций |
| Активация генов-супрессоровапоптоза |
| Амплификация генов. Хромосомные перестройки. Безудержное размножение клеток. Образование клона атипичных (опухолевых) клеток. |
Итак, давайте перейдем теперь к молекулярным механизмам, способствующим переходу нормальной клетки в опухолевую. В этом нам поможет таблица выше. В опухолевую нормальная клетка может перейти только при наличий 3 условий:
1) Превращение протоонкогена в онкоген
2) Отключение генов-супрессоров(подавителей) опухолевого роста
3) Дефект репарационных систем организма
Казалось бы зачем в организме гены, которые могут переходить в опухолевые? Все бы ничего, но они как оказалось очень важны организму из-за их важных функции. Протоонкогены- это группа семейств генов, которыеиграют ключевую роль в пролиферации и дифференцировке клеток, функционировании клеточных рецепторов, репарации ДНК и формировании ответа на внешние регуляторные сигналы. Продуктами этих генов являются белки, называемые факторами роста.
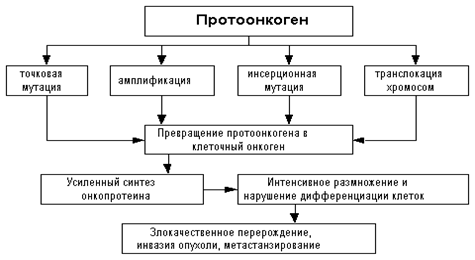
Нормальный протоонкоген может превратиться в онкоген 4 возможными путями:
1) В результате генной(точковой) мутации в кодирующей части гена, синтезируется аномальный белок, центр связывания которогос ингибитором(белок- подавитель) нарушен, вследствие чего этот белок будет постоянно активен, вследствие чего будет постоянно стимулировать соответствующий процесс.
2) Амплификация( увеличение количества копий) протоонкогена- в результате увеличения количества протоонкогена будет увеличиваться впоследствии и количество производимого лишнего и ненужного белка. Спровоцировать этот процесс может, кстати говоря, стрессовые ситуации, поэтому постарайтесь меньше нервничать, так как стресс- тоже канцерогенный фактор.
3) Инсерционная(вставочная) мутация обязана некоторым вирусам, которые способны вставлять, входящий в состав их генома онкоген в геном человека, тем самым провоцируя опухоль.
Примером подобных вирусов являются:
а) вирусы, вызывающие папиломы (папилломавирусы).Вирус папилома может индуцировать рак шейки матки.
б) вирус Эпштайн-Барра (EBV), вызывающий развитие лимфом;
в) вирус гепатита В (HBV)-способный вызывать рак печени.
г) вирус герпеса, вызывающий саркому(злокачественная опухоль, возникающая в соединительной ткани)Капоши (KSHV).
Как известно наследственный материал вирусов представлен либо РНК, либо ДНК.
ДНК- содержащие вирусы при проникновении в клетку далее внедряются в ядро после чего непосредственно внедряются в наше ДНК. РНК- содержащие вирусы же для того чтобы внедриться необходимо превратить его РНК в ДНК. Осуществляется этот процесс благодаря ферменту обратная транскриптаза, а механизм- обратной транскрипцией. Благодаря этому ферменту вирус просто навсего достраивает 2 цепь, используя в качестве матрицы цепь РНК.
4) Транслокацияхромосом-этоприсоединение к протоонкогену нового транскрипционного промотора взамен номального в результате транслокациихромосом, как следствиепротоонкоген начинает работать непрерывно, синтезируя белок постоянно, нерегулируемым образом, т.е. превращается в онкоген.
Однако мутации в протоонкогенах недостаточно для канцерогенеза, необходима ещё мутация в антионкогенах(генах-супрессорах опухолей). Антионкогенами называется семейство генов, защищающих наш организм от воздействия канцерогенных факторов и от процесса опухолевой трансформации клеток. В норме они подавляют клеточную пролиферацию на определенных стадиях онтогенеза, т.е.регулируют (тормозят) экспрессию протоонкогенов.Мутации в генах – супрессорах приводят к синтезу белков, измененных в структурно-функциональном отношении с последующим запуском опухолевой трансформации клеток различных органов и систем.В настоящее время идентифицировано свыше 20супрессорныхгенов, мутации в которых приводят к развитию опухолей. Наиболее частыми мутациями в генах-супрессорах опухолевого роста являются миссенс-мутации и точковыеделеции в структурной части гена. Наиболее изученныеантионкогены — ген p53 и Rb.
Ген Rbв норме является геном-супрессором для ретинобластомы- злокачественной опухоли глаза. Когда происходит его мутация, то происходит снятие его ингибирующего(подавляющего) влияния на комплекс Е2F-DP, в результате чего происходит постоянный запуск митоза, как следствие и неконтролируемый рост.
Но самым важным геном-супрессором опухолевого роста является р53. Почему? При его нормальной деятельности(запускает апоптоз) даже если протоонкоген сумел превратиться в онкоген, р53 это чувствует и запускает комплекс механизмов(вспомни апоптоз), приводящих к гибели клетки и спасению нас от рака. Его же мутация является причиной появления более 50% опухолей человеческого организма, потому что опухолевая клетка сохраняется и убить его теперь невозможно.
В дополнение к этим классам генов, участвующих в онкогенезе, необходимо назвать гены репарации ДНК. Нарушения в системе этих генов вызывают нестабильность генома, что предраспологает клетки к генным мутациям, которые дают начало опухолевому процессу.
Канцерогенез клетки приводит к активации гена, ответственного за синтез теломеразы(фермент, удлиняющий концевые участки(теломеры) хромосом) и его активность обуславливает его(опухолевой клетки) бессмертие.
Опухоли по способности к распространению делятся на:
1) Доброкачественные опухоли(фиброма, миома, ангиома, невринома, хондрома, остеома,паппилома, базалиома и др.)- называется, если она растет очень медленно и не выходит за пределы своей ткани, и не внедряется в подлежащие или соседние ткани - не инвазирует(внедряется), и не метастазирует(внедряется в другие ткани и органы, давая вторичные очаги опухолей) . Мелки опухоли не содержат кровеносных сосудов, поэтому из-за недостатка снабжения, хотя клетки непрерывно растут и размножаются, этот процесс уравновешивается отмиранием более старых клеток. В итоге опухоль не растет и его можно вылечить хирургическим путем, либо облучением.
Свойствами доброкачественной опухолевой клетки являются:
а) ее безудержное и неконтролируемое деление, обусловленное отсутствием (снятием) тормозящих пролиферацию клеток механизмов и факторов.
б) автономность опухоли- её независимость от других клеток. В норме каждая клетка ткани «чувствует» присутствие соседней клетки благодаря мембранным рецепторам. Это обуславливает свойство контактного торможения, когда, клетки не делятся при присутствии рядом других клеток. В опухолевой клетке данное свойство теряется.
в) бессмертие клеток благодаря теломеразе
г) моноклональность- происхождение опухоли в результате изменений в одной единственной клетке.
2) Злокачественныеопухоли(фибросаркома,липосаркома,лейомиосаркома, плоскоклеточный рак и др)- ему свойственно все вышеперечисленное(свойства)+ ещё 2 свойства:
д) способность к инвазии-разрастание в данной ткани
е) метастазирование-процесс образования вторичных очагов опухолевого роста (метастазов) в результате распространения клеток из первичного очага в другие ткани.
Они лечению не поддаются из-за этих 2 свойств. Можно только продлить жизнь пациентами все тем же хирургическим вмешательством или облучением, но полное лечение не возможно.
Стадий канцерогенеза.
Различают 3 стадий канцерогенеза:
1) Инициация опухоли – повреждение протоонкогенов. На данной стадий его полное превращение в опухолевую подавляется антионкогенами и контактным торможением.
2) Промоция опухоли– повреждение и антионкогенов, как следствие размножение опухолевых клеток, который может длиться годами
3) Прогрессия опухоли-инвазирование, метастазирование, одним словом превращение доброкачественной опухоли в злокачественную.
Фармакогенетика.
Каждый человек обладает особенностями генетического материала, вследствие чего это обуславливает различных характер ответа у различных групп людей на одни и те же лекарства бывает различной. Изучением причин различного характера ответа вследствие наследственной обусловленности является предметом фармакогенетики.Характер взаимодействия лекарства и организма между собой зависит от множества причин таких как, срок годности лекарственного препарата, болезни органов обезвреживания(печень) и выделения(почки, мочеточники, мочевой пузырь). Но фармакогенетика изучает только те типичные, либо атипичные реакции организма, связанные с наследственностью, а не с патологическим состоянием организма(то есть предполагает полное здоровье организма).
Наследственная индивидуальная чувствительность к лекарственным препаратам определяется двумя основными критериями:
1) Фармакокинетика- это скорость усвоения, распределения, метаболизма(биотрансформации) лекарственного препарата и её выделение. Все перечисленные этапы находятся под контролем соответствующих генов или гена. И от того насколько данные гены активны зависит насколько успешен проидет этап метаболизма лекарственного вещества и проидёт ли он вообще.
2) Фармакодинамика-изучает локализацию, механизм действия и фармакологические эффекты лекарственных средств, силу и длительность их действия.
Согласно этим критериям различают 3 типа метаболизаторов(люди, принимающие лекарства):
1) Экстенсивные метаболизаторы- это люди с нормальной скоростью метаболизма рассматриваемых лекарственных средств. К этому типу относится как правило большая часть населения планеты.
2) Медленные метаболизаторы- это лица с сниженной скоростью метаболизма рассматриваемых лекарственных препаратов. У них вследствие низкой скорости метаболизма лекарство накапливается в организме и приводит к появлению нежелательных побочных реакции.
3) Быстрые метаболизаторы-лица с ускоренной скоростью метаболизма рассматриваемых лекарственных средств. Таким метаболизатором необходимо давать дозу выше, чем остальным, так как быстрый метаболизм не позволяет в полной мере подвергнуть лекарство переработке, вследствие чего тот не проявляет свой лекарственный эффект.
Атипичные реакции в случаях с быстрыми или медленными метаболизаторами можно обьяснить 2 случаями:
1) Либо дефектом ферментных систем, отвечающих за переработку лекарства
2) Либо наследственной болезнью
Дефект ферментных систем, отвечающих за переработку лекарства:
Основные типы осложнений лекарственной терапии, приводящие к атипичным реакциям могут быть:
1) Повышенная чувствительность- из-за медленного метаболизма лекарственного препарата при введении нормальной дозы у большинства людей, у этих индивидумов наблюдаются случаи передозировки.
2) Полная толерантность-нереагируемость, как будто лекарства и не было и введено.
3) Парадоксальная реакция на лекарство, включающая совсем другие типы осложнений, чем это следовало бы ожидать, исходя из механизмов действия лекарства.
Примером повышенной чувствительностик лекарственному препарату является реакция некоторых индивидумов на лекарственный препарат изониазид- лекарственный препарат против туберкулеза. При его поступлений в норме в течение 2 часов этот препарат метаболизируется путём ацетилированияN- ацетилтрансферазой.Но если в гене, отвечающем за синтез N- ацетилтрансферазыпроизошла мутация, вследствие которого его вырабатывается мало, то изониазидацетилируется дольше за 6- 8 часов. За это время он успевает оказать своё токсическое действие. Наследуется ген по аутосоно- рецессивному типу(то есть аа будет страдать, а АА и Аа- норма.)
Примером полной толерантности является случаи заболевания рахитом(искревление костей), когда витамин Dво время образования первичной мочи не может всосаться обратно в кровь. Заболевание называется витамин D-резистентным рахитом, или гипофосфатемией.
Примером парадоксальной реакцииприменение в хирургии для мышечной релаксации дитилина. В норме этот препарат, действующий по типу яда кураре (остановка дыхания), быстро разлагается сывороточной холинэстеразой. Если холинэстераза атипичная из-за мутации в соответствующем гене, то у лиц с таким неактивным ферментом при введении дитилина происходит остановка дыхания на 1 ч. Больных можно спасти только искусственной вентиляцией лёгких в течение этого периода.
Еще один пример-гемолиз эритроцитов у носителей «безобидной» мутации в гене глюкозо-6-фосфат-дегидгогеназы (Г-6-ФД) при приёме сульфаниламидов, примахина и других лекарств (до 40 наименований). Носителями такого генетического дефекта являются не менее 200 млн. человек. Г-6-ФД участвует в процессе восстановления глутатиона. Восстановленныйглутатион в свою очередь защищает мембраны эритроцитов от окисления. Обычно такие больные не выявляются до приема ими лекарственных средств, так как хоть и активность Г-6-ФД у них снижена, но все-таки хватает. А при приеме например противомалярийного препарата примахина Г-6-ФД оказываются разрушенными и как следствие наступает гемолитический криз(массовое разрушение эритроцитов).
Атипичные реакции на лекарственные препараты при наследственных болезнях.
Некоторые наследственные заболевания обмена веществ приводят к необычной чувствительности к различным лекарственным средствам. Среди этих заболеванийтакие как врожденные метгемоглобинемии и др. При врожденной метгемоглобинии( метгемоглобин- это прочное соединение трехвалентного железа с кислородом, в то время как у оксигемоглобина- соединение двухвалентного железа с кислородом вследствие чего тот может отдать кислород) некоторые лекарственные препараты могут вызвать переход двухвалентного железа в трехвалентное. Например, нитроглицерин, сульфаниламиды, хлорамфеникол, антипирин и т.д. Такой переход возможен при дефекте фермента метгемоглобинредуктазы, которая препятствует этому превращению.
Чтобы не допустить смерти больного на данный момент существуют специальные фармакогенетические тесты- эксперименты с ДНК пациента для проверки на определенные лекарства. Благодарянему врач может подойти персонилизованно к каждому пациенту.В настоящее время около 50% из всех применяемых в клинической практике препаратов уже «имеют» генетическую информацию, т. е. проведены исследования ассоциаций между полиморфизмами тех или иных генов и фармакологическим ответом на лекарство (развитие непредвиденных реакций, или неэффективность, или, наоборот, высокая эффективность). Уже сейчас пациенты некоторых стран имеют фармакогенетическиепаспорты, опираясь на которые врач может назначать соответствующие лекарства.
Эпигенетика.
Геном человека состоит из огромного количества генов, но несмотря на это человечество сумело обнаружить и обнаруживает все новые гены. Наукой, занимающейся изучением генома человека являетсягеномика.
Геномика подразделяется на:
1) Структурную- её задача состоит в изучении последовательности нуклеотидов в геномах, определяет строение и границы генов, межгенных участков и других структурных генетических элементов.
2) Функциональную- разузнает функции каждого гена
3) Сравнительная- сравнивает строение и функции, сходство и отличия генов друг от друга.
4) Медицинскую-решает прикладные вопросы клинической и профилактической медицины на основе знания генома человека.
Однако, несмотря на все достижения науки, остаётся неясным вопрос о молекулярных механизмах экспрессии генов. Каким образом в нервной клетке активируются одни группы генов, в эпителиальной- другие, в мышечной- третьи с подавлением других? Активация одних и подавление других приводит к синтезу различных структурных и регуляторных белков, обуславливающие её специфическую форму, размер и функции. Изучением механизмов контроля активности генов во времени и пространстве в процессе развития занимается наука эпигенетика.Эпигенетика- это молодое направление современной науки и изучает закономерности изменения экспрессии генов или фенотипа клетки, вызванных механизмами, не затрагивающими изменение последовательности ДНК и в этом состоит её отличие от генетики. Также если, например генетические изменения(мутации) стойко передаются на протяжении всех последующих поколений, то эпигенетические изменения проявляются только в пределах 1 поколения и обратимы.
Эпигенетическая регуляция генов осуществляется на уровне ДНК, гистонов и других белков, РНК.
Всего известно на данный момент 3 механизма регуляции:
Метилирование ДНК
При этом процессе к ДНК в последовательностях СрG(цитозин фосфат и гуанин, соединенные в одной цепи)метильной группы(СН3) к цитозину. Осуществляется данный процесс благодаря ферменту ДНК-метилтрансферазе(DNMT).Я не знаю, что произошло с моим ноутбуком, но для просмотра кратинки, тыкните на черное внизу и нажмите на зеленую точку, ответственную за поворот рисунка и удерживайте её. Суть данного процесса состоит в том, что этот участок ДНК, в котором произошло метилирование оказывается навсегда молчащим и экспрессия находящихся здесь генов оказывается невозможной. Таким образом в нервных клетках, например, не соуществляется экспрессия гена, ответсвтвенного за синтез актина, миозина мышц или пищеварительных ферментов(амилаза, трипсин и др.)
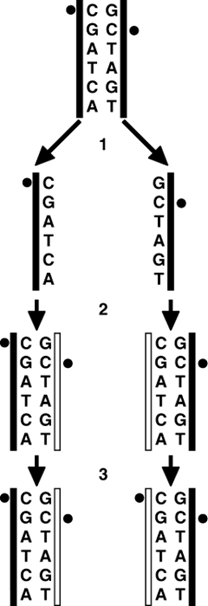
Но как передается схема метилирования ДНК от материнской клетки дочерним клеткам? Каким образом может быть сохранена модель метилирования ДНК при ее репликации?
Механизм показан на рисунке ниже. Когда половинки двойной спирали ДНК разделяются, каждая из них копируется по принципу комплементарности оснований. После разделения двойной спирали родительской ДНК на этапе 1 и репликации обеих цепочек ДНК на этапе 2 новые цепочки «проверяются» ферментом ДНК -метилтрансферазойDNMT может определить, что метиловая группа на каком-либо цитозиновом участке(СрG) одной цепочки молекулы ДНК не соответствует только что синтезированной цепочке. Тогда DNMT присоединяет метиловую группу на новую цепочку (этап 3). Это происходит только в тех случаях, когда основания Ц и Г стоят друг за другом. Благодаря этому процессу обеспечивается сохранение модели метилирования ДНК при ее репликации и делении клетки.DNMT способен определить, метилирован ли мотив CpG только на одной цепочке. Когда DNMT обнаруживает этот дисбаланс, он восстанавливает «пропущенное» метилирование на только что скопированной цепочке.
Чтобы увидеть рисунок сделайте пожалуйста то же самое.
Модификация гистоновых белков.
Давайте для начала вспомним строение нуклеосомы, состоявщая из 4 по 2 гистоновых белков Н2А, Н2В, Н3, Н4 . В итоге в коре всего 8 белков. Посмотрите на рисунок.
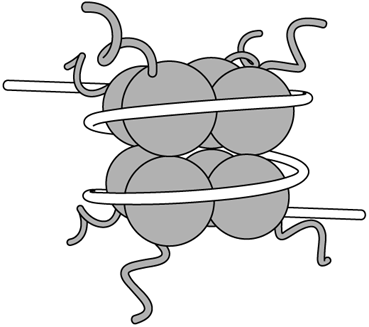
И у такого шарика имеется свободная цепочка аминокислот, называемая гистоновымотростоком.На рисунке они представлены извитыми и длинными структурами. Зачем же я о них говорю? Дело в том, что гистоновыйоктамер теперь не является только лишь молекулярными катушками, на которые могла бы наматываться ДНК. Оказалось, что гистоновые белки претерпевают в клетках химическую модификацию, и эта модификация повышает экспрессию генов, если они находятся возле специфически измененных нуклеосом. Эта гистоновая модификациябыланазванаацетилированием.Ацетилирование представляет собой присоединение химической ацетил-группы(остатка уксусной кислоты СН3СО) к гистоновому отростку.
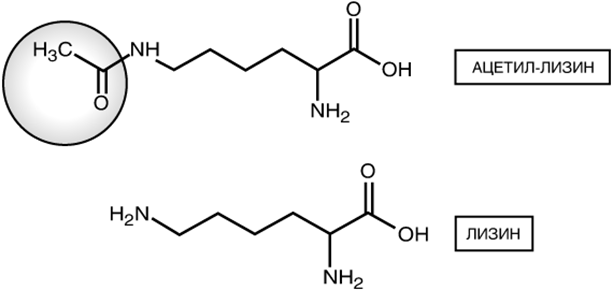
Если метилирование ДНК репрессирует гены, то ацетилирование гистонов активирует их. На сегодняшний день известно уже более 50 различных эпигенетических модификаций гистоновых белков. Все эти модификации меняют экспрессию генов, но не всегда одинаково. И в этом сложность и непредсказуемость, потому что все предсказать невозможно.
Модификация РНК
Оказалось, что не только ДНК является обладательницей регулирующих метильных модификаций; такие же модификации может нести и скопированная с ДНК матричная РНК, на которой и происходит синтез белка. Почти любая человеческая иРНК имеет от 3 до 6 метильных групп, прикреплённых к азотистому основанию аденозину. Точно так же иРНК модифицируется почти у всех млекопитающих и многих других животных. Принцип такой же, как при метилировании ДНК. По-видимому, степень модификации иРНК может определять энергетический баланс в организме и в каких-то случаях вести к ожирению.Кроме 3 видов РНК (тРНК ,рРНК, мРНК), сейчас стали известны другие виды РНК, такие как некодирующие РНК или нкРНК. Эти нкРНК встречаются по всему геному. Они продуцируются из интронов. Раньше считалось, что сплайсированные от интронов частички иРНК разрушаются клетками. Теперь же представляется более вероятным, что, по крайней мере, некоторые из них (если не большинство) в действительности обрабатываются клеткой и становятся полноправными функциональными нкРНК. нкРНКмогут как снижать, так и повышать экспрессию генов.Точный механизм, с помощью которого нашинкРНК способны влиять экспрессию генов, неизвестен. Существует также особый класс коротких (19-25 нуклеотидов) молекул РНК, не несущих какой-либо закодированной информации. Их называют микроРНК (миРНК). Они могут распознавать некоторые дефектные иРНК и связываться с частично комплементарными областями в молекуле целевой информационной РНК(дефктной) и трансляция становится невозможным, так как это уже не иРНК, а структура, похожая на ДНК.
Таким образом, одни участки нашего генома оказываются активными(проявляется экспрессивность), а вторые – молчащими.
Спасибо тебе дорогой читатель, если ты дошел до этого момента и обнаружил мою книгу весьма занимательной!!!
Дата добавления: 2018-08-06; просмотров: 1279; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
