Варианты использования АК в организме. Из АК образуются.


 белки, пептиды (все аминокислоты)
белки, пептиды (все аминокислоты)

 Phe ---à Tyr Met ---à Cys
Phe ---à Tyr Met ---à Cys
Gly ß-à Ser Ser ß-à Thr

 гормоны: окситоцин, вазопрессин, инсулин.
гормоны: окситоцин, вазопрессин, инсулин.

 глутатион (Gln,Сys,Gly)
глутатион (Gln,Сys,Gly)
 креатин (Gly, Arg, Met)
креатин (Gly, Arg, Met)
серотoнин ( Trp)

а меланин (Phe ---à Tyr)
 м
м
 и гистамин ( His )
и гистамин ( His )
н
 о адреналин, норадреналин, Т3, Т4. ( Tyr)
о адреналин, норадреналин, Т3, Т4. ( Tyr)
к
 и холин (Met)
и холин (Met)
с
 л порфирины (Gly)
л порфирины (Gly)
о
 т коферменты: кофермент A (Ala, Val, Cys); никотинамид (Trp);
т коферменты: кофермент A (Ala, Val, Cys); никотинамид (Trp);
ы фолиевая кислота (Glu)
 нуклеотиды: пурины(Gln,Gly,Asp); пиримидины(Gln, Asp).
нуклеотиды: пурины(Gln,Gly,Asp); пиримидины(Gln, Asp).
|
|
|

 сахара,полисахариды (Gly, Ala, Ser,Thr,Val,Asp,Glu,Arg,His,Pro,ОHpro)
сахара,полисахариды (Gly, Ala, Ser,Thr,Val,Asp,Glu,Arg,His,Pro,ОHpro)
 липиды ( Phe, Tyr,Leu,Lys,Trp)
липиды ( Phe, Tyr,Leu,Lys,Trp)
 мочевина( - аминогруппы: Asp, Arg, Glu, цитрулин, орнитин)
мочевина( - аминогруппы: Asp, Arg, Glu, цитрулин, орнитин)
 СО2 NH3 H2O (все аминокислоты)
СО2 NH3 H2O (все аминокислоты)
Ферменты
В нашем организме ферменты катализируют самые разнообразные реакции:
- реакции внешнего обмена (ферменты пищеварения) и внутриклеточные реакции (ферменты специфического и общего обмена)
- передачу сигнала ( аденилаткиназа )
- процесс тканевого дыхания
- мышечное сокращение (миозинкиназа, миоаденилаткиназа)
- свёртываемость крови (фибриноген, протромбиназа, ..)
+ +
- транспорт веществ (К – Nа - АТФаза )
- обезвреживание токсинов и чужеродных соединений (цитохром Р450)
- нейротрансмиссию – передачу нервного сигнала.
Часто ферменты являются объединёнными в комплексы (например, пируватдегидрогеназный). Необходимо знать, и о существовании изоферментов- ферментов, катализирующих одни и те же химические реакции в различных органах. Их появление обусловлено мутациями и естественным отбором. Изучение изоферментного состояния крови используется в медицине при диагностике, т.е. при повреждении определённых органов ферменты из них выходят в кровь, и, обнаружив в крови определённый фермент, можно сказать какой орган повреждён (см. таблицу). Также используют тот факт, что специфичным для органа является и соотношение разных ферментов и изоферментов.
|
|
|
Применение ферментов в медицине
| Основные разделы | Ферменты | Примеры использования | ||
| Диагностика | Лактатдегидрогеназа (изофермент ЛДГ-1) | Инфаркт миокарда. | ||
| Аспартатаминотрансфераза (АСТ) | Инфаркт миокарда. | |||
| Аланинаминотрансфераза (АЛТ) | Заболевания печени (например, инфекционный гепатит). | |||
| Креатинкиназа (изофермент ММ – мышечный тип, изофермент МВ – сердечный тип) | Прогрессирующая дистрофия. Инфаркт миокарда. | |||
| Кислая фосфатаза (КФ) | Рак предстательной железы. | |||
 - Амилаза - Амилаза
| Заболевания поджелудочной железы. | |||
| Лечение | Пепсин | Нарушение переваривания белков в желудке, нарушение синтеза или секреции пепсина. | ||
| Трипсин, химотрипсин | Лечение гнойных ран. | |||
| Стрептокиназа, урокиназа | Предотвращение тромбообразования при пересадке органов и других операциях. | |||
| Гиалуронидаза | Рассасывание рубцов. | |||
| Аспарагиназа | Лечение некоторых злокачественных образований. | |||
| Нуклеазы (ДНКаза) | Вирусный конъюнктивит, ринит, гнойный бронхит. | |||
| Уреаза | Удаление мочевины из организма в аппаратах «искусственная почка». | |||
| Использование ферментов в качестве аналитических реактивов
| Глюкозооксидаза | Определение концентрации глюкозы в крови. | ||
| Холестеролоксидаза | Определение холестерина в крови. | |||
| Липаза | Определение триацилглицеринов в крови. | |||
| Уреаза | Определение мочевины в крови. |
 Снижение * стереохимич. специфичность - катализ только определённого
Снижение * стереохимич. специфичность - катализ только определённого
специфичности стереоизомера (например, D-, L-АК).
действия * абсолютная субстратная - катализ только одного субстрата ( уреаза
фермента. ферментирует только мочевину).
* абсолютная групповая - катализ определённого класса веществ (алкогольдегидрогеназа)
|
|
|
* относит. групповая каталитич. действия на опред. связи в молекулах (липазы, протеазы)
* относится субстратн. – катализ субстратов, принадлежащих к
разным группам химических соединений (цитохром Р450)
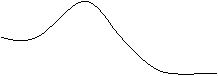
По константе Михаэлиса (Км) определяют сродство фермента к субстрату, чем меньше её значение, тем больше сродство Е к S.
Скорость ферментативной реакции максимальна при полном насыщении активных центров фермента субстратом.
Км. – это такое количество субстрата, при котором достигается половина максимальной скорости реакции.
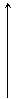
 U U
U U



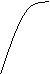
___ _
| |

 | |
| |
Км1 [S] Км2 [S]
Км2 < Км1 => второй график показывает большее сродство фермента к S , т.е. при меньшей концентрации S наблюдаем ту же скорость.
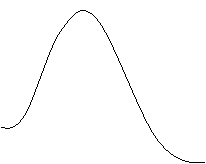
Е1 – энергия активации реакции без фермента
 Е2 – энергия активации ферментативной реакции.
Е2 – энергия активации ферментативной реакции.
Любая реакция протекает только потому,
 Е1 что выделяется энергия (энергия Гиббса G ), но во
Е1 что выделяется энергия (энергия Гиббса G ), но во
многих реакциях, для того, чтобы молекулы.
 провзаимодействовали, нужно преодолеть барьер,
провзаимодействовали, нужно преодолеть барьер,
Е2 добавить Е извне. Использование фермента
 понижает энергетический барьер активации.
понижает энергетический барьер активации.
 G энергия активации - Е, необходимая для
G энергия активации - Е, необходимая для
 активное состояние при данной температуре.
активное состояние при данной температуре.

| Класс | Реакции | Основные подклассы, группы |
| Оксидоредуктазы | Окислительно-восстановительные реакции А +В àА +В восст окис окис восст | Дегидрогеназы, оксидазы, редуктазы, гидроксилазы. |
| Трансферазы | Перенос групп А – В + С à А + В - С | Киназы (фосфатные группы), трансаминазы (аминогруппы). |
| Гидролазы | Гидролиз связей (эфирных, пептидных, гликозидных, связей С-С, P-N) А – В + Н2О à А – Н + В - ОН | Эстеразы, фосфатазы, протеазы, липазы, нуклеазы, тиолазы. |
| Лиазы | Разрыв связей С-С, С-О, С- N, С-S путём элиминирования молекулы с образованием двойных связей. В обратной реакции ускоряют присоединение воды, аммиака и т.д. по двойной связи А (ХН) - В à А – Х + В - Н | Альдегидлиазы (альдолаза), углерод- кислородлиазы (фумараза), дегидратазы (енолаза), декарбоксилазы. |
| Изомеразы | Взаимопревращение изомеров А ßà Изо - А | Изомеразы, мутазы. |
| Лигазы | Соединение 2 молекул, сопряжённое с гидролизом АТР А + В + АТР à А – В + АDР + Рi | Карбоксилазы, синтетазы. |
Дата добавления: 2018-08-06; просмотров: 147; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
