Внутриклеточные превращения аминокислот. Декарбоксилирования аминокислот: значение процесса. Роль биогенных аминов и их инактивации.
Аминокислоты в клетке составляют динамичный пул, который непрерывно пополняется и так же непрерывно расходуется.
Существуют три источника аминокислот для пополнения этого пула – поступлениеиз крови, распадсобственных внутриклеточных белков и синтез заменимых аминокислот.
Путь дальнейшего превращения каждой аминокислоты зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
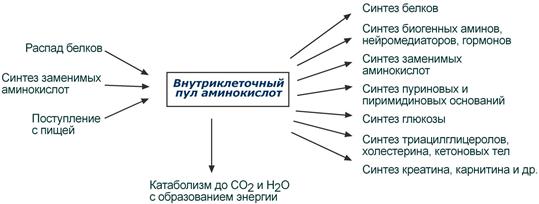
Возможные пути превращений аминокислот
Реакции превращения аминокислот в клетке условно можно разделить на три части, в зависимости от реагирующей группы:
· с участием аминогруппы - здесь подразумевается удаление от аминокислоты аминогруппы тем или иным способом, в результате чего остается углеводородный скелет,
· по боковой цепи (радикалу) - происходит использование углеродного скелета для синтеза глюкозы, жиров, или для образованеия энергии АТФ,
· по карбоксильной группе - связано с отщеплением карбоксильной группы.
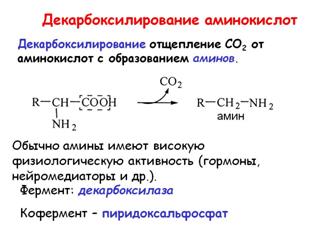 БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕКАРБОКСИЛИРОВАНИЯ АМИНОКИСЛОТ
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ДЕКАРБОКСИЛИРОВАНИЯ АМИНОКИСЛОТ
1. Реакции необратимы - приводят к необратимому распаду аминокислот.
2. Образуется значительное количество СО2 - конечного продукта метаболизма, который выводится из организма.
3. Образуются амины, которые обладают высокой биологической активностью. Поэтому такие амины называют биологически активными или биогенными аминами. Они являются медиаторами, с помощью которых сигнал передается от одной клетки к другой и от одной молекулы к другой
|
|
|
Биогенные амины – органические соединения, которые образуются в результате декарбоксилирования аминокислот или их производных и имеют выраженную биологическую активность. В образовании биогенных аминов участвуют ферменты декарбоксилазы, коферментом которых служит пиридоксальфосфат.
Биогенные амины являются биологически активными веществами, которые выполнят функцию нейромедиаторов, гормонов, регуляторов местного действия. (гистамин, серотонин, Гамма-аминомасляная кислота, Дофамин)
Значение механизмов их инактивации:
1. окисление ферментами моноаминооксидазами (МАО) (кофермент ФАД). Таким путем чаще всего инактивируются дофамин, норадреналин, серотонин и ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками.
2. метилирование с участием S-аденозилметионина. Таким путем чаще всего инактивируются катехоламины – фермент катехол-орто-метилтрансфераза (КОМТ)
3. окисление с помощью диаминооксидаз – инактивация гистамина, а также короткоцепочечных алифатических диаминов (путресцина и кадаверина).
|
|
|
Общее и «местное» обезвреживание аммиака: биологическая роль, органная и внутриклеточная локализация. Орнитиновый цикл (уметь писать реакции): биологическая роль процесса.
Так как аммиак является чрезвычайно токсичным соединением, то в тканях (!) существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата:
· синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратнареакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
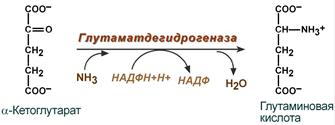
Реакция синтеза глутаминовой кислоты
· синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
|
|
|
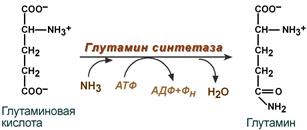
Реакция синтеза глутамина
Образование большого количества глутамина обеспечивает высокие концентрации его в крови (0,5-0,7 ммоль/л).
Так как глутамин проникает через клеточные мембраны путем облегченной диффузии, то он легко попадает не только в гепатоциты, но и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового кольца и гуанозинмонофосфата (ГМФ), синтеза цитидинтрифосфата (ЦТФ), аспарагина, глюкозамино-6-фосфата (предшественник всех остальных аминосахаров).
· синтез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи,
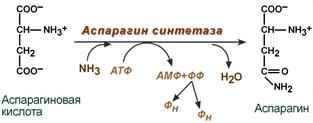
Реакция синтеза аспарагина
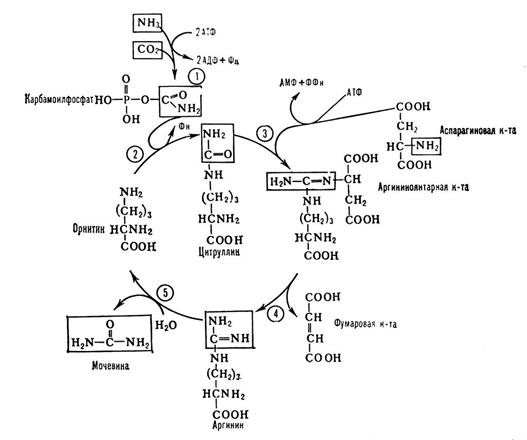
· синтез карбамоилфосфата, происходит в митохондриях печени. Реакция является первой в процессе синтеза мочевины - молекулы, в составе которой аммиак удаляется из организма.
Биологический смысл орнитинового цикла Подавляющая часть азота поступает в организм в составе белков. В процессе метаболизма аминокислоты разрушаются, образуется аммиак как конечный продукт обменных процессов. Орнитиновый цикл – это несколько последовательных реакций, главная задача которых состоит в детоксикации NH3 с помощью его перевода в мочевину. Мочевина, в свою очередь, поступает в нефрон почки и выводится из организма с мочой. Кроме того, побочно орнитиновый цикл является источником аргинина – одной из незаменимых аминокислот. Нарушения в синтезе мочевины может привести к такому заболеванию, как гипераммониемия. Эта патология характеризуется повышенной концентрацией ионов аммония NH4+ в крови человека. Эти ионы отрицательно сказываются на жизнедеятельности организма, выключая или замедляя некоторые важные процессы. Игнорирование этого заболевания может привести к летальному исходу.
|
|
|
Дата добавления: 2018-08-06; просмотров: 1939; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
