Показатели агрессивности подземных вод
Nbsp; МИНИСТЕРСТВО ОБРОЗОВАНИЯ И НАУКИ ДНР ДОНЕЦКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Кафедра Геологии
КОНТРОЛЬНАЯ РАБОТА
По дисциплине
ГИДРОГЕОЛОГИЯ
Вариант№1
Студента группы РПМзс-17
Слинько А.С.
Зачетная книжка № 5831
Сдано:
Проверено:
г. Донецк. 2018
Часть І. Основы гидрогеологии
Обработка результатов химического анализа подземных вод
Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм3, мг/дм3, а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
Таблица 1
| Ионы | Содержание, мг/дм3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na+ Ca2+ Mg2+ | 93 194 45 | 4.0455 9.6806 3.6999 | 23,8 55.1 21.1 |
| Сумма катионов | - | 17.426 | 100 |
| Cl- SO42- HCO3- | 24 76 930 | 0.6768 1.5808 15.252 | 3,5 9,5 87,0 |
| Сумма анионов | - | 17.5096 | 100 |
| М (сухой остаток) | 960 | - | - |
| СО2(свободный) | 160 | - | - |
| рН водородный показатель | 7.3 | - | - |
| Т воды, градусС | 12 | - | - |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
|
|
|
Таблица 2
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na+ Ca2+ Mg2+ | 0,0435 0,0499 0,08222 | Cl- SO42- HCO3- | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
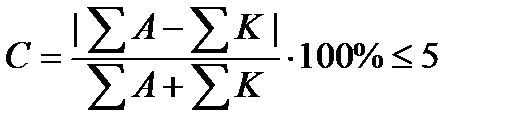
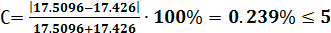
В нашем случаеС = 0.239%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
|
|
|
Слева от дроби указывается содержание газов в мг/дм3 и минерализация (М) в г/дм3, за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м3/сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова по данным таблицы 1:
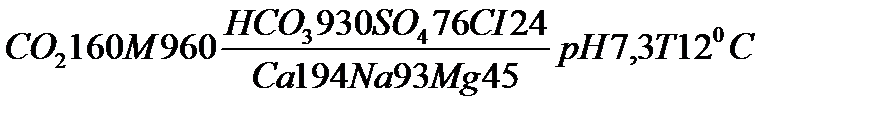
3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы –магнием, натрием и кальцием. В нашем случае вода гидрокарбонатно-кальцевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
|
|
|
Таблица 3
| Минерализация М, г/дм3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 0.96 г/дм3 . Вода пресная.
5) Реакция воды по рН.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
Таблица 4
| Водородный показатель рН при Т22оС | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 7,3. Вода нейтральная.
6) Классификация подземных вод по температуре воды.
|
|
|
Классификация воды по температуре приведена в таблице 5.
Таблица 5
| Температура, ТоС | Наименование |
| <0 >0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100оС называются термальными.
В нашем случае Т12оС. Вода холодная.
7) Жесткость воды.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм3).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
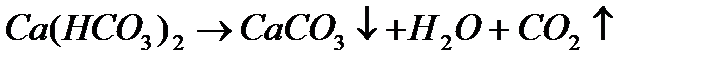
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3- в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной (устранимой), постоянная жесткость отсутствует.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
Таблица 6
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 13.37ммоль, устранимая (карбонатная) –15.25ммоль, вся жесткость считается устранимой. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl- и SO2-4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
Таблица 7
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм3
Общая жесткость ОЖ, ммоль
 , мг/дм3 , мг/дм3
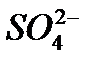 , мг/дм3
рН , мг/дм3
рН
| 1000 7 350 500 6,5-8,5 | 960 13.37 24 76 7,3 | пригодна Не пригодна пригодна пригодна пригодна |
В нашем случае вода не пригодна для водоснабжения. Нужно иметь ввиду, что если вода не пригодна хотя бы по одному из показателей, использовать её для питьевого водоснабжения нельзя.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
Таблица 8
| Минерализация, г/дм3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 0.96 г/дм3. Вода для орошения пригодна.
10) Агрессивность подземных вод.
Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП
2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП).
Показатели агрессивности подземных вод
Таблица 9
Дата добавления: 2018-08-06; просмотров: 400; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
