Первая помощь при отравлении четыреххлористым углеродом
Первая помощь оказывается согласно общим принципам помощи при отравлениях органическими растворителями. При остром ингаляционном отравлении - свежий воздух, покой, длительное вдыхание кислорода, сердечные средства. При резком ослаблении (остановке) дыхания - искусственное дыхание. При приеме яда внутрь - тщательное промывание желудка. В тяжелых случаях необходима немедленная госпитализация в реанимационный центр. [14]
Объекты химико-токсикологического анализа при отравлениях четыреххлористым углеродом
Объектами ХТА являются:
· кровь,моча
· желудок с содержимым
· головной мозг
· сальник
· легкие
· печень, почки [10]
Получение
Четыреххлористый углерод (тетрахлорметан) был впервые получен Дюма в 1840 г. (из метана и хлора) и Рэйнольтом (из метилхлорида и хлора). Позднее четыреххлористый углерод начали получать хлорированием сероуглерода при 105-130°C. Этот метод стал рентабельным после того, как были найдены оптимальные усkовия взаимодействия S2C12 и CS2 в присутствии железа :
 [5]
[5]
В промышленности тетрахлорметан производят хлорированием, например, метана или хлорметана, нагревая смесь хлора и второго вещества до температуры 400—500 °C. При этой температуре происходит серия химических реакций, постепенно превращающих метан или метилхлорид в соединения с большим содержанием хлора.{\displaystyle {\mathsf {CH_{4}+Cl_{2}\rightarrow CH_{3}Cl+HCl}}}
CH4 + Cl2 →CH3Cl + HCl
|
|
|
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 +Cl2 →CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
Результатом процесса является смесь, состоящая из метилхлорида, дихлорметана, хлороформа и тетрахлорметана. Разделение веществ осуществляется дистилляцией.[2]
Известен метод высокотемпературного хлорировнакаливанием смеси угля и СаСl2 при температуре вольтовой дугиания метана в избытке хлора при 450— 700 °C. Прямой синтез четыреххлористого углерода из составляющих его элементов технически еще невозможен.[5]
Так же можно получать четыреххлористый углерод накаливанием смеси угля и СаСl2 при температуре вольтовой дуги.[6]
Изолирование
Изолирование хлорпроизводных соединений в химико-токсикологическом анализе проводят методом дистилляции (перегонкой с водяным паром). На исследования могут быть взяты объекты биологического происхождения (внутренние органы трупов, рвотные массы, пищевые продукты и т.п.) или небиологического происхождения (технические жидкости, лекарственные формы и т.п.).
Прибор для дистилляции с водяным паром. Он состоит из четырех частей: парообразователя, круглодонной колбы, холодильника и приемника . 
Рис. 1. Установка для изолирования летучих ядов перегонкой с водяным паром.
|
|
|
1 - парообразователь; 2 – колба с объектом исследования; 3 - холодильник; 4 – приемник дистиллята.
Парообразователь представляет собой сосуд с отводной боковой трубкой, которая служит для соединения его с колбой. Для уравновешивания давления в горлышко парообразователя вставляется длинная стеклянная трубка (~1 м), доходящая почти до дна цилиндра. Парообразователь заполняют водой на 1/3 – 1/4 объема. О количестве введенной в него воды судят по водомерной трубке. Биологический материал смешивают с дистиллированной водой до густоты кашицы и помещают в круглодонную колбу с таким расчетом, чтобы колба была заполнена не более чем на 1/3 ее объема. Колбу с объектом закрепляют в штативе, глубоко погружают в холодную водяную баню и закрывают пробкой так, чтобы конец стеклянной трубки, вводящей пар, доходил почти до дна колбы. Когда прибор подготовлен, парообразователь нагревают. После того как в парообразователе пойдет пар, объект подкисляют виннокаменной или щавелевой кислотой до pH=2. После этого соединяют все части прибора и доводят водяную баню до кипения, чтобы уменьшить конденсацию водяного пара в колбе. Дистилляция производится по возможности медленно, так, чтобы можно было считать капли в приемнике. Это достигается регулированием нагревания парообразователя. В зависимости от исследуемого токсиканта приёмник должен быть охлажден. После окончания дистилляции сначала отсоединяют от парообразователя колбу с биоматериалом, потом прекращают нагревать парообразователь и водяную баню. В процессе исследования дистилляты хранят в закрытых пробками колбах. [9]
|
|
|
Качественный анализ
Качественное обнаружение четыреххлористого углерода основано на тех же реакциях, что и обнаружение хлороформа и хлоралгидрата: реакции отщепления хлора, реакции образования изонитрила, получение розового окрашивания с резорцином в щелочной среде. Однако в отличие от хлороформа и хлоралгидрата четыреххлористый углерод не дает реакции с реактивом Фелинга, т.к. в процессе нагревания с раствором щелочи не образуется веществ, обладающих восстановительными свойствами. Заключение о наличии четыреххлористого углерода в дистилляте делают при положительном результате реакций 1-3 и отсутствии результата реакции с реактивом Фелинга.
1. Реакция отщепления хлора. Эта реакция является общей реакцией на галогенпроизводные.
К 1-2 мл исследуемого раствора прибавляют 1 мл 10 % спиртового раствора едкого натра и осторожно нагревают в пламени горелки в течение 2 – 3 минут. После охлаждения раствор подкисляют по лакмусу 10 % раствором азотной кислоты и смешивают с 0,5 мл 10 % раствора нитрата серебра. Образование мути или осадка говорит о наличии галогенпроизводных и необходимости проведения других реакций их обнаружения. Реакция не специфична.
|
|
|

2. Реакция образования изонитрила.
В случае отсутствия осадка или мути в реакции №1, учитывая ее сравнительно невысокую чувствительность, нужно проделать реакцию получения изонитрила.
К 1 мл исследуемого раствора прибавляют 10 капель 10 % спиртового раствора едкого натра и одну каплю водного раствора анилина. Пробирку с раствором осторожно нагревают в течение 1- 2 минут. Об образовании изонитрила узнают по появлению характерного запаха. Отрицательный результат этой сравнительно чувствительной реакции (0,01 мг) позволяет судить о не нахождении в исследуемом объекте этих веществ. При положительном результате проводят другие реакции. Реакция не специфична, ее дают все хлорпроизводные, за исключением дихлорэтана.

3. Реакция с резорцином в щелочной среде.
К 1 мл исследуемого раствора добавляют 1 мл 1 % свежеприготовленного раствора резорцина в 10 % водном растворе едкого натра. Параллельно в другой пробирке смешивают 1 мл дистиллированной воды и 1 мл реактива. Пробирки помещают в кипящую водяную баню на 5 – 10 минут. При наличии четырёххлористого углерода возникает розовое или малиново-красное окрашивание. В параллельном опыте розового окрашивания наблюдаться не должно.

4. Реакция Фудживара.
При нагревании СCl4 с пиридином в присутствии щелочи появляется красная окраска.[9]
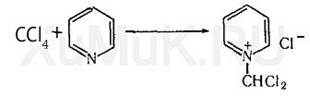

5. Реакция с 2,7-диоксинафталином.
Каплю исследуемой жидкости вносят в пробирку, прибавляют 2 мл циклогексанола, крупинку гидроксида натрия и несколько кристалликов 2,7-диоксинафталина. Смесь нагревают до кипения и продолжают нагревание в течение 45—60секунд. Затем раствор сливают с нерастворившегося гидроксида натрия, охлаждают, прибавляют к нему 2 мл ледяной уксусной кислоты и 4 мл этилового спирта, затем взбалтывают. При наличии ССl4 появляется светло-бурая окраска, переходящая в зелено-желтую.[10]
6. Реакция с реактивом Фелинга.
2 мл исследуемого раствора смешивают с 2 мл 10 % раствора едкого натра и 5 каплями реактива Фелинга (раствор сульфата 10 меди в присутствии сеньетовой соли). Смесь в пробирке осторожно нагревают.
В отличие от хлороформа и хлоралгидрата четыреххлористый углерод не обладает способностью восстанавливать Сu(ОН)2 в Сu2(ОН)2 и Сu2О, так как при кипячении его с едким натром не образуются вещества, обладающие восстановительным свойством.
 [9]
[9]
11. Количественное определение хлорпроизводных
Для обнаружения и количественного определения четыреххлористого углерода в крови и моче, а также в тканях мышцы, внутренних органов и дистиллятах применяют метод агрентометрического титрования и метод газожидкостной хроматографии.
Метод аргентометрического титрования. Навеску исследуемого материала подкисляют винной или щавелевой кислотой и подвергают перегонке с водяным паром. Перегонку заканчивают, когда капля дистиллята не дает изонитрильной пробы. Далее проводят отщепление хлора в специальном приборе. Отбирают 5 мл дистиллята, переносят его в коническую колбу 100 мл, прибавляют 10 мл 10 % спиртового раствора NaOH и осторожно нагревают на водяной бане в течение одного часа с обратным холодильником. После охлаждения раствор подкисляют по лакмусу 10 % раствором азотной кислоты до кислой реакции. Затем титруют образовавшийся хлорид натрия 0,1 н раствором нитрата серебра, используя в качестве индикатора 5% раствор хромата калия, до розового цвета. В другую такую же колбу наливают дистиллированную воду в таком же объеме, в каком был взят дистиллят для титрования, прибавляют такие же реактивов и титруют 0,1 н раствором нитрата серебра (холостой опыт). Содержание хлорпроизводных (х) в % вычисляют по формуле:
Х = (V1-V2)·K·T·100%/(Vд),
где V1 – объем раствора нитрата серебра, израсходованного при первом титровании, мл, V2 - объем раствора нитрата серебра, израсходованного при втором титровании (холостой опыт), мл, К – поправочный коэффициент для приведения концентрации раствора нитрата серебра к точно 0,1 н, Т – титр раствора нитрата серебра по определяющему веществу, г/мл, Vд – объем аликвотной части дистиллята, взятого для титрования, мл.[9]
Метод газожидкостной хроматографии. В пенициллиновый флакон вносят 0,5 мл 0,2% раствора н-пропанола, 5 г измельченного биологического материала или 2 мл крови (мочи). Флакон закрывают резиновой пробкой, обкатывают алюминиевым колпачком и нагревают на водяной бане 10 мин при температуре 80С. Медицинским шприцем отбирают 2 мл парогазовой фазы и вводят в хроматограф. Идентификацию веществ проводят относительно времени удерживания н-пропанола, который является внутренним стандартом.[10]
Хранение
Четыреххлористый углерод хранят в стационарных резервуарах, в герметично закрытых стальных бочках — в хорошо вентилируемых неотапливаемых складских помещениях или под навесом, защищающим от воздействия солнечных лучей и влаги.
Заключение
Четырёххлористый углерод (тетрахлорметан) CCl4– это яд, обладающий наркотическим действием, способен привести к непоправимым изменениям в здоровье, как при длительном контакте, так и при кратковременном, поэтому следует осторожно работать с ним, а лучше не использовать его.
Изолирование хлорпроизводных соединений в химико-токсикологическом анализе проводят методом дистилляции (перегонкой с водяным паром). На исследования могут быть взяты объекты биологического происхождения : кровь, моча, желудок с содержимым, головной мозг, сальник, легкие, печень, почки.
Обнаружить четыреххлористый углерод можно с помощью качественных реакций, таких как: реакция Фудживара, реакция с резорцином в щелочной среде, реакция отщепления хлора, реакция образования изонитрила и т.д.
Количественное определение хлорпроизводных методом аргентометрического титрования и методом газожидкостной хроматографии.
Вещество отнесено ко второму (из пяти) классу опасности и обладает острым токсическим действием. В организм четыреххлористый углерод проникает через органы дыхания и кожу, оказывая наркотическое действие на центральную нервную систему, слабо раздражающее - на кожу, токсическое - на печень, почки и другие органы.
Продуктами метаболизма являются хлороформ, фосген, углекислый газ и соляная кислота.
Список литературы
1. Четырёххлористый углерод./ Электронный ресурс – Режим доступа: http://03-ektb.ru/emainmenu-2/history-smp1/velikie-lekarstva/7504-chetyrekhkhloristyj-uglerod
2. Википедия.Тетрахлорметан./ Электронный ресурс – Режим доступа: https://ru.wikipedia.org/wiki/Тетрахлорметан
3. Четырёххлористый углерод./ Электронный ресурс – Режим доступа: http://www.water.ru/bz/param/carbon_tetrachloride.php
4. Энциклопедии, словари, справочники. Отечественные ветеринарные препараты. Четырехлористый углерод./ Электронный ресурс.-Режим доступа: http://www.cnshb.ru/AKDiL/0031/base/R4/001209.shtm
5. Андреас Ф., Гребе К. Химия и технология пропилена — Л.: «Химия», 1973. — 368 c. [202 c.]
6. Отравление четыреххлористым углеродом./ Электронный ресурс – Режим доступа: http://www.fptl.ru/otravlenija/tetrahlormetan.html
7. Способ очистки четыреххлористого углерода. / Электронный ресурс – Режим доступа: http://www.findpatent.ru/patent/232/2323922.html
8. Четыреххлористый углерод./ Электронный ресурс – Режим доступа: http://orgchemlab.com/boiling-points-of-main-solvents/carbon-tetrachloride.html
9. Химико-токсикологический анализ на группу веществ, изолируемых дистилляцией (хлорпроизводные, карбонильные соединения): Учебно–методическое пособие для студентов 5 курса фармацевтического факультета. / С.А. Гаврилова, Л.Н. Карякина, Н.Б. Мельникова, Т.В. Саликова - Нижний Новгород : изд-во Нижегородской государственной медицинской академии, 2009. – 32 с.
10. Алкилгалогениды./ Электронный ресурс – Режим доступа: https://studfiles.net/preview/1659352/
11. Токсикологическая химия : Учебник для вузов / Под ред. Т.В. Плетеневой. - 2-е изд., испр. - М. : ГЭОТАР-Медиа, 2008. – [512 c.]
12. Токсикологическая химия : учебник / Т. Х. Вергейчик ; под ред. проф. Е. Н. Вергейчика. – 3-еизд., перераб. и доп. – М. :МЕДпресс-информ,2012. – [432 с.]
13. Токсикологическая химия. Метаболизм и анализ токсикантов: учеб. для вузов/ под ред. Н. И. Калетиной. - М: ГЭОТАР – Медиа, 2008. –[1016 с.]
14. Четыреххлористый углерод (тетрахлорметан). Справка. / Электронный ресурс – Режим доступа : https://ria.ru/spravka/20120321/601995852.html
Дата добавления: 2018-08-06; просмотров: 1119; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
