Металдар коррозиясы (жемірілуі)
Электролиз
Электролиттерді ІІ-ретті өткізгіштер деп атайды, ондағы ток тасымалдаушылар-иондар. Электролит ерітінділерінен ток өткенде электр энергиясы химиялық энергияға айналып, электродтар беттерінде тотығу-тотықсыздану үдерістері жүреді, осы құбылысты электролиз деп атайды.
Катодта (теріс полюсі) тотықсыздану, анодта (оң полюсі) тотығу үдерісі жүреді. Электрод бетінде жүретін үдеріс мынадай факторларға тәуелді:
- зат табиғатына,
- зат концентрациясына,
- электрод материалына,
- электролиз жүретін ортаға (рН),
- температураға,
-ток тығыздығына.
Электролиз кезінде гальвани элементіндегідей химиялық белсенді және инертті электродтар қолданылады. Химиялық белсенді ерімтал анод осы үдеріс кезінде иондарын ерітіндіге беріп ериді, ал инерттілері – электронды тасымалдаушының ролін атқарады да химиялық өзгеріске ұшырамайды. Инертті анод ретінде графит және платина қолданылады.
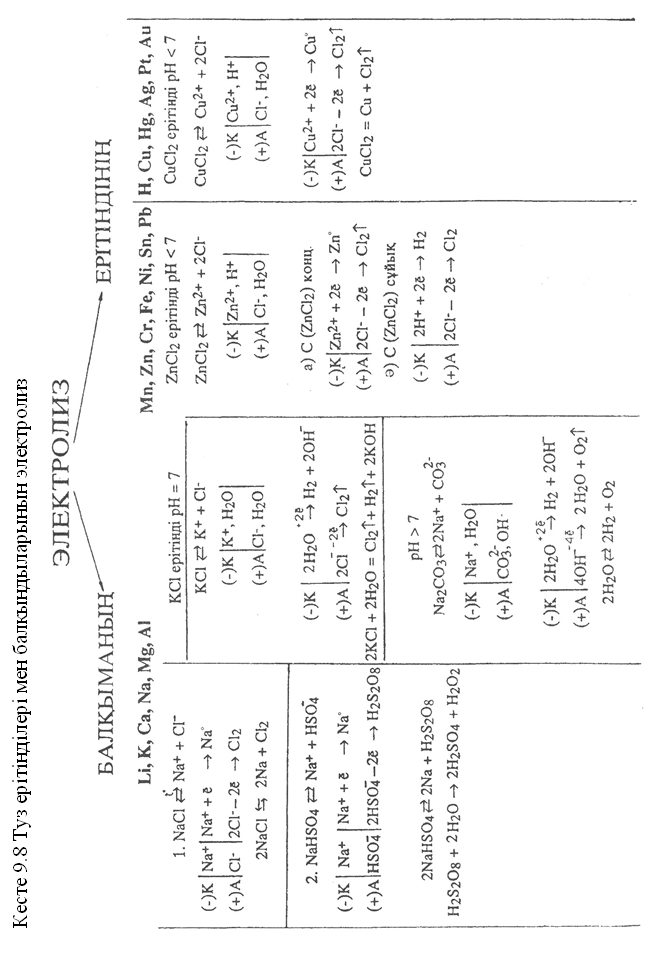
Электролиз балқындысының электролизі кезінде электродтар маңында конкурент (бәсекелес) бөлшектер (иондар, молекулалар) болмағандықтан катион – катодта, анион – анодта «зарядсызданады». Тұздардың балқындыларын электролиздеу арқылы химиялық белсенді металдар (сілтілік, сілтілік-жер) мен химиялық белсенді бейметалдарды (фтор) алуға болады. Ал, тұздардың ерітіндісін электролиздеу кезінде электрод төңірегінде тұз иондарына су молекулалары және су иондары бәсекелестік етеді. Сондықтан катодтық және анодтық үдерістердің кейбір заңдылықтарын қарастырайық.
|
|
|
| Кесте 9.7 Иондардың электродтарда зарядсыздану ретін анықтау |   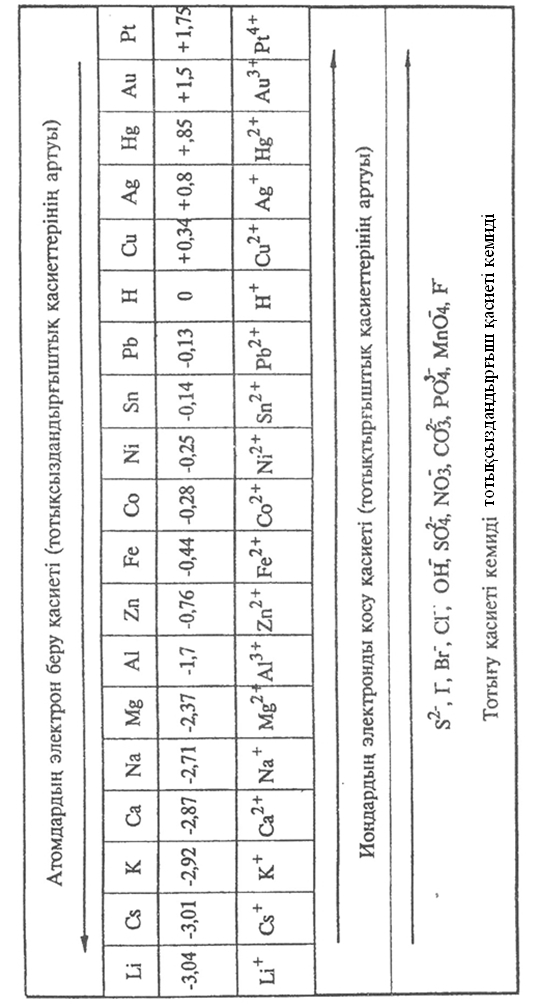
|
Катодтық үдеріс
Металл атомы неғұрлым жақсы тотықсыздандырғыш болса, ионы соғұрлым әлсіз тотықтырғыш болады. Катодқа тартылатын оң заряд иондар – тотықтырғыштар. Сондықтан металдың электркернеу қатарын иондардың тотықсыздану ретіне қарай шартты түрде үшке бөлуге болады:
1) катиондардың бірінші тобына электркернеу қатарында сутектен кейінгі металл иондары жатады, олар сутек иондарынан бұрын тотықсызданады;
2) катиондардың екінші тобына электркернеу қатарында марганец пен қорғасынға дейінгі металдарды жатқызуға болады, олар су молекулалары және сутек иондарымен қатар тотықсызданады, металдың ток бойынша шығымы аз;
|
|
|
3) катиондардың үшінші бөліміне металдардың электркернеу қатарының басынан алюминийге дейінгі химиялық белсенді металл иондары жатады. Бұл иондар тұздарының ерітіндісін электролиздеген кезде еш өзгеріссіз қалады, оның есесіне су тотықсызданады.
Анодтық үдерістер
Анодта жүретін тотығу үдерісінің иондардың тотықсыздандырғыш қасиетіне байланысты болуына сәйкес аниондарды шартты түрде екіге бөлуге болады:
1. Оттексіз қышқыл қалдық аниондарды су иондары мен молекуласынан электрондарын оңай береді, ал галоген иондарын өзара салыстырсық тотығу мына ретпен жүреді: J-, Br-, Cl-; Иод ионының тотықсыздандырғыш қасиетінің жоғары болуы осы қатарда иодқа қарай радиус артады да, оның электронды ұстап тұру қабілеті азаяды, сондықтан ол тезірек зарядсызданады. Осы галогендер қатарын бастайтын фтор ионының тотығуы өте қиын жүреді ( 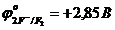 ), сондықтан ол оттекті қышқыл қалдық иондарынан да кейін ерітіндіде өзгеріссіз қалып қояды. Оның себебі ол элементтер ішіндегі ең электртерістілігі басымы, сондықтан ол өзіне қосқан электроннан қиын айырылады (тотығады).
), сондықтан ол оттекті қышқыл қалдық иондарынан да кейін ерітіндіде өзгеріссіз қалып қояды. Оның себебі ол элементтер ішіндегі ең электртерістілігі басымы, сондықтан ол өзіне қосқан электроннан қиын айырылады (тотығады).
|
|
|
2. Оттекті қышқыл қалдық аниондарды су молекуласы анод бетіне қатар келгенде су молекуласы алдымен тотығады.
Кесте 98 –де әртүрлі тұздардың ерітінділері мен балқындыларының электролизденуінің сұлбасы (жоғарыда көрсетілген заңдылықтардың негізінде) берілген.
Ерімтал анодты пайдаланып жүргізілетін электролиз мысалы ретінде мысты рафинациялауды қарастыруға болады.
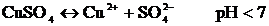
| 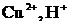
| 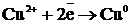
|
| 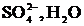
| 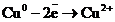
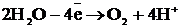
|
96520 К заряд өткенде
Сонда «қара» (черновая) мыстан жасалған электрод оның бетіндегі SO4-2 ионына қарағанда электрондарын оңайырақ беріп тотығады, яғни ериді. Пайда болған мыс иондары катодқа барып тотықсызданады.
Сонда, құрамында қоспасы бар анод еріп, таза мыс катод бетін қаптайды да, әр түрлі қоспа анодтық шлам ретінде немесе ерітіндіде қалып қояды.
Электролиз заңдары (М. Фарадей)
І-заңы. Электродтарда бөлінетін зат массасы заряд шамасына тура пропорционал:
|
|
|
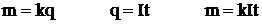 (9.9)
(9.9)
ІІ-заңы. Электродтан өтетін заряд эквивалентті мөлшерде заттар түзеді (96500 кулон заряд 1 эквивалент зат түзеді):
F = 96485 Кл≈96500Кл, F – Фарадей саны F =26,8 А  сағат
сағат
Электрохимиялық эквивалент (К) деп 1 кулон заряд өткенде электродтарда түзілетін зат массасын айтады.
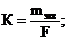 (9.10)
(9.10)
mэ = M ∙ fэкв (9.11)
m =  (9.12)
(9.12)






Металдар коррозиясы (жемірілуі)
Қоршаған орта әсерінен заттардың (металдардың) бүлінуін олардың коррозиясы деп атайды. Біздің қарастыратынымыз металдар коррозиясы, ол халық шаруашылығына үлкен зиян әкеледі.Әлемде өндіретін барлық металдың 18%-ы коррозиядан бүлінген металдан жасалған қондырғыларды қалпына келтіруге жұмсалатын көрінеді. Металдар коррозиясының негізгі себебі олардың типтік тотықсыздандырғыш болуына байланысты иондарға айналуы. Қоршаған ортадағы оттегі, су тағы да басқа өндірістік газдар - CI2, SO2 әсерінен металдардың беттік қабатының бұзылуы.
Коррозияның екі түрі белгілі: химиялық және электрохимиялық.
Химиялық коррозия – металдардың ток өткізбейтін ортада химиялық заттар әсеріне түсуі. Оған металдардың ауадағы оттегі (газдық коррозия), төмен температурада органикалық еріткіштер және мұнай әсерінен бүлінуі.
Электрохимиялық коррозия - металдардың электролит ерітінділерінде өзгеріске ұшырауы. Коррозияның бұл түрі металдан жасалған қондырғылардың (конструкциялардың) электролитке батырылып тұруы шарт емес, ол ауадағы су буында еріген газдар химиялық әрекеттесу нәтижесінде түзілетін электролит әсерінен де болады.
Химиялық және электрохимиялық коррозия бір-бірінен осы үдерістің жүру барысы және оның нәтижесінде түзілетін заттары бойынша да ажыратылады.
Электрохимиялық коррозия микрогальваножұптарының жұмысы арқылы түсіндіріледі.
Кез келген металдан жасалған бұйым тек бір металдан жасалмайды, аз-да болса басқа металл қоспасы болады. Міне, осы металдардың электродтық потенциалдарында айырым болса, гальвани элементі жұмыс істей бастайды. Электрохимиялық кернеу қатарындағы мыс ( 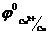 = 0,34В) та, күміс те
= 0,34В) та, күміс те
( 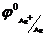 =+0,8B) қышқыл құрамынан сутегі газын ығыстырып шығара алмайтыны белгілі. Егер де осы екі металдарды өткізгішпен байланыстырып, қышқыл ерітіндісіне салса мыс еріп, күміс бетінде сутегі бөліне бастайды, оның себебі төмендегі гальвано-жұптың жұмыс істеуінен болады:
=+0,8B) қышқыл құрамынан сутегі газын ығыстырып шығара алмайтыны белгілі. Егер де осы екі металдарды өткізгішпен байланыстырып, қышқыл ерітіндісіне салса мыс еріп, күміс бетінде сутегі бөліне бастайды, оның себебі төмендегі гальвано-жұптың жұмыс істеуінен болады:
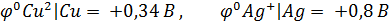
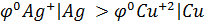
Сондықтан мыс-анод, күміс – катод болады.
А (-) Cu │HхR│Ag (+) K
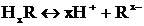
Cu0– 2e → Cu2+│ Cu0 – т-с-ш - т-ғу
Ag│2H+ + 2e → H2 │ H+ - т-т-ш-т-с-у
Олай болса, коррозияға металдардың «тазалығы» тотықсыздандырғыштық қасиеті, тотықтырғыш концентрациясы, температура, электролиттің сутектік көрсеткіштерінің мәндері, теңіз суларындағы флора мен фауна да әсер етеді.
Енді коррозиядан қорғау әдістеріне тоқталайық, олар:
1. Қоршаған ортадағы тотықтырғыштардың әсерін азайту.
Осыны жүзеге асыру үшін:
а) ингибиторлар (тежегіштер) қосу;
ә) ортадағы тотықтырғыш концентрациясын кеміту.
2. Қоршаған ортадан бөлу:
а) металл бетін (оксидтік, фосфаттық жабын) арнайы химиялық өңдеу арқылы оның ішкі бөлімдеріне сыртқы ортадағы тотықтырғыш әсерін кеміту. Мысалы, темірді концентрлі күкірт не азот қышқылдарымен өңдесе, оның бетінде оксидтік қабат түзіледі де, оның тотықтырғыш әсерінен төзімділігі артады.
ә) металл бетін органикалық заттармен: лак, бояу, смола және әртүрлі полимерлермен қаптау.
3. Металл бетін металмен қаптау: анодтық, катодтық.
а) анодтық қаптау жүргізілгенде анод ретінде қорғайтын химиялық белсендірек металл алынады, ал қорғалатыны катод ролін атқарады.
б) катодтық қаптауда - қорғайтын металл катод, ал қорғалатыны – анод болады. Көптеген электр тогын жақсы өткізетін металдар (күміс, мыс, алтын, хром, марганец, вольфрам) коррозияға төзімді болып келеді.Бұл қасиеттері олардың кристалдық торлары және атомдарының құрылысына байланысты. Химиялық белсенділігі төмен металл бүлінгенше оның астындағы металл коррозияға ұшырамайды.
Коррозиядан анодтық қорғауға темірді ( 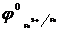 = -0,44В) мырышпен (
= -0,44В) мырышпен ( 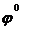 Zn2+/Zn ) = -0,76В) қаптау мысал бола алады. Әртүрлі механикалық әсерден егер мырыш аздап бүлінсе, оның бетіне суда еріген кейбір газдар ерітіндісі жиналады да гальваножұп жұмыс істей бастайды:
Zn2+/Zn ) = -0,76В) қаптау мысал бола алады. Әртүрлі механикалық әсерден егер мырыш аздап бүлінсе, оның бетіне суда еріген кейбір газдар ерітіндісі жиналады да гальваножұп жұмыс істей бастайды:
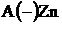
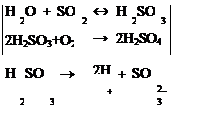
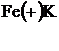
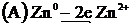

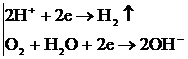
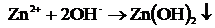
Zn+2 + SO4-2→ ZnSO4
Анодтық қорғаудың екі тәсілі бар.
1. Протекторлық (сүйенішті) қорғау. Металдан жасалған конструкциялардың бетін толығымен химиялық белсенділігі жоғары металмен қаптамай-ақ оны жанастырып қояды, ол жұмсалып біткен сайын жаңартылып отырылады.
2. Электрлік қорғаудың өзгешелігі – ток көзіне жалғануында, анод қорғайтын металл болса, катод – қорғалатыны болады.
Көптеген электр тогін жақсы өткізетін металдар (күміс, мыс, алтын, марганец, хром, вольфрам коррозияға төзімді, болып келеді.) химиялық белсенділігі төмен металл бүлініп болғанша оның астындағы металл жеміріленеді.
3.Коррозияға қарсы қасиетті құймалар әзірлеу (болатты легирлеу)
Кесте 9.9. Болат түрлері
| Түрлері | Құрамы | Болат қасиеті | Қолданылуы |
| Хром-никельді | Cr, Ni | Жоғары температураға, әртүрлі механикалық әсерге төзімді | Үй тұрмысына қажетті бұйымдармен қатар машинаның көптеген бөліктерін жасайды. |
| Хром-молибден | Cr, Mo | Қаттылық, жоғары температура мен қысым әсеріне төзімділігі | Компрессорлар, ұшақ моторлары, мұнай-газ құбырлары және оларды тасымалдаушы трубалар |
| Хром-вольфрамды | Cr, W | Қаттылық | Кесетін инструменттер әзірлеуде |
| Марганецті | Mn | Үйкеліс пен механикалық соққыға төзімді | Машина бөліктері жасалады |
4. Металдарды алмастыратын жаңа конструкциялық материалдар әзірлеу. Сөйтіп, осы айтылғандарды қорыта келе мынадай кесте ұсынуға болады:
Кесте 9.10 Коррозия түрлері және одан қорғау әдістері
| Коррозия түрлері | ||
| Химиялық электр тогын өткізбейтін (газ, мұнай т.б) ортада химиялық заттар әсерінен болады. | Биологиялық микроорганизмдер әсерінен өтетін химиялық коррозия | Электрохимиялық электролит қатысында микрогальвано жұптың жұмыс істеуінен туындайды. |
Коррозиядан қорғау әдістері
| Қоршаған ортаны өзгерту | Металл қондырғылар құрамын өзгерту | Қоршаған ортадан бөлу | |||
| Металл бетін қаптау | Химиялық әдіс | Электрохимиялық әдіс
| |||
| 1) ингибитор (тежегіш) пайдалану 2) қоршаған ортадағы тотықтырғыштар концентрациясын азайту (деаэрация) | Құймалар әзірлеу (Fe - Cr, Ni) (Fe - Cr, Mo) (Fe - Cr, W) (Fe - Mn) | 1) Лактау 2) Эмальдау 3) Смолалау 4) Майлау 5) Әртүрлі полимерлермен жабу
| Химиялық белсенділігі төмен бет түзу а) азоттау ә) фосфаттау б) оксидтеу
| Химиялық белсенділіктері жоғары металдармен қаптау | Катодтық (химиялық белсенділіктерітөмен қаптау) |
| Протек-торлы электрлік сүйенішті | |||||
Металдың шығынын азайту үшін қазіргі кезде қасиеттері жөнінен коррозияға, қысым мен температура өзгерісіне ешбір беріспейтін жаңа конструкциялық материалдармен алмастыру көзделуде.
§9 «Тотығу–тотықсыздану үдерістері» тақырыбы бойынша
шығарылатын типтік есептер мен жаттығулар
9.1Тотығу–тотықсыздану реакциясына қатысқан заттар формулалары берілгенде реакция теңдігін аяқтап, тотықтырғыш пен тотықсыздандырғыштың эквиваленттік массасын есептендер.
NaCrO2 + Br2 + NaOH →
Шешуі
1) Бұл теңдікті аяқтау үшін реакцияға алынған заттардағы элементтердің тотығу дәрежелерін және олардың реакцияда атқарар рольдерін анықтау:
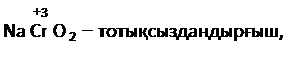
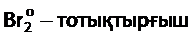
2) Реакцияның ионды-электрондық теңдеуін құру
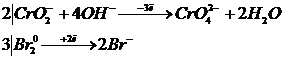
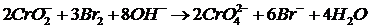
3) Реакция теңдігін жазып, теңестіру:
2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O
4) реакцияның типі – молекула аралық тотығу–тотықсыздану реакциясы.
5) Тотықтырғыш пен тотықсыздандырғыштың эквиваленттік массаларын есептеу:
M (NaCrO2) = 107г/мольfэ (NaCrO2) = 1/3 моль mэ (NaCrO2) = 1/3· 107 = 35,7 г.
М (Br2) = 160г/ моль fэ (Br2) = ½ моль mэ (Br2) = ½· 160 = 80 г.
Жауабы:mэ (NaCrO2) = 35,7 г.
mэ (Br2) =80 г.
9.2 Реакцияға қажетті тотықтырғыш немесе тотықсыздандырғыш таңдау.
Бихромат ионын тотықсыздандыру үшін (рН<7) галогенид иондарының қайсысын пайдалануға болады:
а) 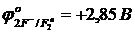 б)
б) 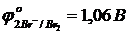
ә) 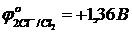 в)
в) 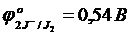
1) Шешуі:
Реакция жүретіндігі оның электр қозғаушы күшіне байланысты, егер ол оң таңбалы болса жүреді, теріс болса – жүрмейді. Реакцияның жүруі үшін Гиббс энергиясының өзгерісі теріс таңбалы болуы тиіс, ол электр қозғаушы күшімен мынадай байланыста болады: ∆ 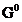 = -nF
= -nF 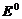 , сонда E>0 болғанда, ∆G <0 болады.
, сонда E>0 болғанда, ∆G <0 болады.
2) 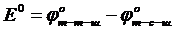
а) E1 = 1,33 – 2,85 = -1,52 В
ә) Е2 =1,33 – 1,36 = -0,03 В
б) Е3 = 1,33 – 1,06 = 0,27 В
в) Е4 = 1,33 – 0,54 = 0,79 В
3)Сонда, бұдан шығатын қорытынды соңғы тотықсыздандырғыш (J-)бұл реакцияны жүргізуге қолайлы, себебі жүйенің электр қозғаушы күшінің мәні жоғары, олай болса, мына реакцияның теңдеуін жазуға болады:
4)K2Cr2O7 + 4H2SO4 + 6HJ = K2SO4 + 3J2 +7H2O + Cr2(SO4)3
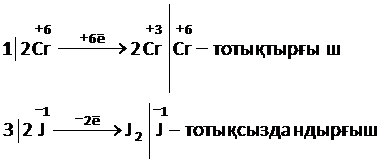 Жауабы:иодид ионы
Жауабы:иодид ионы
9.3 Тотығу–тотықсыздану реакциясының жүру мүмкіндігін және жағдайын
анықтау:
Шешуі:
1)Электрондық балансын құру
4NH3 + 3O2= 2N2 + 6H2O
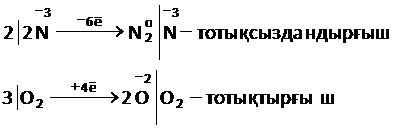
2)Термодинамикалық функцияларының (∆H,S◘) мәндерін жазу.
4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г)
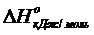 -46,2 0 0 -241,8
-46,2 0 0 -241,8
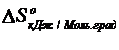 ᵒ 0,193 0,205 0,192 0,189
ᵒ 0,193 0,205 0,192 0,189
4) Реакцияның энтальпиясы мен энтропиясының өзгерістерін есептеу
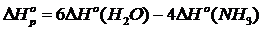
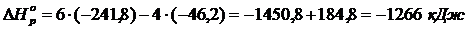
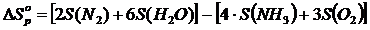
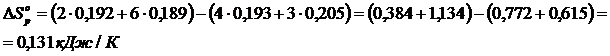
5) Реакцияның Гиббс энергиясының өзгерісін есептеу
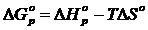
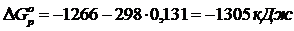
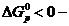 реакция жүреді
реакция жүреді
6) Жауабы:реакция жүреді
9.4 Гальвани элементі бойынша:
а) редоксо-жұптар бойынша (электрод – инертті) қай электрод мына жұпқа Sn4+/Sn2+ қарағанда оң полюсті болады, электр қозғаушы күшін, ток бағытын көрсетіңіз.
а) V+3/V+2 ә) Al+3/Al б) Cr2O72-, 14H+/2Cr3+, 7H2O
1) Электродтың потенциалдарының мәндерін жазу
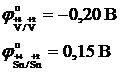
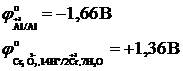
2) Электродтың потенциалдар мәндерін өзара салыстырғанда б-жұбының оң полюсті болатыны байқалады, ток анодтан катодқа қарай бағыталады.
A (–) Sn4+/Sn2+ || Cr2O72-, 14H+/2Cr3+, 7H2O (+)
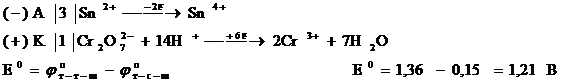
3) Электр қозғаушы күшінің мәнін есептеу.
Е0 = 1,36 – 0,15 = 1,21 В
Жауабы: 1,21В
ә) екі гальвани элементінің сызбанұсқасын жазыңыз, соның бірінде темір катод, екіншісінде анод болсын.
1) Электродтық потенциалдарының мәндерін салыстырсақ
φ0Fe+3|Fe+2<φ0Bi+3|Bi, сондықтан темір – анод, висмут – катод болады.
φ0Mn+2|Mn <φ0Fe+2|Fe →Mn - анод, Fe – катод болады.
9.5 Электролиз және оның заңдарына есептер.
а) Қорғасын балқымасынан 30 минут 20 а ток өткенде Pb-ның массасын, хлордың көлемін анықтау.
Берілгені: Шешуі:
 1)t = 30 мин. 2)
1)t = 30 мин. 2) 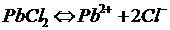
J = 20 a 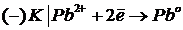 | Pb2+ - тотықтырғыш
| Pb2+ - тотықтырғыш
 m(Pb)-?
m(Pb)-? 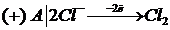 | CI - тотықсыздандырғыш
| CI - тотықсыздандырғыш
Vo(Cl2)-? 3) 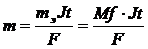
f (Pb) = 1/2 mэ = 1/2· 207 = 103,5 г.
fэ (Cl2) = 1/2 mэ = 1/2· 73 = 35,5 г.
Vэ (Cl2) = 11,2 л.
4)
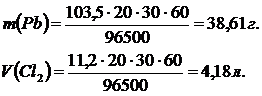
5)Жауабы: 38,61 г. Pb
4,18 л. Cl2
9.6 Суды электролиздеу кезінде 5 F заряд өтсе, қанша көлем сутегі және оттегі түзіледі (қ.ж.)? Оттегімен сутегінің химиялық және электрохимиялық эквивалентерін салыстырыңыз.
| 1)Берілгені: q = 5F | Шешуі |
| Т/К V(H2, O2), K(O, H)-? | 2)Суды электролиздеу үшін оған диссоциациялану дәрежесінің мәні жоғары зат (Na2SO4) қосылады, сонда: күшті негіз (к.н.) 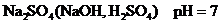 күшті қышқыл(к.қ)
к.н. к.қ. күшті қышқыл(к.қ)
к.н. к.қ.
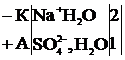 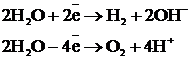
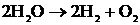
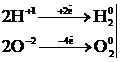  3)
3) 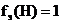 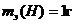 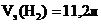
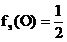 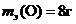 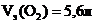 4) Фарадей заңы бойынша:
4) Фарадей заңы бойынша:
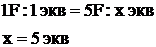 Vэ(Н2) = 11,2 л, Vэ(О2) = 5,6 л
Vэ(Н2) = 11,2 л, Vэ(О2) = 5,6 л
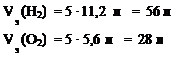 5)
5) 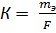 ; ; 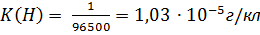
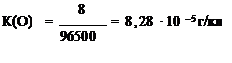 6)Жауабы: 1,03∙10-5 г/кл, 8,28∙10-5 г/кл, 56 л Н2, 28 л О2.
6)Жауабы: 1,03∙10-5 г/кл, 8,28∙10-5 г/кл, 56 л Н2, 28 л О2.
|
9.7 «Металдар коррозиясы» бойынша
Темір бұйым мыспен жалатылған болса, оның ылғалды ауадағы және күкірт қышқыл ерітіндісіндегі жүретін химиялық электрохимиялық үдерістер теңдеулерін жазыңыз.

1) Бұйым бүлінгенде мынадай гальвани элементі жұмыс істей бастайды:
A (–) Fe/Fe2+ || Cu2+/Cu (+) K
2) Қышқылдық ортада тұрған бұйым (анод) темір еріп,
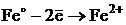
ерітіндідегі иондармен әрекеттеседі: Fe2+ + SO42-→FeSO4, ал, катод бетінде жинақталған сутек иондары темірден келген электрондарды қосып, молекулалық сутегіге айналады: 2H+ + 2ē → H2↑
Ал, ылғалды ауада катод бетінде
O2 + 2H2O + 4 ē → 4OH –
еріген анодтан түзілген Fe2+ иондары гидроксид түзеді.
Fe2+ + 2OH - → Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Темір (ІІІ) гидроксиді температура әсерінен ыдырап, аралас оксидке (темір таттанады) айналады.

Бұл тараудан (ІХ) не білдіңіз?
1. Заттар формуласы бойынша оның құрамында элементтердің валенттілігі және тотығу дәрежесін анықтау.
2. Тотығу дәрежесі және валенттіліктің айырмашылығы, олардың байланыс типіне тәуелділігі.
3. Түсініктер: тотықсыздандырғыш, тотықтырғыш, тотығу, тотықсыздану үрдістері.
4. Тотығу-тотықсыздану реакцияларының типтері.
5. Тотығу-тотықсыздану реакциясын теңестірудің тәсілдері: электрондық баланс және ионды-электрондық баланс тәсілі.
6. Гальвани элементі бойынша мына түсініктер: электродтық потенциал, сутектік электрод, электр қозғаушы күш.
7. Электролиз; катодтық және анодтық үрдістер.
8. Фарадей заңдары І, ІІ, электрохимиялық эквивалент.
9. Металдар коррозиясы, одан қорғау тәсілдері.
10. Типтік есептер мен жаттығуларды шешу әдістерін қарастыру.
А. Тотығу-тотықсыздану реакциясы ТТР бойынша:
а) электрондық теңдеу жазу;
ә) тотықтырғыш пен тотықсыздандырғышты анықтау;
б) тотықтырғыш пен тотықсыздандырғыштың эквиваленттік факторын есептеу; (молекулааралық, тотығу-тотықсыздану реакциялары бойынша).
в) ТТР-дің типін анықтау;
г) ТТР-дің электр қозғаушы күшін есептеу.
Ә. Гальвани элементі бойынша:
а) редоксо-жұптардың стандартты электродтық жұптарының потенциалдары бойынша гальвани элементінің полюстерін анықтау;
ә) Гальвани жұбында жүретін ТТР-дің электрондық теңдеулерін жазу;
Б.Электролиз және оның заңдары бойынша:
а) электродтарда (инертті және еритін анодты) жүретін үдерістердің электрондық теңдеулерін жазу;
Фарадей заңы бойынша есептеулер жүргізу арқылы мына шамаларды J,  есептей білу;
есептей білу;
В.Металдар коррозиясы бойынша:
а) коррозия түрлерін жіктей білу;
ә) коррозиядан қорғау әдістерін ( катодтық, анодтық қорғау) білу.
Дата добавления: 2018-08-06; просмотров: 649; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
