Кристаллическое вещество и его строение. Типы химических связей и связанные с ними свойства минералов.
Кристаллическоевещество - вещества, которое материальны частицы расположены упорядочено.
Типы химических связей:
· Ионная связь - не высокая твердость, хорошая спаянность, растворимость, высокая температурная явления.
· Ковалентная связь - твердые связь прочная, соединены минералы - твердые, плотные, но химически не очень стойкие.
· Металлическая связь - электропроводность, высокая плотность, теплопроводность.
· Водородная связь - летучие, имеют низкие температурные испарение, способность молекул оторваться от поверхности.
Твердые вещества могут быть аморфными и кристаллическими. Аморфные-беспорядочное расположение атомов, кристаллические- упорядоченное. Кристалл - кристаллическое вещество, имеющее форму естественного многогранника. Поверхность кристаллов ограничена плоскостями, которые носят название граней. Места соединения граней называются рёбрами, точки пересечения которых называются вершинами или углами. Кристаллическому строению вещества присущи следующие элементы симметрии: плоскость симметрии, ось симметрии и центр симметрии. Пользуясь элементами симметрии, все разнообразие кристаллических разновидностей классифицируют на 7 систем, состоящих из 32 классов, или видов симметрии, к которым относят тот или иной кристалл. Для кристаллического строения вещества характерным являете правильное периодическое расположение атомов ( ионов, молекул) в трехмерной про-с т р анственной решетке. Особенностью кристаллического строения вещества является высокая энергия взаимодействия частиц и связанная с этим медленность процессов переноса в решетке. Поэтому в реальных кристаллах большую роль играют не только равновесные, но и неравновесные свойства решетки. Если число дефектов превышает равновесное значение, их называют биографическими в отличие от тепловых или равновесных, которые только и рассматриваются в термодинамических теориях кристаллов. Различают следующие типы структурных дефектов. Кристаллы ,состоящие из молекул, не играют существенную роль в строении земной коры. Поэтому рассматривают связь между атомами. Существуют несколько типов связей, а именно: ионная, ковалентная, металлическая и межмолекулярная. Связь атомов, осуществляемая электронными парами называется атомной или ковалентной, а ионная - передача электронов одного атома к другому с образование противоположно заряженных атомов. Вокруг каждого атома имеется определенная «сфера действия», внутрь которой атом не может проникнуть. Радиус этой сферы называют атомным или ионным. Атомы и ионы способны замещать друг друга , если они обладают близкими величинами своих радиусов. Если вещества имеют однотипные хим составы и размеры, то они могут образовывать смешанные кристаллические структуры. Это явление изоморфизм
|
|
|
|
|
|
Изоморфизм и его условия. Понятие полиморфизма минералов; примеры.
Изоморфизм - способность элементов в кристаллической структуре замещать друг друга при условии близости радиусов. очень широко развита в природе. наиболее активна проявляется при магматизме, когда при высоком давлении и температуре.
Условия изоморфизма:
· Близость радиусов участвующих в изоморфных замещениях ионов и атомов.
· Определенное сходство химических свойств заменяющих друг друга элементов( лучше всего, если они принадлежат одной подгруппе периодической системы).
· Сохранение электронейтральности кристаллической структуры миенрала.
Полиморфизм - способность некоторых веществ существовать в состояниях с различной кристаллической структурой. пример - алмаз и графит - полиморфные модификации углерода. различные свойства алмаза и графита определяются различиями в их кристаллохимических структурах. Пирит и маркозит являются полиморфными модификациями одного вещества - Fe 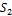 . (с химической точки зрения это одно и тоже).
. (с химической точки зрения это одно и тоже).
Дата добавления: 2018-08-06; просмотров: 448; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
