Влияние строения на силу кислот и оснований.
Ионная – атом Ме и атом НеМе Металлическая – атомы Ме Ковалентная (непо-) – Между одинаковыми НеМе Ковалентная (по-)- между двумя НеМе Водородная - 2.Биогенные элементы-элементы, необходимые организму для построения и жизнедеятельности клеток и органов, называют биогенными элементами. Макроэлементы – их концентрация в организме превышает 0,01% (О, С, H, N, Ca, Р, К, Na, S, Cl, Mg). 2. Микроэлементы - концентрация от 0,00001% до 0,01% (Fe, Zn, F, Sr, Mo, Cu, Br, Si, Cs, I, Mn, Al, Pb, Cd, В, Kb) Ультрамикроэлементы - концентрация ниже 0,000001% (Se, Со, V, Cr, As, Ni, Li, Ba, Ті, Ag, Sn, Be, Ga, Ge, Hg, Sc, Zr, Bi, Sb, U, Th, Rh). 1. Органогены, в организме их 97,4% (С, Н, О, N, Р, S), 2. Элементы электролитного фона (Na, К, Ca, Mg, Сl). Данные ионы металлов составляют 99% общего содержания металлов в организме; 3. Микроэлементы – это биологически активные атомы центров ферментов, гормонов (переходные металлы). 3.Макроэлементы -некоторые элементы этой группы называют «органогенами»(О, Н, С, N, Р, S) в связи с их ведущей ролью в формировании структуры тканей и органов. Микроэлементы входят в состав нуклеиновых кислот, обеспечивают стабильность хромосомных нитей, образуют хелатные комплексы с макромолекулами, активируют или ингибируют ферментные системы. 4. Термодинамика – это наука, изучающая общие закономерности протекания процессов, сопровождающихся выделением, поглощением и превращением энергии. Система – любой объект природы, состоящий из большого числа молекул (структурных единиц) и отделённый от других объектов природы реальной или воображаемой граничной поверхностью (границей раздела). Типы термодинамических систем: I. По характеру обмена веществом и энергией с окружающей средой: 1. Изолированная система – не обменивается со средой ни веществом, ни энергией (Δm = 0; ΔE = 0) - термос. 2. Закрытая система – не обменивается со средой веществом, но может обмениваться энергией (закрытая колба с реагентами). 3. Открытая система – может обмениваться со средой, как веществом, так и энергией (человеческое тело). II. По агрегатному состоянию: 1. Гомогенная – отсутствие резких изменений физических и химических свойств при переходе от одних областей системы к другим (состоят из одной фазы). 2. Гетерогенная – две или более гомогенные системы в одной (состоит из двух или нескольких фаз). Классификация термодинамических процессов: Изотермический - постоянная температура – T = const Изобарный - постоянное давление – p = const Изохорный - постоянный объем – V = const Стандартное состояние - это состояние системы, условно выбранное в качестве стандарта для сравнения. 5.Внутренняя энергия U - общий запас энергии, включая движение молекул, колебания связей, движение электронов, ядер и др., т.е. все виды энергии кроме кинетической и потенциальной энергии системы в целом. Теплота (Q) – форма передачи энергии путем хаотического, неупорядоченного движения частиц. Работа (А) – форма передачи энергии путем упорядоченного перемещения частиц под действием каких-либо сил. 6.Первое начало термодинамики, или закон сохранения энергии, гласит, что энергия не может возникать из ничего и исчезать, а только переходит из одной формы в другую. Энтальпия: функция состояния системы, приращение которой равно теплоте, полученной системой в изобарном процессе. Стандартная энтальпия реакции - это разность между суммой энтальпий образования продуктов реакции и суммой энтальпий образования реагентов с учетом стехиометрических количеств веществ: 7.Опыт, в том числе повседневный, свидетельствует о том, что беспорядок возникает самопроизвольно, а чтобы привести что-нибудь в упорядоченное состояние, нужно затратить энергию. Это утверждение – одна из формулировок второго начала термодинамики. Энтропия S является функцией состояния и определяется степенью беспорядка в системе. Свободная энергия Гиббса. Одновременный учет энергетического и энтропийного факторов приводит к понятию еще одной полной функции состояния – свободной энергии. Если измерения проводятся при постоянном давлении, то величина называется свободной энергией Гиббса и обозначается ΔG. 8. Экзергонические реакции – G<0 и системой совершается работа (гидролиз АТФ): АТФ + Н2О → АДФ + Ф, ΔG= - 7,3 ккал/моль Эндергонические реакции – G>0 и над системой совершается работа (фосфорилирование глюкозы): Глюкоза + Ф → глюкоза-6-фосфат + Н2О, ΔG= 3 ккал/моль Принципы энергетического сопряжения: 1. Эндергоническая реакция осуществляется совместно и одновременно с экзергонической. 2. Абсолютное значение изменения свободной энергии для экзергонической реакции должно быть больше, чем для эндергонической. 3. Экзергоническая и эндергоническая реакция должны иметь общий промежуточный продукт (например, Ф и Н2О). 9.Гомогенная реакция происходит в гомогенной системе и осуществляется во всем объеме этой системы. Гетерогенная реакция происходит между веществами, образующими гетерогенную систему. Она проходит только на поверхности раздела фаз этой системы. Например: Fe + 2НСl→FeCl2 + Н2 Растворение металла в кислоте может происходить только на поверхности металла, так как только здесь контактируют друг с другом оба реагирующих вещества. Микрогетерогенный катализ - это такой тип катализа, когда катализатор и реагенты находятся в коллоидно-дисперсном состоянии. Размеры частичек ферментов близки к размерам мицелл коллоидных растворов – 1-100 нм. По отношению к субстратам, частички которых часто намного меньше, катализаторы являются гетерогенными. Простыми, элементарными являются одностадийные реакции. Сложныминазываются многостадийные реакции. 10. Увеличение числа частиц в данном объеме (концентрации) приводит к более частым их столкновениям, т.е. к увеличению скорости химической реакции. Таким образом, скорость химической реакции пропорциональна концентрации реагирующих веществ. Эту зависимость скорости реакции от концентрации реагирующих веществ выражает закон действующих масс, открытый норвежскими учеными К. Гульдбергом и П. Вааге в 1867 г. 11. С повышением температуры скорость химического процесса обычно увеличивается. В 1879 г. голландский ученый Я. Вант-Гофф сформулировал эмпирическое правило: с повышением температуры на 10 К скорость большинства химических реакций возрастает в 2-4 раза. Математическая запись правила Я. Вант-Гоффа: γ10 = (kт+10)/kт Энергия активации.Значительное возрастание скорости реакции при повышении температуры нельзя объяснить только увеличением числа столкновений между частицами реагирующих веществ, т.к., в соответствии с кинетической теорией газов, с возрастанием температуры количество столкновений увеличивается в незначительной степени. 12. Катализ – явление повышения скорости химического процесса с помощью катализаторов. В случае гомогенного катализа катализатор и вещества, принимающие участие в реакции, образуют одну фазу. Например, разложение раствора пероксида водорода при наличии ионов меди (II) как катализатора: Cu2+ 2H2O2 2H2O + O2 В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы: 2SO2 (г) + O2 (г)→SO3 Уравнение 13. Химические процессы происходят самопроизвольно, если в результате процесса уменьшается свободная энергия Гиббса, ΔG < 0. Если энтальпийный и энтропийный факторы действуют согласованно, направляя реакцию в сторону образования продуктов, то исходные вещества полностью превращаются в продукты реакции. Такие реакции называют необратимыми. Если продукты реакции могут взаимодействовать между собой с образованием исходных веществ, то реакция происходит в двух противоположных направлениях. Такие реакции называют обратимыми. Если система находится в состоянии химического равновесия, то она будет в этом состоянии до тех пор, пока внешние условия сохраняются постоянными. Если эти условия изменяются, то система выходит из равновесия. Смещение равновесия происходит в соответствии с принципом Ле Шателье: если изменяется хотя бы одно из условий, при которых система находится в состоянии химического равновесия, то равновесие смещается в сторону того процесса, который уменьшает (ослабляет) это изменение. Сместить равновесие можно, меняя концентрацию, давление, температуру. 14. Вода в организме участвует в: -процессах метаболизма; -терморегуляции как теплоноситель и хладагент; -трансформации энергии (синтез и гидролиз макроэргических соединений); -процессе диссоциации электролитов как полярный растворитель; -растворении минеральных и органических веществ, газов, жидкостей. Свойства воды объясняются строением её молекул и структурированностью. Водородные связи слабее ковалентных. Однако, благодаря их многочисленности, они обеспечивают многие аномальные физические свойства воды: -высокую удельную теплоёмкость; -высокую температуру кипения; -высокую температуру кристаллизации; -высокую удельную теплоту испарения; Вода, как полярный растворитель, имеет хорошую растворяющую и диссоциирующую способность. 15. Растворимость веществ, т.е. способность растворяться в том или ином растворителе Коэффициент растворимости s (k) равен максимальной массе вещества (в г), которое можно растворить в данных условиях в 100 г (реже — в 1 дм3) растворителя, чтобы получить насыщенный при данных условиях раствор. В случае газов растворимость часто задают в кубических сантиметрах (или граммах) на 1 дм3: см3/дм3 или г/дм3. 1. Природа растворяемого вещества и растворителя. 2. Температура (принцип Ле Шателье). 3. Давление. 16.Коллигативные свойства – это свойства растворов, зависящие только от числа растворённых частиц в единице массы растворителя и от абсолютной температуры, и не зависящие от их природы. Это относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества (закон Рауля). Математически закон Рауля можно выразить так: (Р0 – Р) / Р0 = n / n+N, . Понижение температуры замерзания раствора, по сравнению с чистым растворителем. Растворы замерзают при температуре ниже, чем чистый растворитель. . Повышение температуры кипения раствора, по сравнению с чистым растворителем. Известно, что раствор начинает кипеть тогда, когда давление его насыщенного пара равно внешнему давлению. Следовательно, раствор закипает при более высокой температуре, чем чистый растворитель. 17.Диффузия – это самопроизвольный процесс выравнивания концентрации растворённого вещества в объёме. Осмос – это односторонняя диффузия растворителя через полупроницаемую мембрану в сторону раствора с большей концентрацией растворённого вещества. Осмос вызывается осмотическим давлением – силой, отнесённой к единице поверхности мембраны. Осмотическое давление имеется у любого раствора. Оно обусловлено стремлением частиц растворителя путём диффузии распределиться в максимально большем объёме. Закон Вант-Гоффа: учитывая, что С = n/V, получаем: РосмV = nRT. Осмолярность и осмоляльность представляют собой общую концентрацию растворенных частиц в 1 л раствора (осмолярность) или в 1 кг воды (осмоляльность). 18. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. Раствор, осмотическое давление которого ниже изотонического, называется гипотоническим. Раствор, осмотическое давление которого выше изотонического, называется гипертоническим. В изотонических растворах эритроциты не изменяют свою форму, т.к. Росм изотонического раствора равно Росм эритроцита, поэтому потоки Н2О в эритроцит и из него уравновешены. В результате ток воды направлен из эритроцитов в окружающую среду (в сторону раствора с большей концентрацией). Наступает обезвоживание эритроцитов и, как следствие, их сморщивание (плазмолиз). Росм гипотонического раствора меньше Росм эритроцита. В результате ток воды направлен в эритроцит из окружающей среды (в сторону раствора с большей концентрацией). Наступает набухание эритроцита и, как следствие, его разрыв (гемолиз). 19. Кравн×[Н2О] = [Н+][ОН-] (1.3) и, подставляя числовые значения в уравнение 1.3, получаем: К =1,8×10-16 моль/л×55,5 моль/л = 10-14 моль2/л2, где К – ионное произведение воды. С ростом температуры увеличивается число диссоциациировавших молекул воды и, следовательно, увеличивается ионное произведение воды. В 1909 г. Зёренсен предложил использовать для выражения концентрации протонов водородный показатель – рН, равный десятичному логарифму концентрации протонов, взятому с противоположным знаком: pH = -lg [Н+] Так как ионное произведение воды для данной температуры – величина постоянная, увеличение концентрации одного из ионов влечёт снижение концентрации другого. Зная рН, легко вычислить рОН: рОН = 14 – рН и наоборот. Название Цвет индикатора в среде Кислая [H+] > [OH-] рН < 7 Нейтральная [H+] = [OH-] рН = 7 Щелочная [OH-] > [H+] рН > 7 Лакмус красный фиолетовый синий Фенолфталеин бесцветный бесцветный малиновый Метилоранж розовый оранжевый желтый 20. Вещества, которые отдают протон, являются кислотами, а вещества, которые протон присоединяют - основаниями. Сила кислоты или основания определяется положением равновесия кислотно-основного взаимодействия и зависит от разности свободных энергий исходных и конечных соединений.
|
|
|
|
|
|
|
|
|
|
|
|
Влияние строения на силу кислот и оснований.
Кислоты Бренстеда.
Сила кислоты зависит от природы атома при кислотном центре и от его структурного окружения. Для оценки относительной силы кислот важны такие характеристики атома при кислотном центре как его электроотрицательность и поляризуемость.
При прочих равных условиях для элементов одного периода с ростом электроотрицательности атома кислотность соединений увеличивается, так как высокая электроотрицательность атома при кислотном центре стабилизирует образующийся при отщеплении протона анион. Так, кислотность уменьшается в ряду :OH-кислоты> NH-кислоты> CH-кислоты
Введение заместителя
делокализация отрицательного заряда
радиуса атома
21. Слабые кислоты: H2S, HF, CH3COOH, HNO2 (HnЭOm m-n<2)
Слабые основания: NH4OH, Me(OH)n (Me-  , кроме щелочных и щелочно земельных).
, кроме щелочных и щелочно земельных).
Константа диссоциации - вид константы равновесия, которая показывает склонность к диссоциации.
 <<1 и Kд<1
<<1 и Kд<1
 Закон разбавления Оствальда.
Закон разбавления Оствальда.
 Закон:
Закон: 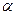 -степень электролитической диссоциации слабых электролитов, увеличивается при разбавлении раствора.
-степень электролитической диссоциации слабых электролитов, увеличивается при разбавлении раствора.

 ;
; 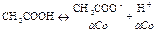
22.Буферные системы (БС) – водные растворы, препятствующие изменению рН при добавлении небольших количеств сильных кислот, оснований, а также при разбавлении и концентрировании.
Состав любой БС включает в себя 2 компонента в следующих вариантах:
а) слабая кислота и её соль, образованная сильным основанием;
б) слабое основание и его соль, образованная сильной кислотой.
Буферная ёмкость – это количество молей любой сильной кислоты или щёлочи, которое необходимо добавить к 1 л буферного раствора для смещения его рН на 1. Буферная ёмкость тем выше, чем больше концентрация компонентов и чем ближе их соотношение к единице.
Интервал рН = рКа ± 1 называется зоной буферного действия.
23.Бикарбонатная (гидрокарбонатная) БС (Н2СО3/НСО3-) – мощная система плазмы крови, составляющая примерно 10% от её общей буферной ёмкости. В норме соотношение компонентов (гидрокарбонат-анион / угольная кислота) равно 20.
Фосфатная БС. Образована двумя ионами: гидро- и дигидрофосфат-анионами: НРО42-/Н2РО4
Белковая БС имеет меньшее значение в поддержании рН. Благодаря амфотерным свойствам белков, состав белковой БС условно можно представить, как белок-кислоту (НООС–Pr–NH3+) и белок-основание (-ООС–Pr–NH2), где Pr – протеин (белок).
Гемоглобиновая БС – самая мощная в организме. Она действует в эритроцитах, обеспечивая примерно 76% буферной ёмкости крови.
24. Защита от кислоты: при добавлении сильной кислоты (Н+) в работу вступает оснóвный компонент буфера, связывая протоны водорода в слабую кислоту – компонент буфера. Поэтому рН среды практически не меняется. Защита от кислоты будет продолжаться до тех пор, пока в буфере есть оснóвный компонент. Другими словами, буфер обладает определенной емкостью по кислоте.
Защита от щелочи: при добавлении щелочи (ОН−) в работу вступает кислотный компонент буфера, и, отдавая свои Н+ на ОН−, связывает их в воду, что не может повлиять на рН среды. В то же время кислотный компонент буфера превращается в сопряженное основание – компонент буфера. Поэтому рН среды практически не меняется. Защита от щелочи будет продолжаться до тех пор, пока в буфере есть кислотный компонент. Другими словами, буфер обладает определенной емкостью по основанию.
25. рН плазмы 7,4±0,05
Сдвиг реакции среды в кислую сторону называют ацидоз, а в оснóвную – алкалоз.Щелочной резерв - это количество бикарбоната (NaHCО3) (точнее объем СО2, который может быть связан плазмой крови)
26.Окислительно-восстановительными называются реакции, протекающие с изменением степени окисления двух или более веществ.
Типы окислительно-восстановительных реакций в организме человека:
1. Реакция дегидрирования: SH2 + HAD+ → S + HADH+H+
2. Потеря электрона:O20 + 1e → O2-
3. Перенос 2Н+ от восстановленного субстрата на молекулярный кислород: SH2 + O20 +2e → S + H2O
4. Присоединение кислорода к субстрату: SH2 + ½O20 +2ē → HO-S-H
27. Окислительно-восстановительный потенциал является мерой окислительно-восстановительной способности веществ. Значение стандартных потенциалов пар указаны в справочных таблицах.
Стандартные потенциалы электродов (Е°), выступающих как восстановители по отношению к водороду, имеют знак «-», а знак «+» имеют стандартные потенциалы электродов, являющихся окислителями.
В ряду редокс-потенциалов отмечают следующие закономерности.
1. Если стандартный редокс-потенциал пары отрицателен, например φ°(Zn2+(р)/Zn°(т)) = -0,76 В, то по отношению к водородной паре, потенциал которой выше, данная пара выступает в качестве восстановителя (реакции окисления).
2. Если потенциал пары положителен, например φ°(Сu2+(р)/ Cu(т)) = +0,345 В по отношению к водородной или другой сопряженной паре, потенциал которой ниже, данная пара является окислителем (реакции восстановления).
3. Чем выше алгебраическая величина стандартного потенциала пары, тем выше окислительная способность окисленной формы и ниже восстановительная способность восстановленной формы этой пары. Разность между стандартными окислительными потенциалами окисленной и восстановленной полупар называют электродвижущей силой (ЭДС).
Е0 = Еок- Евосст
Количественным критерием оценки возможности протекания той или иной окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления.
Для установления возможности самопроизвольного протекания в стандартных условиях ОВР необходимо:
Рассчитать ЭДС реакции согласно уравнению Нернста
Е = Е0 + 0,0592/пlgCоф/Свф
28. Согласно данной теории, центральный атом или ион, в большинстве случаев в форме катиона (обычно положительно заряженный), координирует (т.е. близко располагает) вокруг себя некоторое число анионов или молекул, которые называются лигандами, (или аддендами – старое название). Простые положительно заряженные катионы в роли лигандов не выступают.
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L  [MLn]
[MLn]
В комплексном ионе или нейтральном комплексе вокруг комплексообразователя координируются ионы, атомы или простые молекулы (L). Все эти частицы, имеющие химические связи с комплексообразователем, называются лигандами (от латинского «ligare» - связывать).
Число лигандов, окружающих центральный ион, называется координационным числом (КЧ).
Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных.
Центральный атом вместе с координированными лигандами образуют внутреннюю координационную (т.е. комплексную) сферу
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу.
29.Классификация комплексных соединений
Существует несколько систем классификации комплексных соединений, которые основываются на различных принципах.
1. По знаку заряда комплекса:
1. Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
2. Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы
3. Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона - комплексообразователя отрицательных ионов и молекул.
2. По принадлежности комплексного соединения к определенному классу соединений:
3. По природе лиганда:
- аквакомплексы (лигандом выступает вода: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3 и др.),
- аммиакаты (лигандом выступает аммиак, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3, [Pt(NH3)6]Cl4 и др.),
- ацидокомплексы (анионы - кислоты). К ним относятся комплексные соли: K2[PtCl4], комплексные кислоты: H2[CoCl4], H2[SiF6].
- гидроксокомплексы (ОН), например: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.
- карбонилы - комплексные соединения, в которых лигандами являются молекулы оксида углерода (II): [Fe(CO)5], [Ni(CO)4].
- комплексы с макроциклическими лигандами, внутри которых размещается центральный атом (хлорофилл, гемоглобин, цианокобаламин).
4. По внутренней структуре комплекса:
- моноядерные – если комплекс содержит только один атом металла --комплексообразователя (пример, PdCl4 – имеет один атом палладия);
- многоядерные или полиядерные – если он содержит два или более атомов металла (комплекс платины [Pt2(NH3)2Cl4] – содержащий два атома платины.
30. Металлоферменты – это ферменты класса протеидов, для каталитического действия которых необходимы ионы металлов.

Гемоглобин состоит из 4 субъединиц (имеет четвертичный уровень организации белковой части) и включает четыре гем-группы. Миоглобин сходен с гемоглобином по строению, но содержит только одну субъединицу (третичный уровень организации белковой части молекулы) и одну гем-группу. К числу ферментов, катализирующих окислительно-восстановительные реакции, относятся гемсодержащие ферменты - цитохромы.
31. Под поверхностной энергией понимается энергия Гиббса (Gs) - образования поверхности. Она равна произведению удельной поверхностной энергии σ на площадь поверхности раздела фаз S:
Gs=σ×S
Поверхностное натяжение σ − важнейшая термодинамическая характеристика поверхности раздела фаз, определяемая как работа обратимого изотермического образования единицы площади этой поверхности.
Сорбция (от лат. sorbeo – поглощаю) − поглощение твёрдым телом или жидкостью вещества из окружающей среды. Поглощающее тело называется сорбентом, поглощаемое им вещество − сорбатом
Абсорбция − поглощение веществ из газовой смеси жидкостями.
Адсорбция − процесс концентрирования вещества из объема фаз на границе их раздела.
32.Адсорбция на границе раздела твердое тело – жидкость.
При адсорбции на границе раздела твердое тело − жидкость величина избытка адсорбируемого вещества становится функцией молярной концентрации раствора
Дата добавления: 2018-08-06; просмотров: 321; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
