ОКРЕМІ ПРЕДСТАВНИКИ АМІНОКИСЛОТ
ОДЕСЬКИЙ ДЕРЖАВНИЙ АГРАРНИЙ УНІВЕРСИТЕТ
Кафедра садівництва, виноградарства, біології та хімії
Завдання для самостійної роботи студентів
з дисципліни «Органічна хімія»
Частина ІV
«НІТРОГЕНВМІСНІ СПОЛУКИ»
До уваги студентів!
Кожен студент виконує самостійне завдання
тільки згідно свого варіанту.
При виконанні самостійних завдань студенту доцільно
користуватись конспектом лекцій, додатками
та підручником.
Одеса - 2018
АМІНИ. АМІДИ КИСЛОТ
Аміни та аміди кислот - це органічні сполуки, що містять у молекулі аміно-групу. Аміни - похідні від аміаку (NН3). Аміди – похідні від органічних кислот.
Загальні формули амінів:
- первинний R—NН2
- вторинний R—NН—R
- третинний R—N—R
|
R
- ароматичний

Загальна формула аміду кислоти:

Робота 10.
АМІНИ. АМІДИ КИСЛОТ
Завдання 1.Запишіть структурні формули вказаних речовин та вкажіть їх тип.
| № варіанту | Назва сполуки | № варіанту | Назва сполуки |
| 1 | метиламін, дипропіламін | 16 | дипропіламін, феніламін |
| 2 | диметиламін, етиламін | 17 | метиламін, дифеніламін |
| 3 | пропіламін, дифеніламін | 18 | диметиламін, триметиламін |
| 4 | диетиламін, анілін | 19 | бутиламін, метилпропіламін |
| 5 | триметиламін, етиламін | 20 | етиламін, диметиламін |
| 6 | пропіламін, метилетиламін | 21 | метилпропіламін, феніламін |
| 7 | дипропіламін, феніламін | 22 | триметиламін, пропіламін |
| 8 | диметиламін, триметиламін | 23 | дтиламін, анілін |
| 9 | метиламін, дифеніламін | 24 | діетиламін, трифеніламін |
| 10 | бутиламін, метилпропіламін | 25 | пропіламін, метилетиламін |
| 11 | етиламін, диметиламін | 26 | триметиламін, етиламін |
| 12 | метилпропіламін, феніламін | 27 | диетиламін, анілін |
| 13 | триметиламін, пропіламін | 28 | пропіламін, дифеніламін |
| 14 | дтиламін, анілін | 29 | диметиламін, етиламін |
| 15 | діетиламін, трифеніламін | 30 | метиламін, дипропіламін |
Завдання 2.Складіть слідуючи схеми реакцій та назвіть їх продукти для вказаних речовин у завданні 1:
|
|
|
а) взаємодія з водою;
б) взаємодія з хлоридною кислотою.
АМІНОКИСЛОТИ
Амінокислотами називають органічні сполуки, що містять у молекулі карбоксильну групу, а в радикалі – аміногрупу.
Загальна формула: R – СООН
|
|
|
|
NН2
Класифікація. Число карбоксильних груп визначає основність амінокислот. За кількістю аміногруп в радикалі розрізняють моноамінокислоти та диамінокислоти.
Номенклатура.Головною функціональною групою амінокислот є карбоксильна група –СООН.
Номенклатура. У назві амінокислоти вказується положення аміногрупи відносно карбоксилу, яке позначається цифрами 1,2,3... або буквами грецького алфавіту α, β, γ, δ, ε… (дивись додатки 1, 2). Наприклад:
α
СН3-СН-СООН
|
NН2
Назва за номенклатурою ІЮПАК: 2-амінопропанова кислота
Тривіальні назви: α-амінопропанова кислота або аланін.
Ізомерія амінокислот пов'язана з положенням аміногруп і з будовою вуглецевого ланцюга. Наприклад:
3 2 1 3 2 1
СН3-СН-СООН СН2-СН2-СООН
|
|
|
| |
NН2 NН2
2-амінопропанова кислота 3-амінопропанова кислота
Атом карбону, з’єднаний з аміногрупою, в молекулі α – амінопропанової кислоти є асиметричним. Тому для амінокислот характерна оптична ізомерія.
Фізичні властивості. Амінокислоти безбарвні кристалічні речовини. У природі більше розповсюджені α – амінокислоти L ряду. Такі кислоти гіркі на смак, або не мають смаку. Амінокислоти D-ряду, як правило, солодкі на смак.
Хімічні властивості.Амінокислоти проявляють властивості амінів і органічних кислот (амфотерні властивості).
1.Дисоціація амінокислот. Амінокислоти амфотерні сполуки. Наявність карбоксильної групи надає молекулі кислотні властивості, наявність аміногрупи – основні. Кислотні і основні групи в середині молекули взаємодіють одна з одною, в результаті чого утворюється біполярний іон (внутрішня сіль, цвіттер-іон):
СН2-СООН ↔ СН2-СОО‾
| |
|
|
|
NН2 NН3+
Гліцин внутрішня соль Гліцину
(α-амінооцтова кислота)
Дисоціація карбоксильних груп полягає у відщепленні іонів Н+, наприклад: (–СООН↔ СОО‾ + Н+),
а дисоціація аміногруп полягає у приєднанні іонів Н+, наприклад:
(–NН2 + Н+ ↔ NН3+).
У нейтральному середовищі дисоціацію аміногрупи розглядають як взаємодію з водою, наприклад: –NН2 + НОН → NН3+.
2. Реакції за рахунок карбоксильної групи.Подібно до карбонових кислот утворюють солі, складні ефіри (естери), хлорангідриди. Наприклад:
а) СН2-СООН + NаОН → СН2-СООNа + Н2О
| |
NН2 NН2
натрієва сіль Гліцину
б) СН2-СООН +РCl5 → СН2-СОCl + НCl + РОCl3
| |
NН2 NН2
хлорангідрид Гліцину
в) СН2-СООН + НО-С2Н5 → СН2-СО-О-С2Н5 + Н2О
| |
NН2 NН2
етиловий естер Гліцину
3. Реакції за рахунок аміногрупи. Подібно до амінів утворюють солі з мінеральними кислотами (НСІ, Н2SO4) та гідроксикислоти (з HNO2). Наприклад:
а) СН2-СООН + НCl → СН2-СООН
| |
NН2 NН2 ·НCl
хлорид Гліцину
б) СН2-СООН + НО-NО → СН2-СООН + N2 + Н2О
| |
NН2 ОН
α-гідроксиоцтова кислота
ОКРЕМІ ПРЕДСТАВНИКИ АМІНОКИСЛОТ
(дивись додатки 1, 2)
Гліцин, глікокол (амінооцтова кислота, аміноетанова кислота) –перша амінокислота виділена із желатини при гідролізі.Безбарвна кристалічна речовина, розчинна у воді, солодка на смак. У великій кількості міститься у білках натурального шовку, желатини.
Аланін (α – амінопропанова кислота) –перша амінокислота,яку отримали штучним шляхом. Безбарвна кристалічна речовина.L – Аланін входить до складу всіх білків.
Цистин –у великій кількості знаходиться у білках волосся, вовни, пір’я.
Глютамінова кислота (α – аміноглутарова кислота).Безбарвна кристалічна речовина. Сіль глютамінової кислоти (глутамат натрію) має смак м’яса, тому застосовується у якості смакової приправи у харчовій промисловості.
Лізин (α, ε – діамінокапронова кислота) –незамінна амінокислота.Недостатній вміст лізину викликає ослаблення організму тварин і людей.
Робота 11.
АМІНОКИСЛОТИ
(При виконанні завдань цієї теми користуйтесь Додатком 1)
Завдання 1. Складіть схему електролітичної дисоціації для вказаної амінокислоти у нейтральному середовищі. Вкажіть реакцію середовища, що утворилась внаслідок дисоціації та область значень рН (рН = 7 нейтральне, рН < 7 кисле, рН > 7 лужне середовище).
| № варіанту | Назва сполуки | № варіанту | Назва сполуки |
| 1 | валін | 16 | 2,4-диаміновалеріанова |
| 2 | глутамінова кислота | 17 | метіонін |
| 3 | аланін | 18 | α,γ-диаміногексанова кислот |
| 4 | аспарагінова кислота | 19 | треонін |
| 5 | цистеїн | 20 | 3-аміноянтарна кислота |
| 6 | 2,4-диамінобутанова кислота | 21 | гліцин |
| 7 | лейцин | 22 | β-аміномасляна кислота |
| 8 | 3-аміногептанова кислота | 23 | валін |
| 9 | лізин | 24 | 4-аміногексанова кислота |
| 10 | 2-аміномалонова кислота | 25 | фенілаланін |
| 11 | ізолейцин | 26 | α-амінопропіонова кислота |
| 12 | α,γ-диаміновалеріанова кислота | 27 | глутамінова кислота |
| 13 | фенілаланін | 28 | α-амінооцтова кислота |
| 14 | 2,5-диаміногексанова кислота | 29 | лейцин |
| 15 | гліцин | 30 | аспарагінова кислота |
Рекомендації до виконання завдання 1:
1) Запишіть структурну формулу амінокислоти, визначте кількість функціональних груп (-СООН та –NН2 ), схему дисоціації амінокислоти записують враховуючи дисоціацію всіх функціональних груп молекули.
2) Визначте реакцію середовища, що утворилась за наявністю записаних у правій частині рівняння іонів Н+ (кисле) або ОН– (лужне) середовище. Якщо надлишок вказаних іонів не утворився – середовище нейтральне.
Реакція середовища, що утворилась внаслідок дисоціації, визначається співвідношенням кількості карбоксильних та аміногруп у молекулі.
НАПРИКЛАД:
а) кількість карбоксильних груп дорівнює кількості аміногруп:
НООС–СН–СН–СООН ↔ –ООС–СН–СН–СОО–
| | | |
NН2 NН2 NН3+ NН3+
нейтральне середовище, рН =7.
б) кількість карбоксильних груп більша, ніж кількість аміногруп:
НООС–СН2 –СН–СООН ↔ –ООС–СН–СН–СОО– + Н+
| |
NН2 NН3+
кисле середовище, рН < 7
(утворились вільні іони Н+)
в) кількість аміногруп більша, ніж кількість карбоксильних груп.
В процесі дисоціації вода бере участь як хімічний реагент:
Н3С–СН–СН–СООН + НОН ↔ Н3С–СН–СН–СОО– + ОН–
| | | |
NН2 NН2 NН3+ NН3+
лужне середовище, рН > 7
(утворились вільні іони ОН–)
Завдання 2. Складіть слідуючи схеми реакцій для даної амінокислоти з вказаними реагентами та назвіть їх продукти.
| № варіанту | Назва амінокислоти | Реагенти |
| 1 | 3–амінобутанова кислота | а) НCl; б) КОН; в) етанол |
| 2 | валін | а) Н2SО4; б) NаОН; в) НNО2 |
| 3 | β–аланін | а) Н3РО4; б) КОН; в) метанол |
| 4 | 2–амінобутанова кислота | а) НВr; б) Са(ОН)2; в) етанол |
| 5 | лейцин | а) Н2SО4; б) КОН; в) пропан-1-ол |
| 6 | аспарагінова кислота | а) НCl; б) NаОН; в) пропан-2-ол |
| 7 | γ–аміномасляна кислота | а) Н3РО4; б) Ва(ОН)2; в) НNО2 |
| 8 | β–аміновалеріанова кислота | а) НЈ; б) КОН; в) пропанол-1 |
| 9 | 4–аміногептанова кислота | а) НСlО4; б) NаОН; в) бутан-1-ол |
| 10 | 3–амінопропанова кислота | а) НВr; б) Ва(ОН)2; в) НNО2 |
| 11 | β–аміномасляна кислота | а) Н2SО4; б) NаОН; в) бутан-2-ол |
| 12 | 2–аміногексанова кислота | а) НРО3; б) Са(ОН)2; в) NН3 при нагріванні |
| 13 | 4–аміногептанова кислота | а) НCl; б) NаОН; в) бутан-1-ол |
| 14 | 3–аміногептанова кислота | а) НСlО4; б) Ва(ОН)2; в) пропан-1-ол; |
| 15 | ізолейцин | а) НВr; б) КОН; в) етанол |
| 16 | глутамінова кислота | а) НЈ; б) NаОН; в) НNО2 |
| 17 | α–аміномасляна кислота | а) НВr; б) Ва(ОН)2; в) етанол |
| 18 | лейцин | а) Н2SО4; б) NaОН; в) NН3 при нагріванні |
| 19 | аспарагінова кислота | а) НCl; б) KОН; в) пропан-1-ол |
| 20 | γ–аміномасляна кислота | а) Н3РО4; б) Cа(ОН)2; в) НNО2 |
| 21 | 3–амінопентанова кислота | а) НЈ; б) NaОН; в) пропан-2-ол |
| 22 | γ–амінокапронова кислота | а) НСlО4; б) KОН; в) NН3 при нагріванні |
| 23 | β–амінопропіонова кислота | а) НВr; б) Cа(ОН)2; в) НNО2 |
| 24 | 3–амінобутанова кислота | а) Н2SО4; б) NаОН; в) бутан-1-ол |
| 25 | α–амінокапронова кислота | а) НРО3; б) Bа(ОН)2; в) NН3 при нагріванні |
| 26 | γ–аміновалеріанова кислота | а) НCl; б) NаОН; в) бутан-2-ол |
| 27 | 4–аміногептанова кислота | а) НСlО4; б) Ва(ОН)2; в) NаОН; |
| 28 | ізолейцин | а) НВr; б) NaОН; в) етанол |
| 29 | глутамінова кислота | а) НЈ; б) KОН; в) НNО2 |
| 30 | 2–амінобутанова кислота | а) НВr; б) Са(ОН)2; в) NН3 при нагріванні |
БІЛКИ
Білки –складні високомолекулярні органічні сполуки побудовані із залишків α-амінокислот, що з'єднані між собою пептидними зв'язками (-NН-СО-). До складу одного білку входять різні амінокислоти. При повному гідролізі білок перетворюється на суміш амінокислот.
Класифікація білків.Серед білків розрізняють дві основних групи речовин:
1) протеїни (прості білки) - складаються тільки із α-амінокислот і при гідролізі інших речовин не утворюють;
2) протеїди (складні білки) - складаються із білкової частини, яка складається із α–амінокислот, з’єднаної з небілковою частиною. До складу небілкової частини входять: вуглеводи, фосфатна кислота, гетероцикли.
Білки відіграють вирішальну роль в процесах обміну і розмноження клітин.
 Будова білків. До складу білків входять 25 різних амінокислот, які мають різну структуру:
Будова білків. До складу білків входять 25 різних амінокислот, які мають різну структуру:
- Первинна структура - амінокислоти послідовно з'єднані між собою утворюють лінійний ланцюг за рахунок пептидного зв’язку.
 - Вторинна структура - білкові молекули скручуються у спіралі за рахунок взаємодії молекул одна з одною з утворенням міжмолекулярних водневих зв'язків.
- Вторинна структура - білкові молекули скручуються у спіралі за рахунок взаємодії молекул одна з одною з утворенням міжмолекулярних водневих зв'язків.
α-спіраль вторинної структури

- Третинна структура - поліпептидні молекули з'єднуються між собою з утворенням амідних, дисульфідних, водневих зв'язків за рахунок бокових ланцюгів амінокислот. В результаті чого спіраль закручується в клубок (глобула).
 - Четвертинна структура - поліпептидні молекули білка з'єднуються між собою з утворенням міцних комплексів за рахунок взаємодії між різними поліпептидними ланцюгами, наприклад - гемоглобін.
- Четвертинна структура - поліпептидні молекули білка з'єднуються між собою з утворенням міцних комплексів за рахунок взаємодії між різними поліпептидними ланцюгами, наприклад - гемоглобін.

Властивості білків. Більшість білків розчинні у воді, але утворюють не істинні розчини, а колоїдні.
Ізоелектрична точка білків (pI) - кислотність середовища (pH), при якій певна молекула або поверхня не несе електричного заряду (електронейтральна).
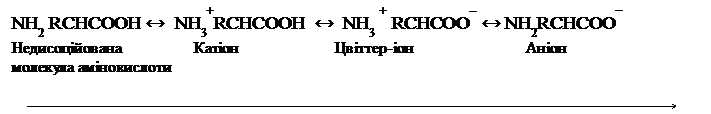
збільшення рН
Білкові речовини, як і амінокислоти, у водному середовищі проявляють амфотерні властивості, тобто вони ведуть себе і як кислоти, маючи карбоксильні групи, і як основи завдяки наявності аміно-груп.
При ізоелектричній точці молекула білка електронейтральна і не пересувається в електричному полі. У такому стані молекули білка легко випадають в осад, цю властивість використовують для поділу білкових речовин при сумісній присутності. Більшість білків мають ізоэлектричну точку при рН від 4,0 до 8,0. Однак якщо розчин білка підкисляти, то його кислотна дисоціація буде придушувати, білок заряджається позитивно, утворюється катіон білка. Якщо додавати луг, то лужна дисоціація білка буде придушувати, білок заряджається негативно, з'явиться аніон білка. Отже, поведінка білків в електричному полі буде залежати від їх амінокислотного складу, що і використовують для розділення білків фракції при електрофорезі.
Якщо у білках переважають амінокислоти, що містять по дві карбоксильні групи (глутамінова і аспарагінова кислоти), такі білки в електричному полі будуть пересуватися до анода ( + ), а білки, які містять основні амінокислоти (аргінін, лізин і гістидин), будуть пересуватися до катода ( -). Розрізняють електрофорез на гелях - крохмальному, агарному, поліакриламідному і т. д.
| Білок | Ізоелектрична точка білків (pI) |
| Пепсин шлункового соку | 1 - 2,08 |
| Альбумін сиворотки крові | 4,64 |
| Казеїн молока | 4,6 |
| Альбумін курячого яйця | 4,7–4,8 |
| a-Глобулін крові | 4,8 |
| Міозин м’язів | 5,0 |
| b-Глобулін крові | 5,2 |
| Фібріноген крові | 5,4 |
| g-Глобулін крові | 6,4 |
| Гемоглобін | 6,8 |
| Каталаза крові | 7,0 |
| Хімотрипсин соку підшлункової залози | 8,6 |
Застосування білків. Білки входять до складу харчових продуктів. Організм дорослої людини повинен одержувати кожен день близько 100 г білків.
В рослинах білки синтезуються із неорганічних сполук, в організмі тварин і людини із амінокислот, що надходять до організму людини з їжею у вигляді рослинних або тваринних білків. Є замінні амінокислоти (гліцин, аланін, орнітин) і незамінні (валін, лейцин, лізин, ізолейцин, треонін, метіонін, фенілаланін, триптофан). Дітям необхідна ще одна незамінна амінокислота – аргінін (дивись додаток 2).
Незамінні амінокислоти в організм людини і тварини надходять з їжею. В добовому раціоні людина повинна отримувати 21-31 г незамінних амінокислот. Найбільш повноцінна по набору амінокислот їжа тваринного походження (м’ясо, риба, яйця, молоко тощо). Невеликий вміст незамінних амінокислот характерний для білків рослинного походження. Так, неповноцінними білками вважаються: горох (не містить триптофану), зеїн кукурудзи (не містить лізину), соя (малий вміст лізину) тощо.
Робота 12. БІЛКИ
(При виконанні завдань цієї теми користуйтесь Додатком 1)
Завдання 1. Складіть схеми реакцій утворення дипептиду (а) та трипептиду (б) з вказаних амінокислот.
| № варіанту | Назви амінокислот | |
| 1 | а) аланін, гліцин | б) гліцин, лейцин, ізолейцин |
| 2 | а) валін, гліцин; | б) аланін, цистеїн, лізин |
| 3 | а) гліцин, валін | б) аланін, валін, лейцин |
| 4 | а) аланін, серин | б) гліцин, лейцин, валін |
| 5 | а) гліцин, фенілаланін | б) лейцин, валін, гліцин |
| 6 | а) гліцин, триптофан | б) лейцин, глутамінова кислота, валін |
| 7 | а) аланін, валін | б) лейцин, валін, гліцин |
| 8 | а) валін, лейцин | б) лейцин, аланін, валін |
| 9 | а) гліцин, фенілаланін | б) аланін, цистеїн, гліцин |
| 10 | а) серин, аланін | б) аланін, лізин, серин |
| 11 | а) валін, гліцин | б) лейцин, лізин, гліцин |
| 12 | а) фенілаланін, лейцин | б) серин, гліцин, лейцин |
| 13 | а) серин, глутамінова кислота | б) аланін, валін, лейцин |
| 14 | а) цистеїн, валін | б) серин, лейцин, лізин |
| 15 | а) ізолейцин, серин | б) серин, лейцин, лізин |
| 16 | а) триптофан, гліцин | б) валін, серин, аланін |
| 17 | а) аланін, гліцин | б) гліцин, лейцин, ізолейцин |
| 18 | а) валін, гліцин; | б) аланін, цистеїн, лізин |
| 19 | а) гліцин, валін | б) аланін, валін, лейцин |
| 20 | а) аланін, серин | б) гліцин, лейцин, валін |
| 21 | а) гліцин, фенілаланін | б) лейцин, валін, гліцин |
| 22 | а) гліцин, триптофан | б) лейцин, глутамінова кислота, валін |
| 23 | а) валін, гліцин | б) лейцин, лізин, гліцин |
| 24 | а) фенілаланін, лейцин | б) серин, гліцин, лейцин |
| 25 | а) серин, глутамінова кислота | б) аланін, валін, лейцин |
| 26 | а) цистеїн, валін | б) серин, лейцин, лізин |
| 27 | а) ізолейцин, серин | б) серин, лейцин, лізин |
| 28 | а) триптофан, гліцин | б) валін, серин, аланін |
| 29 | а) валін, гліцин | б) лейцин, лізин, гліцин |
| 30 | а) фенілаланін, лейцин | б) серин, гліцин, лейцин |
Рекомендації до виконання завдання 1:
Кожна амінокислота має дві функціональні групи, які можуть брати участь в утворенні пептидних зв’язків: карбоксильну групу – СООН та α – аміногрупу – NН2. Згідно з прийнятими правилами, та амінокислота, яка дає на утворення пептичного зв’язку групу –СООН , записується першою, а та, яка дає групу – NН2 записується наступною. Тому формули амінокислот в рівняннях реакцій записуйте строго в тій послідовності, в якій записано їх назви в умові завдання.
Для зручності всі формули амінокислот (крім першої) рекомендуємо записувати у такій формі: О
||
НNН – СН - С – ОН (де R – радикал)
|
R
НАПРИКЛАД:
Скласти схему реакції утворення дипептиду з двох α-амінокислот: гліцин, аланін
О О О О
|| || || ||
 Н2N – СН2 –С – ОН+НNН – СН – С – ОН→Н2N – СН2 –С –NН – СН – С – ОН + Н2О
Н2N – СН2 –С – ОН+НNН – СН – С – ОН→Н2N – СН2 –С –NН – СН – С – ОН + Н2О
| |

 СН3 СН3
СН3 СН3
гліцин аланін гліцил-аланін
(дипептид)
Завдання 2.Складіть схему повного гідролізу для вказаного трипептиду.
| № варіанту | Назва трипептиду | № варіанту | Назва трипептиду |
| 1 | Валіл-гліцил-серин | 16 | Фенілаланіл-цистеїл-гліцин |
| 2 | Гліцил-цистеїл-валін | 17 | Аланіл-серил-ізолейцин |
| 3 | Валіл-лейцил-аланін | 18 | Лізил-лейцил-гліцин |
| 4 | Гліцил-валіл-серин | 19 | Лейцил-фенілаланіл-серин |
| 5 | Гліцил-лейцил-аланін | 20 | Серил-лейцил-аланін |
| 6 | Лейцил-валіл-глутамін | 21 | Аланіл-гліцил-валін |
| 7 | Гліцил-лейцил-аланін | 22 | Серил-ізолейцил-лейцин |
| 8 | Лейцил-валіл-аланін | 23 | Аланіл-глутамініл-валін |
| 9 | Фенілаланіл-цистеїл-гліцин | 24 | Валіл-гліцил-серин |
| 10 | Аланіл-серил-ізолейцин | 25 | Гліцил-цистеїл-валін |
| 11 | Лізил-лейцил-гліцин | 26 | Валіл-лейцил-аланін |
| 12 | Лейцил-фенілаланіл-серин | 27 | Гліцил-валіл-серин |
| 13 | Серил-лейцил-аланін | 28 | Гліцил-лейцил-аланін |
| 14 | Аланіл-гліцил-валін | 29 | Лейцил-валіл-глутамін |
| 15 | Серил-ізолейцил-лейцин | 30 | Гліцил-лейцил-аланін |
Рекомендації до виконання завдання 2:
1) Запишіть назву три пептиду та розділіть його на фрагменти, що відповідають окремим амінокислотам: гліцил-аланіл-серин. Запис показує, що даний трипептид складається із залишків гліцину, аланіну та серину, з’єднаних послідовно між собою пептидними зв’язками.
2) Користуючись додатком, запишіть формулу трипептиду та його реакцію з водою. Врахуйте, що для розриву двох пептидних зв’язків необхідні дві молекули води. Внаслідок гідролізу однієї молекули трипептиду утворюються три молекули амінокислот.
НАПРИКЛАД:
О О
|| ||
СН2 –С –NН – СН – С – NН – СН- СООН + 2 Н2О →
| | |
 NН2 СН3 СН2 – ОН
NН2 СН3 СН2 – ОН
Дата добавления: 2018-08-06; просмотров: 136; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
