Определить адиабатическую температуру горения
Этилового спирта в воздухе
Решение: Расчет проводим по схеме, приведенной в табл.2.3.
1. Так как горючее индивидуальное, для определения объема и состава продуктов горения запишем уравнение химической реакции горения:
С2Н5ОН+3О2+3∙3,76N2=2СО2+3Н2О+3∙3,76N2,
следовательно, продукты горения состоят из:
Vco2=3 моля, VН2О=3 моля, VN2=11,28моля, VПr=17,28 моля.
2. Низшую теплоту сгорания определим по формуле (2.2) Из табл.3приложениянаходим теплоту образования горючего- 278,2кДж/моль: Qн=3∙396,9+3∙242,2-278,2=1639,1 кДж/моль;
3. Средняя энтальпия продуктов горения:
∆Н ср = 
4. Так как ∆Н ср выражена в кДж/моль, по табл.1приложения выбираем, ориентируясь на азот, первую приближенную температуру горения Т1=25000С
5. Рассчитаем теплосодержание продуктов горения при 25000С по формуле (2.13):
Q1пr=139,9∙3+115,1∙3+85,1∙11,28=1687,2 кДж/моль;
Сравниваем Qн и Qпr,так как Qпr>Qн выбираем температуру горения равной 24000С.
6. Рассчитываем теплосодержание продуктов горения при температуре равной 24000С:
Q2пr=133,0∙3+109,6∙3+81,5∙11,28=1646,7 кДж/моль; так как Q2пr>Qн, принимаем температуру равной 23000С
Q3пr=126,9∙3+104,1∙3+77,8∙11,28=1570,6 кДж/моль.
7. Так как Q3пr<Qн<Q2пrопределим температуру горения:
Тr*=2300+  0C
0C
Определить адиабатическую температуру горения органической массы, состоящей из: С-60%, Н-7%, О-25%, W-8%.
Решение:
1. Так как горючее представляет собой сложное вещество, состав продуктов горения рассчитываем по формулам(1.16 и 1.19):
|
|
|
Vco2=1.86∙60/100+1,12 м3/кг;
VН2О=11,2 ∙7/100+1,24∙8/100=0,88 м3/кг;
VN2=1/100∙7∙60+21(7-25/8)=5,01 м3/кг
2. Общий объем продуктов горения равен: VПr=7,01 м3/кг.
3. Определим низшую теплоту сгорания вещества по формуле Д.И.Менделеева (2.3):
Qн=339,4∙60+1157∙7-108,9∙25-25,1(9∙7+8)=23958,4 кДж/кг;
4. Определим среднюю энтальпию продуктов горения:
∆Н ср =23958,4/7,01=3417,7кДж/м3
5. Так как величина энтальпии рассчитана в кДж/м3. первую приближенную температуру выбираем по табл.2 приложения. Ориентируясь на азот, принимаем Т1=21000С
6. Рассчитаем теплосодержание продуктов горения при 21000С по формуле (2.13):
Qпр=5118,2∙1,12+4166,1∙0,88+3142,9∙5,01=25144,5 кДж/кг
7. Из сравнения Qн и Qпr,так как Qн  Qпр выбираем вторую приближенную температуру 19000С. Рассчитываем теплосодержание продуктов горения при 19000С:
Qпр выбираем вторую приближенную температуру 19000С. Рассчитываем теплосодержание продуктов горения при 19000С:
Q2пr=5118,2∙1,12+3693,5∙0,88+2818,2∙5,01=22498,8 кДж/кг
8. Так как Q2пr  Qн<Q1пrопределим температуру горения:
Qн<Q1пrопределим температуру горения:
Тr*=1900+ 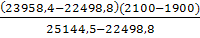 =20100С
=20100С
Рассчитать действительную температуру горения фенола
(∆Нобр=4,2 кДж/моль), если потери тепла излучением составили 25% от Qн,, а коэффициент избытка воздуха при горении – 2,2
Решение:
1. Определим состав продуктов горения:
|
|
|
С6Н5ОН+7О2+7∙3,76N2;
Vco2=6 моль,
VН2О=3 моля,
VN2=26,32моля,
∆Vв=(7+7∙3,76)(2,2-1)=39,98 моля,
VПr=75,3моля.
2. Определим низшую теплоту сгорания фенола (формула2.2):
Qн=7∙396,9+3∙242,2-1∙4,2=3500,7 кДж/моль.
3.Так как по условию задачи 25%тепла теряется, то определим количество тепла, пошедшее на нагрев продуктов горения (теплосодержание продуктов горения при температуре горения)(формула 2.11.):
Qпr=33500,7 (1-0,25)=2625,5 кДж/моль
4. По формуле(2.15)определим действительную температуру горения:
Тr=273+2625,5/10-3∙(50,85∙6+39,87∙3+31,81∙26,32+32,26∙39,98) =1302К.
Контрольные задачи
5. Определить как изменяется адиабатическая температура горения в гомологическом ряду предельных углеводородов(на примере метана, пропана, пентана, гептана). Построить график зависимости температуры горения от молекулярной массы горючего вещества.
6. Определить, как изменится адиабатическая температура горения древесины состава: С-49%, Н-8%, О-43%, если содержание влаги (сверх100%)составляет 0% ; 5%; 15%. Построить график зависимости температуры горения от влажности горючего
Примечание : при решении задачи необходимо состав древесины пересчитать так , чтобы количество всех компонентов ( в том числе воды) составляло 100%.
|
|
|
7. Определить: как измениться адиабатическая температура горения бензола в воздухе и окислительной среде, содержащей 25;30;40% кислорода. Построить график зависимости температуры горения от содержания кислорода.
8. Рассчитать действительную температуру горения газовой смеси, состоящей из 45%Н2; 30%С3Н8;15% О2; 10% N2, если потери тепла составили 30% от Qн, а коэффициент избытка воздуха при горении равен 1,8.
9. Определить количество сгоревшего антрацита (С=100%) в помещении объемом 180м3, если среднеобъемная температура возросла с 305 до 625К.
10. Рассчитать действительную температуру горения бутано- воздушной смеси стехиометрической концентрации и на нижнем концентрационном пределе воспламенения (1,9% бутана и 98,1% воздуха), если потери тепла излучением составили 20%от низшей теплоты сгорания.
11. Определить как измениться температура горения ацетилена при разбавлении его азотом в количестве 10; 20; 30%, если потери тепла излучением составляют25% от низшей теплоты сгорания. Коэффициент избытка воздуха-1.2. Построить график зависимости температуры горения от содержания азота в ацетилене.
|
|
|
12. Определить время горения толуола, при котором температура в помещении объемом 400м3повыситься с 295 до 375К, если скорость его выгорания 0,015кг/(м2с), а площадь пожара 50 м3. При расчете пренебречь приращением объема продуктов горения над расходуемым воздухом.
Домашнее задание 3
Рассчитать температуру горения i-го вещества (табл. 2.4)
Таблица 2.4.
Дата добавления: 2018-08-06; просмотров: 5194; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
