Соли ЩЗМ и беррилия (привожу самые популярные реакции)
Katyal
Химия элементов:
«Щелочноземельные металлы»
Щелочноземельные металлы (2а группа)
Физические свойства:
Общие характеристики: высокая тепло и электропроводность, температуры кипения и плавления выше, чем у ЩМ.
Be – металл серо-стального цвета, достаточно твердый и хрупкий. На воздухе Be покрывается оксидной пленкой, что придает ему матовый оттенок и снижает его химическую активность.
Mg – серебристо-белый блестящий металл, сравнительно мягкий и пластичный, хороший проводник тепла и электричества.
Ca, Ba и Sr в свободном виде – серебристо-белые металлы. При нахождении на воздухе мгновенно покрываются желтоватой пленкой.
Химические свойства щелочноземельных
Металлов и Be
Хочу отметить некоторые особенности, прежде чем приступать к разбору химических свойств. Щелочноземельные металлы активны (но уже менее, в отличие от щелочных), Mg покрыт оксидной пленкой и тяжело вступает в реакции, его свойства несколько отличаются от ЩЗМ, а Be является амфотерным элементом (двойственные свойства).
ЩЗМ сильные восстановители, поэтому им характерны все свойства металлов!
1. С водой:
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде.
Ca, Sr и Ba растворяются в воде с образованием щелочей:
Mg + 2H2O → Mg(OH)2 + H2↑ (нагревание!)
Ca + 2H2O → Ca(OH)2 + H2↑ (без нагревания!)
|
|
|
2. Реакция с кислородом:
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
2Mg + O2 → 2MgO (окисление кислородом воздуха, оксидная пленка)
Ba + O2 → BaO2
3. С другими неметаллами образуют бинарные соединения (практически везде при нагревании):
Be + Cl2 → BeCl2 (галогениды)
Ba + S → BaS (сульфиды)
3Mg + N2 → Mg3N2 (нитриды)
Ca + H2 → CaH2 (гидриды)
Ca + 2C → CaC2 (карбиды)
3Ba + 2P → Ba3P2 (фосфиды)
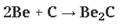 (метанид)
(метанид)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. растворяются в кислотах:
Ca + 2HCl → CaCl2 + H2
Mg + H2SO4(разб.) → MgSO4 + H2
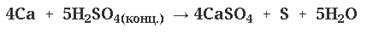
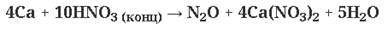
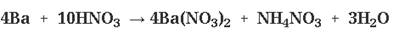 (очень разб. кислота)
(очень разб. кислота)
5. с кислотными оксидами:
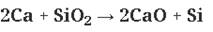
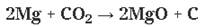
6. Бериллий растворяется в водных растворах щелочей:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 (т.к он амфотерный)
Химические свойства соединений ЩЗМ и Be
1. Оксиды ЩЗМ:
Оксиды всех металлов этой группы имеют основный характер, а оксид Be амфотерный характер.
BeO
В расплаве щелочи:


сплавление с солями:
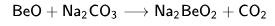
В растворе щелочи:
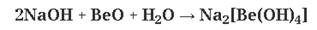
(тетрагидроксоберрилат(||)натрия)
С кислотами:
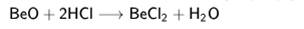
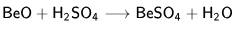
MgO, CaO, SrO, BaO2, RaO:
с водой:
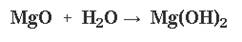
с кислотами:
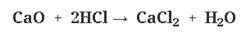
с кислотными оксидами:
MgO+CO2=MgCO3 (сплавление)
CaO+SO2=CaSO3 (сплавление)
2. Гидроксиды ЩЗМ+Be(OH)2
Be(OH)2
со щелочами:
сплавление:
|
|
|
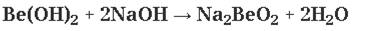
водный раствор:
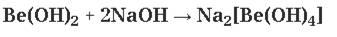
с кислотными оксидами, кислотами:
SO3 + Be(OH)2 → BeSO4 + H2O
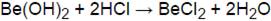
с основными оксидами:
Be(OH)2 + CuO = Cu(OH)2 + BeO
Mg(OH)2, Ca(OH)2, Ba(OH)2, Sr(OH)2
1. С кислотными оксидами, с кислотами:
Mg(OH)2+SO2=MgSO3+H2O
Ca(OH)2+CO2=CaCO3+H2O
Ba(OH)2+HCl=BaCl2+H2O
2. С солями
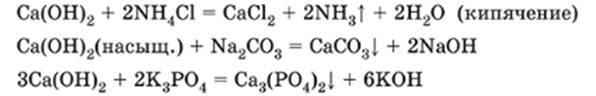
Соли ЩЗМ и беррилия (привожу самые популярные реакции)

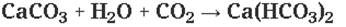
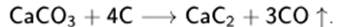

Жесткость воды
В теме ЩЗМ есть отдельный момент, которому я хочу уделить внимание – это жесткость воды.
Различают постоянную и временную жесткости.
ПОСТОЯННАЯ ЖЕСТКОСТЬ ВОДЫ (Присутствие солей, которые простым кипячением удалить нельзя). Обычно это хлориды, сульфаты кальция и магния. MgCl, MgSO4, CaSO4, CaCl)
Способы устранения:
Реакциями ионного обмена, КОТОРЫЕ ОСАЖДАЮТ ИОНЫ КАЛЬЦИЯ И МАГНИЯ.
Добавление соды:

Добавление фосфатов:

ВРЕМЕННАЯ ЖЕСТКОСТЬ ВОДЫ(карбонатная жесткость обусловлена присутствием в воде гидрокарбонатов MgHCO3, CaHCO3).
Способы устранения:
Наша цель – ВЫПОЛНИТЬ ПЕРЕХОД ОТ ГИДРОКАРБОНАТОВ К КАРБОНАТАМ.
Кипячение:
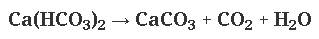
Добавление извести:
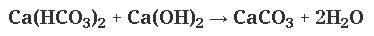
Качественные реакции
Окраска пламени:
Ca2+ — кирпично-красный.
Sr2+ — карминово-красный.
Ba2+ — желтовато-зеленый.
Ra2+ — темно-красный
Дата добавления: 2018-08-06; просмотров: 593; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
